瑋馳祝賀賽橋全封閉細胞處理工藝耗材通過DMF備案
恭喜賽橋生物自主研發生產的一次性全封閉細胞處理工藝耗材通過美國食品藥品監督管理局DMF備案,備案號:MF037783 III類。

DMF的意義
一次性全封閉細胞處理工藝耗材是賽橋生物Gentle Flex多功能全封閉自動化細胞處理系統/Gentle Flex Pro大體積全封閉自動化細胞處理系統配套耗材,已獲得中國國家知識產權局頒發的發明專利證書,并完成在美國FDA的DMF備案。
未來,藥物申報者進行IND申報時,可以直接引用DMF備案資料,大大縮減了審查和評估時間,提高評審效率,加速項目申報流程。如果您需要引用DMF編號,請郵件向賽橋市場部(marketing@cellbri.com)授權申請,收到申請后,我們將向FDA中心提供DMF授權書。
目前,賽橋生物已有多達6項自主研發耗材完成了在美國FDA的DMF備案,詳見下表:
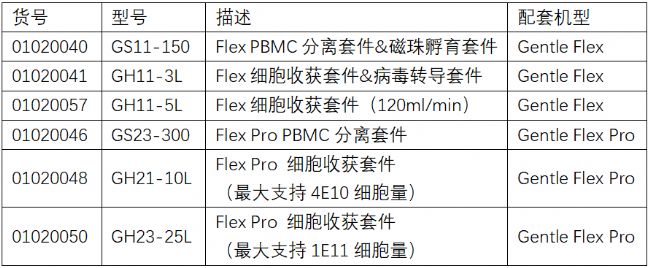
賽橋生物Gentle Flex多功能全封閉自動化細胞處理系統/Gentle Flex Pro大體積全封閉自動化細胞處理系統是一款全自動化、封閉化、數字化、柔性化的細胞處理設備,可以滿足從研發,PD到生產全流程細胞處理工藝。
包括了PBMC分離,磁珠孵育,病毒轉導,濃縮收獲,細胞清洗及分裝過程,每個功能都有多規格GMP一次性全封閉細胞處理工藝耗材。一次性全封閉細胞處理工藝耗材可以在整個細胞處理過程中保持密閉環境,并且提供生物相容性如內毒素,溶析,毒性等檢測報告,保證細胞處理工藝符合法規要求。

藥物主文件,即Drug Master Files(DMF),是提交給FDA的申報資料,資料內容包含生產、加工、包裝和儲存人用藥品中所使用的生產設施、生產工藝等的機密、詳細信息。
根據美國聯邦食品、藥品和化妝品法規定,藥品在上市之前申報者必須向FDA提出相關的申請,比如臨床研究申請(IND)、新藥注冊(NDA)和生物制品許可證申請(BLA)等,并需要提供該藥物在安全性、有效性和質量三方面的全部信息,其中涉及到原料藥、輔料的相關技術內容,但是準備這些材料無疑會耗費大量的時間和精力,同時原料供應商也不愿透漏自己的技術信息,因此嚴重影響臨床申報的進程。
為解決這一問題,FDA建立了DMF體系,原料供應商以DMF文件的形式將所需的技術內容直接交給FDA備案并獲得備案編號,藥物申報者可以直接使用DMF備案編號來代替申報過程中需要提供有關原料和輔料的具體信息,極大程度上縮短了審查和評估時間。
賽橋生物賽橋生物專注于CGT行業上游關鍵制造技術及成套核心工藝裝備的源頭技術創新和國產化工作,致力于實現CGT產業化裝備的全封閉、自動化、數字化和柔性化。現已構建設備與耗材能力平臺,完成全套工藝模塊的開發,包括全封閉自動化血細胞分離、磁珠激活分選、電轉染、細胞擴增、清洗濃縮、制劑分裝等設備,以及配套的系列化GMP一次性密閉耗材。
- 關稅加碼,培安發聲:CEM產品價格不受關稅影響
- Eppendorf 新品CO2培養箱搖床斬獲2025年iF設計獎!
- 武漢谷豐光電高通量盆栽表型檢測平臺在華南農大安裝
- 復旦大學瑞孚迪獎學金項目啟動,簽約儀式順利舉行
- GelNEST™基質膠助力應對貿易壁壘下的科研不確定性
- 無懼關稅!韓國派氏全線液基細胞制片產品助力IVD領域
- FDA宣布逐步取消動物實驗,加速類器官替代進程
- 關稅波動情況下科茲莫關于穩定供應及品質承諾的聲明
- 東樂自然基因榮獲丹納赫生命科學平臺兩項殊榮
- 艾普拜生物:以全流程解決方案,為科研工作者護航
- 中天智感智慧農場全程健康化理念獲農業部交流會關注
- 中山大學王鵬教授榮獲安捷倫ACT-UR研究基金支持
- 德國品質 中國動力——探訪 Eppendorf 中國制造基地
- IPHASE——創新藥體外評價生物試劑國產替代先行者
- 北京雅欣理儀關于應對美國關稅政策的通知
- 關稅波動情況下科茲莫關于穩定供應及品質承諾的聲明
- BIOLOG 推出新品益生元板和厭氧菌培養基優化板
- ibidi micro-Insert 3D微孔插件及培養皿新品來襲
- MD官方商城上線52款試劑耗材新品,限時好禮相送
- 賽默飛開工返校季促銷:高品質細胞培養耗材尊享價
- 耐思一次性筆式注射器獲得加拿大醫療器械許可證
- 康寧公布2024年第四季度及全年強勁財務業績
- ibidi新品:應用于高分辨率顯微鏡成像的6孔培養板
- 2025耐思SCI論文獎勵計劃全新方案發布
- 潔特生物推出新規格2L超大容量培養基方瓶&密閉系統
- 耐思生物網頁版類器官AI大模型分析軟件上線
- 潔特生物精彩亮相2024慕尼黑上海分析生化展
- 潔特生物2024年論文征集進入倒計時,有獎速來
- 凱輝基金領投,百林科順利完成新一輪數億元融資
- 康寧公布2024Q3財報,宣布Springboard計劃重大進展






