逍鵬新品速遞:重組人白蛋白蓄勢待發
“最初,人血白蛋白(Human Serum Albumin, HSA)在戰爭生靈涂炭之時誕生并挽救無數生命。1940年,美國輸血委員會批準白蛋白作為血漿替代物用于臨床,此后廣泛用于各種臨床治療。隨著研究的深入,HSA多功能特性被逐一發現,讓其在各生物領域大展拳腳,然而血液來源白蛋白引起的短缺和安全問題,讓重組HSA(Recombinant Human Serum Albumin, rHSA)進入大家的視野……”
01.
HSA的基礎知識
VivaCell
人血白蛋白(Human Serum Albumin, HSA)顧名思義是在人體血液中發現的血清白蛋白,是人體血漿中含量最多的蛋白質,約占血清蛋白的一半,約35-50g/L(3.5–5.0g/dL),具有維持血液滲透壓、結合和轉運各種分子、清除自由基、調節免疫反應和凝血等重要的代謝作用。
-
穩定性
pH 4-9范圍內穩定,60℃的高溫下耐受10小時。
-
結構
HSA的單多肽含有585個氨基酸,三維(Three dimensions)結構是一個具有三個同源結構域I, II, III的α-螺旋橢球,同源結構域間通過二硫鍵交聯。白蛋白分子結構域內存在不同的藥物結合位點,因此白蛋白具有較高的結合能力,可轉運多種藥物、脂肪酸、膽紅素、離子(Na+、K+、Ca2+)和多種激素。
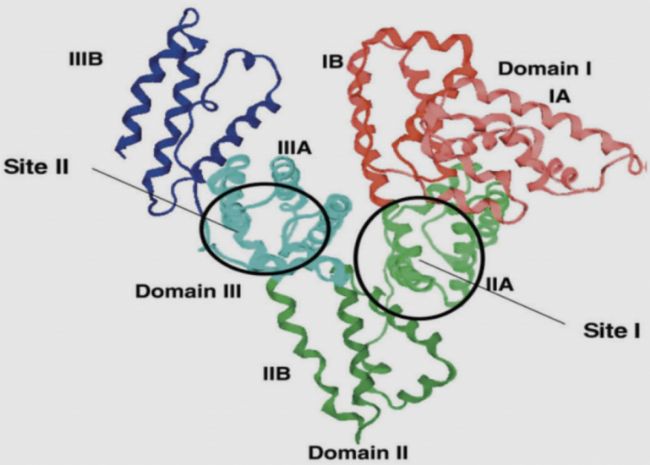
圖1 HSA結構示意圖
(引用自Chuang VTG, Otagiri M. Stereoselective binding of human serum albumin. Chirality. 2006; 18(3): 159–166. )
HSA作為研究最多的蛋白質之一,因其免疫原性低,容易獲得且有良好的生物相容性,在生物學領域被廣泛運用。
02.
HSA的主要來源
VivaCell
-
人血白蛋白
來源受限、成本高、存在批間差異和潛在動物源病毒污染的安全隱患。
-
重組人血白蛋白(Recombinant Human Serum Albumin,rHSA)
基于白蛋白多種特性,其在生物學領域應用頗多,白蛋白的需求量日益增加,人血白蛋白遠遠不能滿足需求,這促使了對rHSA的開發和研究。
-
兩種高效的重組表達系統:酵母和水稻
在過去的幾十年里通過科學家們的嘗試和努力,從多種表達系統中篩選出畢赤酵母和水稻兩種高效的白蛋白表達系統。
水稻表達系統:重組蛋白特異性地在水稻胚乳細胞中表達,因水稻種植規模化簡單,表達體系雜質少純化成本低,安全性高也被廣泛運用。
酵母表達系統:兼具原核和真核表達的優勢,提供多種翻譯后修飾,如蛋白水解加工、折疊和二硫鍵形成,避免不良的翻譯后修飾,是生產具有工業或醫學功能性應用重組蛋白的杰出宿主。
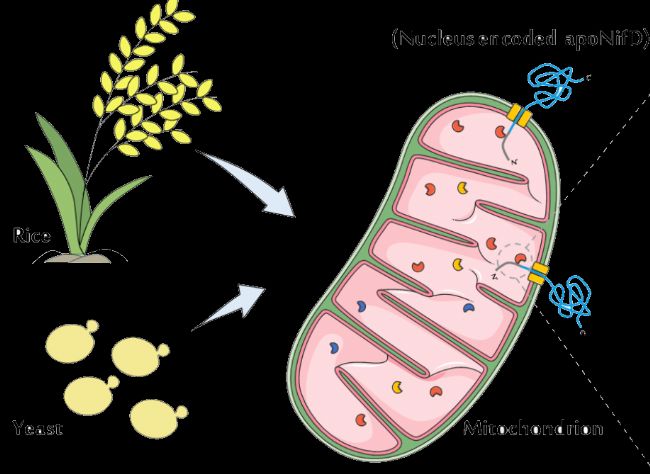
圖2 兩種重組白蛋白表達系統
(圖源網絡)
-
rHSA可替代性
研究表明rHSA與人血白蛋白有相同的結構和生理生化性質,其在細胞培養、藥用輔料及臨床方面的作用完全可替代人血白蛋白。重組人血白蛋白的替代試驗表明,rHSA比人血白蛋白純度高、質量穩定,安全性方面等或許還優于人血白蛋白。國內外一些企業已經或正在使用rHSA替代人血白蛋白作為藥物輔料來提高其產品的安全性,增加市場競爭力。例如默克公司的麻腮風三聯疫苗已經獲得美國FDA批準上市,輔料使用重組人血白蛋白,產品上市多年,尚無相關不良反應的報道。
(圖源網絡)
03.
HSA在不同領域中的應用
VivaCell
臨床用藥:
HSA對于多種疾病的治療具有重要的臨床意義,包括低血容量、休克、手術失血、創傷、急性呼吸窘迫綜合征、血液透析、急性肝衰竭、低蛋白血癥、復蘇等。
-
失血性休克復蘇:在外科手術中,HSA可以減少液體需求,提高血漿膠體滲透壓,減少肺水腫和腸道水腫等。
-
低蛋白血癥:低白蛋白血癥是危重病的常見并發癥。靜脈輸注血清白蛋白可提高血漿膠體滲透壓,促進胃腸道營養的吸收和利用,降低發病率。
-
慢性肝病:研究表明,肝硬化會伴隨機體中有效HSA濃度降低,靜脈注射HSA可以有效治療失代償性肝硬化病癥。另外,HSA可以與血管加壓藥聯合治療肝腎綜合征,提高治療效果,降低復發率。
醫療器械涂層:
在臨床應用中,多種醫療器械不可避免會與血液直接接觸。非涂層醫療器械通常會將血漿蛋白(如纖維蛋白原)吸附在其表面,被吸附的蛋白進一步介導血小板聚集,形成血小板-纖維蛋白血栓,從而誘導炎癥和凝血反應甚至威脅使用者的生命。
-
HSA特性及應用
HSA被證明具有抗血栓和抗腐蝕的特性,還能夠提供抗氧化保護,防止內皮細胞凋亡。因此,HSA涂層也被應用于各種生物材料。研究表明,動脈血管假體材料滌綸用于動脈置換會容易引發血栓。將移植物涂覆交聯白蛋白涂層后發現減少了凝血活化和纖維蛋白肽的形成,以及白細胞和血小板的粘附,滌綸的短期血液相容性有顯著改善。
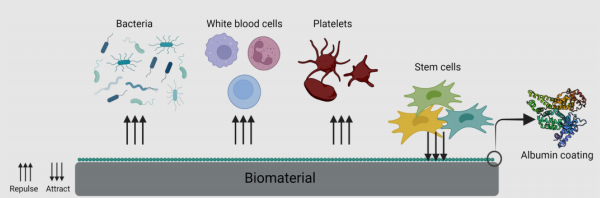
圖3 生物材料表面的白蛋白涂層
(引用自BioRender.com)
-
目前的一些商業產品已經利用了白蛋白涂層,如灌注系統、導管和插管等。例如邁柯唯(Maquet)品牌下的 Bioline 和 Safeline 兩個產品。以Bioline為例,通過共價鍵結合肝素和白蛋白的涂層可確保被涂層的PVC管道內部表面平整均勻,從而減少凝血活性、血栓形成和補體系統激活。
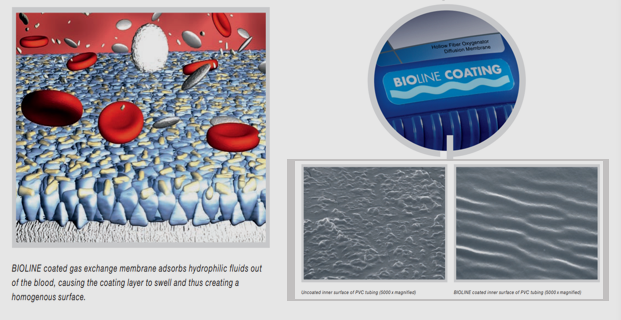
圖4 Bioline涂層說明
(引用自Maquet.com)
藥用輔料:
-
藥物遞送系統(Drug Delivery System,DDS)是指在空間、時間及劑量上全面調控藥物在生物體內分布的技術體系。其目標是在恰當的時機將適量的藥物遞送到正確的位置,從而增加藥物的利用效率,提高療效,降低成本,減少毒副作用。
-
理想藥物載體
HSA的多功能特性使其具有優異的藥代動力學,如延長循環半衰期,增強療效,降低毒性等,理所應當的成為藥物和基因遞送的理想載體。例如白蛋白紫杉醇(Paclitaxel For Injection Albumin Bound)——人血白蛋白作為紫杉醇助溶劑的一種藥物,不僅自身的水溶性以及抗腫瘤作用都得到了進一步提升。研究表明,其作用機理可能是增加了紫杉醇在腫瘤細胞內的存在濃度,與白蛋白結合的紫杉醇可以通過快速交換細胞膜的脂質成分進入細胞。同時該藥物還可以減輕對人體的毒性反應,使用前無需特意對患者進行脫敏處理,從而減輕患者的治療負擔。
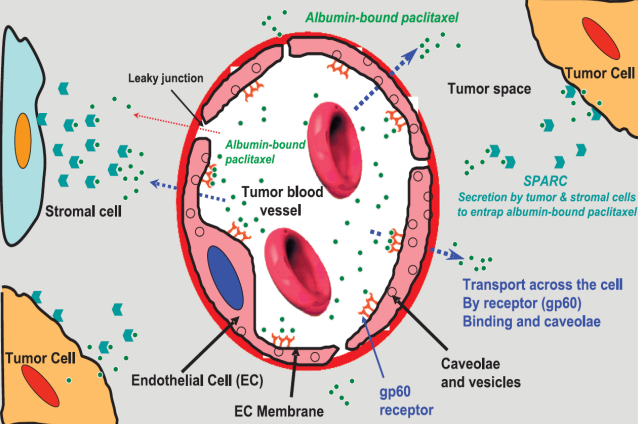
圖5 紫杉醇白蛋白作用機理
(引用自Desai N, Trieu V, Damascelli B, Soon-Shiong P. SPARC expression correlates with tumor response to albumin-bound paclitaxel in head and neck cancer patients. Transl Oncol 2009;2:59-64.)
-
納米技術對醫學和生物學的最大影響之一就是在藥物釋放系統(DDS),制備納米載體最常用的構建對象之一就是白蛋白。多種藥物和帶電分子都能與白蛋白結合,所以它們可以有效地結合到白蛋白納米載體的基質中。白蛋白納米載體已被證明是一種有效的藥物載體,可提高抗癌藥物的殺瘤活性。許多研究已經使用基于HSA的DDS來遞送不同的抗癌藥物,如阿霉素(DOX)。
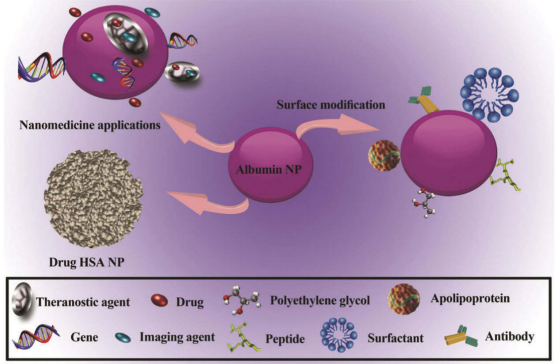
圖6 白蛋白納米多功能載體系統
(引用自Karimi M, Bahrami S, Ravari SBeal. Albumin nanostructures as advanced drug delivery systems. Expert Opin Drug Deliv. 2016 Nov;13(11):1609-1623. doi: 10.1080/17425247.2016.1193149. Epub 2016 Jun 3. PMID: 27216915; PMCID: PMC5063715)
-
疫苗穩定劑
研究表明,人血白蛋白能夠提高疫苗凍干制品的穩定性,可以替代明膠作為藥物的穩定劑。為了保障疫苗使用的安全性,無動物源的rHSA成為理想選擇。美國藥典已經明確rHSA的質量標準,為其生產應用提供指導,國內外一些企業已經或正在使用rHSA替代人血白蛋白作為藥物輔料來提高其產品的安全性,增加市場競爭力。例如默克公司,使用rHSA作為輔料的麻腮風三聯疫苗已經獲得美國FDA批準上市,產品上市多年,無不良反應的報道。
細胞培養:
-
細胞培養基補充劑
HSA可提供對細胞生長很重要的氮和必需氨基酸,并有助于維持細胞培養環境中的PH和滲透壓平衡。
-
多功能抗氧化劑
HSA具有多種配體結合能力和自由基捕獲特性,因此具有特定的抗氧化功能。HSA可以結合脂肪酸并防止其發生氧化;銅與HSA結合后,將不會參與自由基相關的氧化還原反應;通過與半胱氨酸和谷胱甘肽結合形成蛋白質混合二硫化物,有助于防止這些分子被氧化并提高其細胞利用度;結合膽紅素和吡哆醛-5’-磷酸鹽并防止它們發生氧化。
HSA通常根據不同的細胞類型和培養應用采取不同的濃度添加到細胞培養基中。
04.
產品推薦
VivaCell
EastBuminTM重組人白蛋白,East意為東方,與酵母的英文Yeast發音相同,是VivaCell旗下又一位新成員。該產品作為國內酵母表達的重組人血白蛋白,采用新型規模化純化工藝生產,GMP等級,無批間差、低內毒素、具有高安全性和優越的生物活性,適合多種類型細胞的生長,如間充質干細胞,胚胎干細胞,誘導多能干細胞和免疫細胞等。目前該產品已經進入臨床三期試驗,我們將為您提供最優質最安全的產品,為您的試驗助一臂之力。
| 產品名稱 | 產品貨號 | 產品規格 |
|
|
C6520-0001 | 1g |
| C6520-0005 | 5g | |
| C6520-0100 | 100g |
參考文獻
[1] Kuten Pella O, Hornyák I, Horváthy D, et al. Albumin as a Biomaterial and Therapeutic Agent in Regenerative Medicine. Int J Mol Sci. 2022 Sep 12;23(18): 10557.
[2] Karimi M, Bahrami S, Ravari SB,et al. Albumin nanostructures as advanced drug delivery systems. Expert Opin Drug Deliv. 2016 Nov; 13(11): 1609-1623.
[3] Rabbani G, Ahn SN. Structure, enzymatic activities, glycation and therapeutic potential of human serum albumin: A natural cargo. Int J Biol Macromol. 2019 Feb 15; 123: 979-990.
[4] Krajewski S, Neumann B, Kurz J, Perle N,et al. Preclinical evaluation of the thrombogenicity and endothelialization of bare metal and surface-coated neurovascular stents. AJNR Am J Neuroradiol. 2015 Jan; 36(1): 133-139.
[5] Mishra V, Heath RJ. Structural and Biochemical Features of Human Serum Albumin Essential for Eukaryotic Cell Culture. Int J Mol Sci. 2021 Aug 5; 22(16): 8411.
[6] Ohnishi K, Kawaguchi A, Nakajima S, et al. A comparative pharmacokinetic study of recombinant human serum albumin with plasma-derived human serum albumin in patients with liver cirrhosis. J Clin Pharmacol. 2008 Feb; 48(2): 203-208.
-END-
- 德國IKA歐洲之星EUROSTAR系列頂置攪拌器煥新升級
- 賽默飛蘇州TSX通用系列國產化超低溫冰箱震撼上市
- 勤翔發布新品IVScope 8000Pro小動物活體成像系統
- OT Bioelettronic推出新品肌電分析系統novecento+
- BIOLOG 推出新品益生元板和厭氧菌培養基優化板
- Clinx勤翔ChemiScope 6000系列化學發光成像系統升級
- 翼鬃麒新品多通道葉綠素熒光儀,藻類連續監測/培養
- PHCbi推出新品TwinGuard ECO獨立雙系統藥品保存箱
- EVIDENT新品IXplore IX85倒置顯微鏡助力微觀成像
- 蔡司正式發布Lightfield 4D高速體成像技術
- Clinx勤翔新一代CUV系列LED紫外透射儀全新上市
- ibidi micro-Insert 3D微孔插件及培養皿新品來襲
- 明慧四通道LED熒光光源MH-400-LED產品全新升級
- 賽默飛色譜數據系統Chromeleon CDS新版本7.3.2發布
- 瑞孚迪新款酶標儀VICTOR Kira發布:延續高品質基因
- 本生生物推出胎牛血清試用活動,開蓋即有獎
- 美森細胞年終大促活動來襲,胎牛血清跌破底價
- 美德聲推出頭孢吡肟-恩美他唑巴坦MIC藥敏紙條和紙片
- 美德聲推出三款新品藥敏紙片:氨曲南+阿維巴坦等
- 艾貝泰MesenPlify™ sXF 干細胞培養基,試用已開啟
- 中喬新舟推出新品自研周細胞完全培養基
- 逍鵬開學促銷活動:試劑瓶掃碼積分兌換豪禮
- 逍鵬邀您參展哈爾濱中國干細胞第十四屆年會
- 中喬新舟夏日福利:下單就送600元細胞培養套裝包
- 瑋馳逐典聯名促銷,買Gibco胎牛血清送TrypLUS消化液
- 中喬新舟推出無血清成纖維細胞培養基試用活動
- BUNSEN本生生物新推出多款胎牛血清系列產品
- 活動:逍鵬Biolaminin人源重組層粘連蛋白產品促銷
- 通知:逍鵬已暫停上海中韜認證經銷商資格
- 味之素(中國)與華理郭美錦教授團隊簽署合作協議







