|
||||||||||||||||||||||||||||||||||
| [發(fā)表評論] [本類其他產(chǎn)品] [本類其他供應(yīng)商] [收藏] | ||||||||||||||||||||||||||||||||||
| 銷售商: 北京康潤誠業(yè)生物科技有限公司 | 查看該公司所有產(chǎn)品 >> |
【貨號和規(guī)格】T115-01,20 rxn
【產(chǎn)品概述】
隨機(jī)突變是闡述蛋白質(zhì)結(jié)構(gòu)和功能之間的關(guān)系、改進(jìn)蛋白質(zhì)性能的重要工具。StarMut隨機(jī)突變試劑盒基于易錯PCR (error-prone PCR) 技術(shù),利用Taq DNA polymerase不具有3′→5′校對功能的特性,在特定的反應(yīng)緩沖體系中,向擴(kuò)增的目的基因中引入隨機(jī)突變密碼子。帶有隨機(jī)突變的擴(kuò)增產(chǎn)物通過雙酶切,連接到表達(dá)載體中構(gòu)建文庫,然后轉(zhuǎn)化入表達(dá)宿主中,進(jìn)行蛋白活性篩選。如果經(jīng)一次突變反應(yīng)不能獲得滿意的結(jié)果,可采用連續(xù)易錯PCR (sequential error-prone PCR)策略,即將一次PCR擴(kuò)增得到的有用突變基因作為下一次PCR擴(kuò)增的模板,連續(xù)反復(fù)地進(jìn)行隨機(jī)誘變,使每一次獲得的突變累積而產(chǎn)生更有意義的突變。
本試劑盒包含有優(yōu)化的2 x StarMut Random System、StarMut Enhancer和ddH2O三種組分,使用時只需加入適量的DNA模板和合成的兩條擴(kuò)增引物,并用水補(bǔ)足體積,即可進(jìn)行擴(kuò)增反應(yīng),操作簡便快速,大大減少了多次加樣可能造成的出錯和污染機(jī)會。2 x StarMut Random System含有優(yōu)化濃度的Taq DNA polymerase、dNTPs、反應(yīng)緩沖液和穩(wěn)定劑,可最大限度地克服常規(guī)易錯PCR 技術(shù)中,由于Taq DNA polymerase本身的偏愛性造成的以GC突變?yōu)橹鞯娜秉c(diǎn),獲得相對均衡的突變譜。堿基突變率可通過適量添加StarMut Enhancer、調(diào)整模板DNA量和改變PCR擴(kuò)增循環(huán)數(shù)進(jìn)行控制。
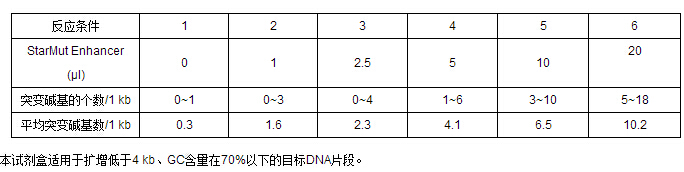
下表列出以10 ng質(zhì)粒DNA為模板,PCR擴(kuò)增一條1 kb DNA片段(20個循環(huán))后測序檢測得到的突變率結(jié)果。需要注意的是,由于不同DNA模板的堿基組成不同、長度不一,以及不同引物的擴(kuò)增效率存在差異,所以即使在相同的PCR反應(yīng)條件下,兩組PCR產(chǎn)物所得到的突變率也可能不同。因此我們建議根據(jù)實(shí)驗的具體要求,首先進(jìn)行多個小體系(20 μl)擴(kuò)增預(yù)實(shí)驗,分別加入不同體積的StarMut Enhancer(如0 μl、1μl、5 μl、10 μl等),摸索出符合目標(biāo)突變率的反應(yīng)條件后,再放大擴(kuò)增體系。其他影響突變率的因素見【注意事項】。
【產(chǎn)品組分】
2 x StarMut Random System
0.5 ml
StarMut Enhancer
0.1 ml
ddH2O
1 ml
【保存條件】
−20℃保存,有效期一年;經(jīng)常使用,可于4℃保存,有效期三個月。
【使用方法】
1.引物設(shè)計原則:
(1) 正、反向擴(kuò)增引物各一條,長度約20~45個堿基,3’端分別與目標(biāo)突變DNA片段的上下游結(jié)合;
(2) 盡量將引物的GC含量控制在40~60%;
(3) 引物如帶有克隆酶切位點(diǎn),必須添加足夠的保護(hù)堿基以確保酶切效率;實(shí)驗證明,引物結(jié)合在目標(biāo)DNA片段的酶切位點(diǎn)外側(cè)可提高酶切效率,增加轉(zhuǎn)化的克隆數(shù)量。
2.隨機(jī)突變反應(yīng):
(1) PCR反應(yīng)體系:
向PCR薄壁管中依次加入下列試劑
質(zhì)粒DNA模板(1~10 ng/μl) * 1 μl
2 x StarMut Random System 25 μl
正向擴(kuò)增引物 (10 μM) 1 μl
反向擴(kuò)增引物 (10 μM) 1 μl
StarMut Enhancer 0~20 μl
ddH2O 補(bǔ)足體積至 50 μl
(2) 混勻后短暫離心,放入PCR儀。
(3) PCR循環(huán)參數(shù)的設(shè)置:
95℃ 2 min
94℃ 30 sec
50~65℃ 1 min x 16~25 cycles*
72℃ 1 min/1 kb
72℃ 7 min
*突變率可通過改變起始模板濃度和擴(kuò)增循環(huán)數(shù)進(jìn)行控制。起始模板濃度越高,突變率越低;擴(kuò)增循環(huán)數(shù)越高,突變率越高。
3.取1~5 μl PCR產(chǎn)物電泳檢測條帶濃度和特異性。
4.剩余的PCR產(chǎn)物電泳,切膠回收目標(biāo)DNA片段。
5.酶切、連接、轉(zhuǎn)化到表達(dá)宿主菌株中進(jìn)行篩選。
【注意事項】
1. 由于不同DNA模板的堿基組成不同、長度不一,以及不同引物的擴(kuò)增效率存在差異,所以即使在相同的PCR反應(yīng)條件下,兩組PCR產(chǎn)物所得到的突變率也可能不同。因此我們建議根據(jù)具體實(shí)驗要求,首先進(jìn)行多個小體系(20 μl)擴(kuò)增預(yù)實(shí)驗,分別加入不同體積的StarMut Enhancer(如0 μl、1 μl、5 μl、10 μl等),通過測序或活性檢測等方法,摸索出符合目標(biāo)突變率的反應(yīng)條件后,再放大擴(kuò)增體系。
2. 起始DNA模板的濃度對突變率有很大影響,通常可通過提高或降低DNA模板的濃度來調(diào)整突變率。鑒于不同型號的分光光度計檢測的DNA濃度存在偏差,DNA模板最好在酶切線性化后,采用凝膠電泳方法,與已知濃度的線性化雙鏈DNA或商品化的DNA marker進(jìn)行對比,確定其濃度。
3. 突變反應(yīng)產(chǎn)物必須進(jìn)行切膠回收處理,去除DNA模板、PCR產(chǎn)物上結(jié)合的Taq酶以及其他雜質(zhì)。常規(guī)的乙醇沉淀、硅膠膜(珠)或玻璃奶吸附等方法,均無法去除結(jié)合的Taq酶,后者可能遮蔽酶切位點(diǎn),影響克隆效率。
4. 建立隨機(jī)突變文庫通常需要10~200 ng/μl (相當(dāng)于500 ng ~10 μg/50 μl體系)的PCR產(chǎn)物。如遇產(chǎn)量不足,可通過下列方法提高產(chǎn)量:
(1) 突變率符合需求時,可放大PCR體系,或切膠回收PCR產(chǎn)物后,采用常規(guī)PCR反應(yīng)條件進(jìn)行擴(kuò)增;
(2) 突變率低于需求時,提高PCR擴(kuò)增循環(huán)數(shù),或切膠回收PCR產(chǎn)物后,進(jìn)行第二輪隨機(jī)突變反應(yīng);
(3) 重新設(shè)計擴(kuò)增引物;
(4) 降低退火溫度;
(5) 確保模板質(zhì)量,采用凝膠電泳方法精確定量。
5. 對于帶有克隆酶切位點(diǎn)的DNA模板,必須在PCR反應(yīng)結(jié)束后,使用DpnI完全消化清除甲基化的模板,再切膠回收目標(biāo)DNA片段。對于非甲基化的質(zhì)粒(例如從大腸桿菌JM110或SCS110菌株中提取的質(zhì)粒),可通過轉(zhuǎn)化dam+的大腸桿菌菌株(如DH5α、TOP10、JM109、XL1-Blue等),再抽提獲得甲基化的質(zhì)粒作為PCR反應(yīng)模板。
6. 經(jīng)過雙酶切的克隆載體在插入突變DNA片段前,應(yīng)首先通過自身連接檢測,確保極低的自連背景。必要時可采用去磷酸化、切膠回收等方法把自連率降至最低,以免影響后續(xù)連接反應(yīng)。
【備注】
本產(chǎn)品僅供科研使用。在確認(rèn)產(chǎn)品質(zhì)量出現(xiàn)問題時,本公司承諾為客戶免費(fèi)更換等量的質(zhì)量合格產(chǎn)品。在所有情況下,本公司對此產(chǎn)品所承擔(dān)的責(zé)任僅限于此產(chǎn)品的價值本身。
- MCE中國將攜試劑產(chǎn)品亮相美國芝加哥2025 AACR年會
- 2024年"MCE中國生命科學(xué)研究促進(jìn)獎"評獎結(jié)果公布
- 陶術(shù)生物直播預(yù)告:受體藥理學(xué)與藥物發(fā)現(xiàn)研究
- 安捷倫免疫組化法PD-L1檢測試劑盒獲得歐盟IVDR認(rèn)證
- 天隆自主研發(fā)HCV核酸檢測試劑盒獲批藥監(jiān)局三類NMPA
- 德國Massive Photonics推出多款DNA-PAINT各系試劑盒
- IPHASE邀您共赴BIOCHINA2025第十屆易貿(mào)生物產(chǎn)業(yè)大會
- 蘭博利德推出新品高保真快速擴(kuò)增 PCR mix試劑盒
- OK432在腫瘤和免疫研究中的作用機(jī)制及應(yīng)用優(yōu)勢
- 鐵調(diào)素Hepcidin-25作為鐵代謝和免疫反應(yīng)關(guān)鍵調(diào)節(jié)因子的功能和作用
- 糖蛋白Fibronectin在細(xì)胞培養(yǎng)中的功能及作用
- TDP-43的結(jié)構(gòu)與功能及在漸凍癥(ALS)等神經(jīng)退行性疾病中的作用機(jī)制
- DNP-BSA(2,4-二硝基苯偶聯(lián)牛血清白蛋白)在免疫學(xué)研究與檢測中的作用
- AbMole LPS(脂多糖)在免疫激活、動物造模等方面的應(yīng)用及案例分享
- AbMole蛋白酶抑制劑Cocktail在WB實(shí)驗中的應(yīng)用優(yōu)勢及案例分享
- AbMole重組CRM197載體蛋白的特性及在疫苗研發(fā)中的應(yīng)用



