細胞遷移與侵襲全攻略
瀏覽次數(shù):5325 發(fā)布日期:2019-7-3
來源:本站 僅供參考,謝絕轉載,否則責任自負
|
|
小室操作處理的步驟
Step1.選擇水凝膠類型包被小室:
水凝膠主要分為兩種:動物來源(如基質(zhì)膠、膠原蛋白膠、纖維蛋白膠)或是合成型水凝膠(如Vitrogel 3DTM)。以24孔板的小室為例,取70-100μl(體積量不需太多,剛好將聚碳酸酯膜浸濕即可)稀釋好的水凝膠,均勻涂抹在小室內(nèi)的膜進行包被,37℃放置1-3 h左右(時間取決于選用的水凝膠類型)。
▲細胞遷移和侵襲實驗圖示
Step2.制備細胞懸液:
將進行實驗的細胞消化下來,終止消化后離心棄去培養(yǎng)液,用PBS洗1-2次,用不含血清培養(yǎng)基將細胞重懸,并進行細胞計數(shù),調(diào)整細胞密度至5×104/ml -5×105/ml (根據(jù)實驗決定細胞接種數(shù)量)。
Step3.接種細胞:
取100µl細胞懸液加入24孔板上層小室,24孔板下室一般加入600µl含20%FBS的培養(yǎng)基,避免下層培養(yǎng)液和小室間氣泡產(chǎn)生,氣泡會減弱下層培養(yǎng)液的趨化作用,如果不小心出現(xiàn)氣泡,需要將小室提起,將氣泡除去,再將小室放進培養(yǎng)板。
Step4.培養(yǎng)時間:
培養(yǎng)時間由實驗目的決定,如細胞共培養(yǎng)、細胞趨化、細胞遷移以及細胞侵襲等多種方面的研究;細胞遷移與侵襲的能力,除了培養(yǎng)時間需要考慮外,也需考慮細胞的處理!
Step5.結果分析:
結束培養(yǎng),取出小室,移除孔中培養(yǎng)液,用無鈣鎂的PBS洗2-3次,使用甲醇固定15-30分鐘后,將小室適當風干。用預備好的0.1%-0.5%結晶紫染色,再用棉簽輕輕擦掉內(nèi)層未遷移細胞,用PBS洗3次。在200倍或400倍顯微鏡視野下,隨機選擇五個視野拍照觀察并計數(shù)穿過膜后的細胞。
▲統(tǒng)計穿膜后細胞數(shù)量圖示 |
|
|
|
|
Reference
Transwell® Invasion Assays. Methods Mol Biol. 2011; 769:97-110 |
|
|
|
| 產(chǎn)品信息: |
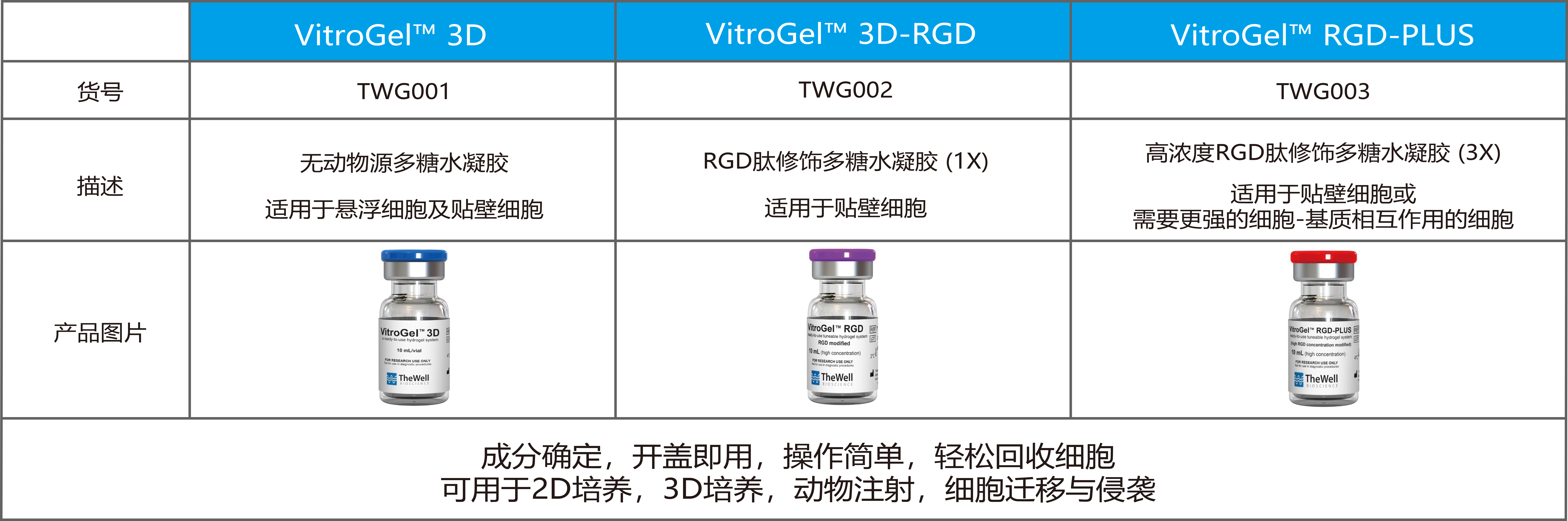 |
|
|
聯(lián)系我們
電話:021-58785545
網(wǎng)址:http://www.xpbiomed.com
郵箱:info@xpbiomed.com
地址:上海浦東新區(qū)祖沖之路1505弄80號1幢3樓
|
|
|
|
|