CRISPR-Cas9技術在實現(xiàn)內(nèi)源性基因替換治療β-地貧小鼠模型上的應用
2020年,CRISPR/Cas9技術成功摘下諾獎桂冠,成為當下最熱門的基因編輯技術。CRISPR/Cas9在醫(yī)學領域具有強大的潛力,已經(jīng)在多種基因疾病上顯示出強大的治療效果。
2021年3月,Integrated DNA Technologies(埃德特生物,以下簡稱IDT)聯(lián)合美國斯坦福大學、貝勒醫(yī)學院等全球知名機構的研究人員在國際頂級學術期刊Nature Medicine(影響因子:36.130)發(fā)表重磅研究論文,利用IDT公司的Alt-R® CRISPR/Cas9 基因編輯系統(tǒng)和Lonza的電轉染系統(tǒng),成功在小鼠模型中實現(xiàn)用β-珠蛋白替代α-珠蛋白來治療β-地中海貧血。

在這項研究中,研究人員使用LONZA 4D-Nucleofector對β-地貧來源CD34+ HSPC進行電穿孔,然后利用AAV6作為載體將IDT公司的Cas9結合化學合成的sgRNA遞送至HSPC進行基因編輯,在保持高度同源HBA2基因的同時,將內(nèi)源性HBA1基因敲除并替換成全長HBB基因。
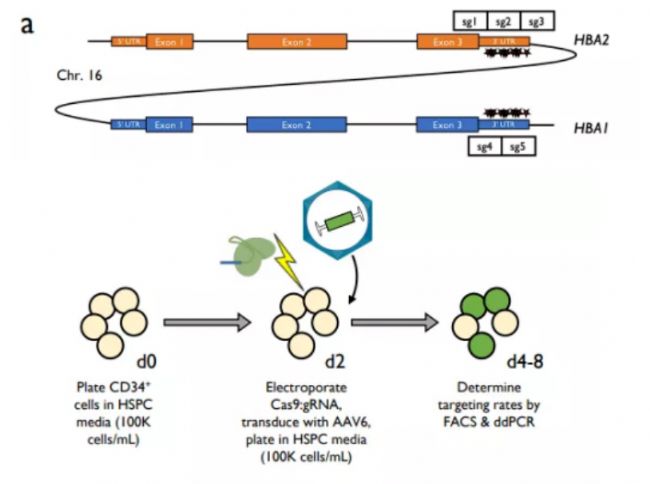
研究結果顯示:該基因編輯策略使得β-球蛋白:α-球蛋白信使RNA和蛋白質比率正常化,能夠產(chǎn)生功能性的成年血紅蛋白四聚體;在小鼠模型體內(nèi)回輸后,經(jīng)過基因編輯的HSPC能夠在小鼠中進行長期和雙系造血重建。提示HBB替代HBA1可以作為治療β-地中海貧血的新型治療策略。
研究人員表示,這項研究可能是首次證明在Cas9介導的DNA雙鏈斷裂(DSB)下,能夠實現(xiàn)整個內(nèi)源性基因替換。該發(fā)現(xiàn)有望能夠拓展CRISPR/Cas9的應用范疇,以治療更多基因突變導致的疾病類型。
突破傳統(tǒng)CRISPR/Cas9的局限性
近年來,CRISPR基因編輯技術已經(jīng)廣泛應用于許多領域,可以預見的是基于CRISPR的基因組編輯技術轉化為醫(yī)學應用會對人類健康產(chǎn)生重大影響,而此技術也引領了分子生物學工具的一場革命。
但是CRISPR/Cas9目前仍然存在一些局限性,限制了CRISPR/Cas9的快速發(fā)展,例如脫靶效應。同時,傳統(tǒng)CRISPR/Cas技術在基因切割上具有強大的優(yōu)勢,但是在長片段DNA精確的靶向插入/替換上依然存在一定的挑戰(zhàn)。
為了克服這些問題,IDT公司開發(fā)了Alt-R® CRISPR/Cas9基因編輯系統(tǒng),在降低整體脫靶率的同時實現(xiàn)在目標靶點的高效切割。同時在最新發(fā)表的研究中,顯示出這種新型的CRISPR/Cas9系統(tǒng)能夠將長片段的功能性基因插入/替換致病性基因。
Alt-R® CRISPR/Cas9編輯系統(tǒng)主要采用遞送核糖蛋白復合物(Ribonucleoprotein complex,RNP)的方法,RNP即Cas9蛋白和gRNA結合形成的具有編輯功能的復合物。與傳統(tǒng)CRISPR/Cas9不同的是,在IDT公司Alt-R®CRISPR 系統(tǒng)中,gRNA的組成成分crRNA和tracrRNA均經(jīng)過優(yōu)化。
事實上,在2018年發(fā)表于期刊Nature Medicine上的另一篇研究文獻中,證實了Alt-R® CRISPR/Cas9的優(yōu)越性能。在該研究中,IDT公司的 Alt-R® S.P. HiFi Cas9呈現(xiàn)出穩(wěn)定的中靶編輯活性,脫靶率極低。

研究顯示:HiFi Cas9/AAV6能夠在5個治療位點(HBB、IL2RG、CCR5、HEXB、TRAC)誘導強大的基因編輯,具有高靶向性;同時HiFi Cas9/AAV6介導鐮狀細胞疾病(SCD)患者HSPC中p.E6V突變的高水平校正。
通過化學合成的高度定制化的引導RNA(gRNA)序列,配套使用的電轉/敲入增強子,各類對照試劑以及免費使用的序列設計工具,實現(xiàn)了從實驗設計到結果分析的全流程覆蓋,實現(xiàn)高效精準的基因編輯,讓實驗不再困難。
Integrated DNA Technologies, Inc. (IDT) 是丹納赫集團(Danaher Corporation,紐約證交所代碼:DHR)生命科學平臺旗下的一家運營公司。IDT致力于面向生命科學界開發(fā)、生產(chǎn)并銷售核酸產(chǎn)品,為學術與商業(yè)研究、農(nóng)業(yè)、醫(yī)療診斷和藥物開發(fā)等領域提供支持。IDT 開發(fā)了多項針對基因組應用的技術,涵蓋二代測序、CRISPR基因組編輯、合成生物學、數(shù)字PCR以及RNA干擾。通過GMP服務,IDT生產(chǎn)的產(chǎn)品被科學家用于研究多種形式的癌癥以及各類遺傳性和傳染性疾病,為超過130,000名生命科學研究人員提供服務,也是公認的定制核酸生產(chǎn)行業(yè)的領導者。
Lonza公司的Nucleofector技術輕松實現(xiàn)CRISPR高效轉導
CRISPR技術作為除ZFN和TALEN技術外另一種有效的位點特異性基因組修飾的工具。而如何將CRISPR系統(tǒng)高效的轉導到目的細胞中,成了另一個亟待解決的問題。Lonza獨有的Nucleofector技術已有20年的歷史,自2001年問世以來得到廣泛的客戶認可,已經(jīng)被證明可作為基于CRISPR的基因組編輯工具的有效非病毒轉染方式。Nucleofector技術使用預優(yōu)化的電轉參數(shù)和細胞類型特異性電轉液的組合,以使得底物能夠直接轉染到細胞核中。與傳統(tǒng)電轉相比,直接轉染到細胞核中,與細胞分裂無關,即使在非分裂的原代細胞中也具有較高的轉染效率。Nucleofector技術按照模塊化將小體積轉染及大體積轉染,可以實現(xiàn)在小體積到大體積的線性放大,適用于從藥物研發(fā)階段到臨床階段的轉化。






