流式細胞術常見樣本的處理與保存
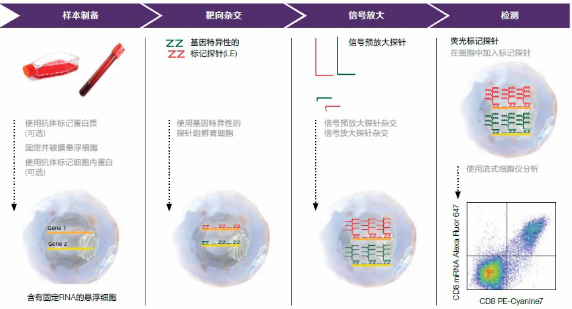
流式細胞術(flow cytometry, FCM)是當代最先進的細胞分析技術之一,包括各種細胞的計數、細胞中抗原分子的檢測、細胞中DNA和RNA的倍體分析、細胞的生物學特性及功能分析等。在血液學檢測中,應用FCM分析的樣本多為外周血、骨髓、各類體液(如腦脊液、胸水、腹水)以及人體的組織(如淋巴結、脾、肝等),下面我們將介紹這幾種常見樣本的制備方法,樣本制備的好壞對最終的檢測結果有很大影響。
體 液
1. 保存方法
收集樣本后置于肝素抗凝管中,室溫保存,盡量在12 h內處理樣本;若無法及時處理,4℃保存,保存時間最好不要超過48 h。
2. 處理方法
a. 樣本1000-1500 rpm離心5 min,棄去上清;
b. 加入含有0.1%牛血清白蛋白的磷酸鹽緩沖液(PBS),離心洗滌5 min;
c. 加入適量PBS重懸。如有細小沉淀,用300目尼龍網過濾后備用。
外 周 血 或 骨 髓
1. 保存方法
收集樣本后置于加有抗凝劑(一般選擇肝素或EDTA)的試管中,室溫保存,盡量在12 h內處理樣本;若無法及時處理,4℃保存,此時最好選擇肝素抗凝管。
2. 處理方法
一般不需要特殊處理制備單細胞懸液,所用試劑為淋巴細胞分離液和紅細胞裂解液。但在臨床檢測中,為了避免細胞成分丟失,通常不推薦使用淋巴細胞分離液分離單核細胞。
3. 抗凝劑的選擇
血液標本可以使用EDTA、ACD(枸櫞酸葡萄糖)或肝素抗凝。
一般認為,ACD和肝素抗凝的樣本72 h內細胞是穩定的;EDTA抗凝48 h內是穩定的,但超過24 h則認為不是很好了。
EDTA適用于白細胞的免疫表型分析,可防止成熟的髓系細胞貼壁造成細胞損失,并具有較強的抗血小板凝集能力,但對細胞活性的保持不如肝素抗凝。同時EDTA是二價陽離子的強螯合劑,會影響與Ca2+相關的抗原位點(如CD11b等),并會抑制與Ca2+相關的細胞功能。肝素常用于白細胞功能研究,可維持Ca2+和Mg2+在細胞內的生理濃度,更好保持細胞活性,適用于放置時間較長、不能及時檢測的樣本,但不適合血小板的相關檢測。
骨髓樣本優先選擇肝素抗凝。
組 織
1. 保存方法
切取新鮮組織樣本置于生理鹽水或PBS中,室溫保存,盡量在12 h內處理樣本;若無法及時處理,4℃保存,保存時間最好不要超過48 h。不建議用甲醛、乙醇固定細胞,不要用酶、表面活性劑處理細胞。
2. 處理方法
常用的組織樣本制備單細胞懸液方法有:機械法、酶處理法、化學試劑處理法及表面活性劑處理法,在流式分析中,為保持抗原活性,多采用機械法處理樣本。采用機械法需注意動作輕柔,盡量減少細胞的損傷。
若實驗室無單細胞制備儀,手工剪切制備單細胞懸液:
a. PBS清洗組織樣本,去除大量紅細胞;
b. 用眼科剪將組織剪成極小塊,再次PBS清洗;
c. 組織小塊加入勻漿器中,加少量PBS勻漿;
d. 用細注射針頭抽取細胞懸液;
e. 300目尼龍網過濾;
f. 加入含0.1%牛血清白蛋白的PBS;
g. 1000-1500 rpm離心5 min,棄去上清;
h. 加入適量PBS重懸。

體 液
1. 保存方法
收集樣本后置于肝素抗凝管中,室溫保存,盡量在12 h內處理樣本;若無法及時處理,4℃保存,保存時間最好不要超過48 h。
2. 處理方法
a. 樣本1000-1500 rpm離心5 min,棄去上清;
b. 加入含有0.1%牛血清白蛋白的磷酸鹽緩沖液(PBS),離心洗滌5 min;
c. 加入適量PBS重懸。如有細小沉淀,用300目尼龍網過濾后備用。
外 周 血 或 骨 髓
1. 保存方法
收集樣本后置于加有抗凝劑(一般選擇肝素或EDTA)的試管中,室溫保存,盡量在12 h內處理樣本;若無法及時處理,4℃保存,此時最好選擇肝素抗凝管。
2. 處理方法
一般不需要特殊處理制備單細胞懸液,所用試劑為淋巴細胞分離液和紅細胞裂解液。但在臨床檢測中,為了避免細胞成分丟失,通常不推薦使用淋巴細胞分離液分離單核細胞。
3. 抗凝劑的選擇
血液標本可以使用EDTA、ACD(枸櫞酸葡萄糖)或肝素抗凝。
一般認為,ACD和肝素抗凝的樣本72 h內細胞是穩定的;EDTA抗凝48 h內是穩定的,但超過24 h則認為不是很好了。
EDTA適用于白細胞的免疫表型分析,可防止成熟的髓系細胞貼壁造成細胞損失,并具有較強的抗血小板凝集能力,但對細胞活性的保持不如肝素抗凝。同時EDTA是二價陽離子的強螯合劑,會影響與Ca2+相關的抗原位點(如CD11b等),并會抑制與Ca2+相關的細胞功能。肝素常用于白細胞功能研究,可維持Ca2+和Mg2+在細胞內的生理濃度,更好保持細胞活性,適用于放置時間較長、不能及時檢測的樣本,但不適合血小板的相關檢測。
骨髓樣本優先選擇肝素抗凝。
組 織
1. 保存方法
切取新鮮組織樣本置于生理鹽水或PBS中,室溫保存,盡量在12 h內處理樣本;若無法及時處理,4℃保存,保存時間最好不要超過48 h。不建議用甲醛、乙醇固定細胞,不要用酶、表面活性劑處理細胞。
2. 處理方法
常用的組織樣本制備單細胞懸液方法有:機械法、酶處理法、化學試劑處理法及表面活性劑處理法,在流式分析中,為保持抗原活性,多采用機械法處理樣本。采用機械法需注意動作輕柔,盡量減少細胞的損傷。
若實驗室無單細胞制備儀,手工剪切制備單細胞懸液:
a. PBS清洗組織樣本,去除大量紅細胞;
b. 用眼科剪將組織剪成極小塊,再次PBS清洗;
c. 組織小塊加入勻漿器中,加少量PBS勻漿;
d. 用細注射針頭抽取細胞懸液;
e. 300目尼龍網過濾;
f. 加入含0.1%牛血清白蛋白的PBS;
g. 1000-1500 rpm離心5 min,棄去上清;
h. 加入適量PBS重懸。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





