蛋白質組學助力急性髓系白血病精準亞型分析
急性髓性白血病(AML)是一種臨床和遺傳異質性疾病,其特征是骨髓浸潤與未成熟白血病原始細胞導致骨髓衰竭。盡管基因組學已經幫助解決了AML的一些臨床異質性,并揭示了特定的藥物靶點,但仍然存在許多挑戰。蛋白質組學一直被認為是一種很有前途的技術,可以補充基因組學來闡明癌癥生物學并識別診斷和預測生物標記物。本文中,研究者利用多組學技術分析蛋白質和基因的表達、細胞遺傳學和體細胞突變特征,從蛋白質水平對AML患者分型,并為確認致病機制和預測性生物標志物的研究奠定基礎。
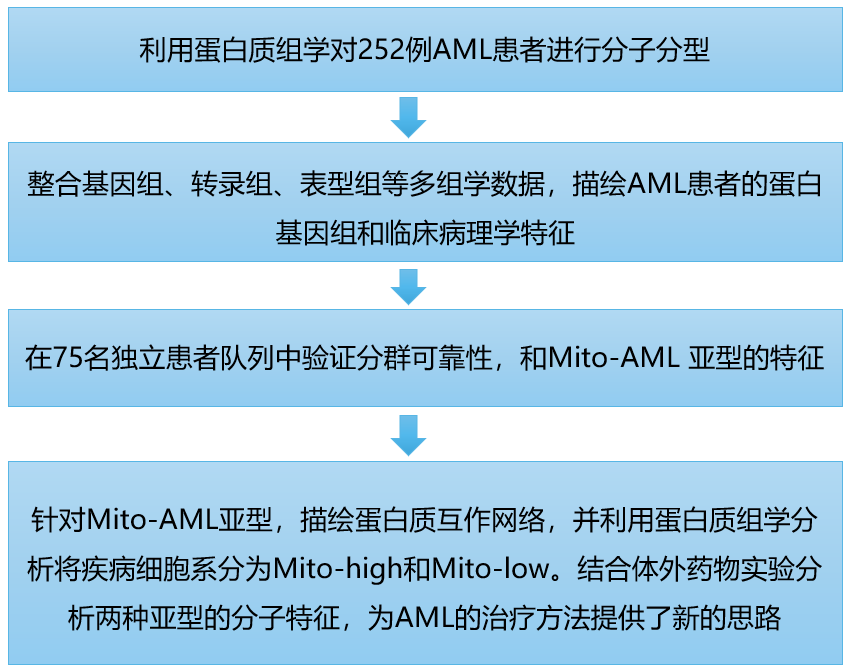
研究思路
文章詳情
文章題目:The proteogenomic subtypes of acute myeloid leukemia
中文題目:急性髓系白血病的蛋白基因組亞型
發表時間:2022.03
期刊名稱:Cancer Cell
影響因子:31.743
實驗平臺:LC-MS/MS DDA+DIA、全轉錄組測序、基因組靶向測序等
DOI:10.1016/j.ccell.2022.02.006
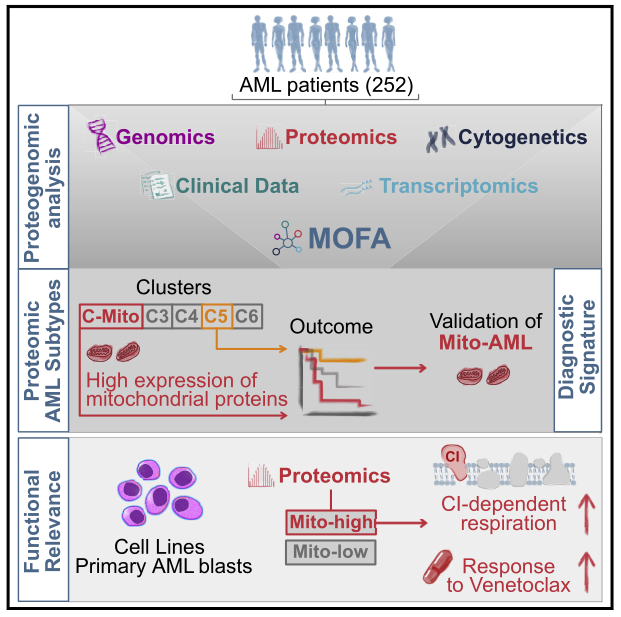
研究內容
· 蛋白質組AML亞型的發現及其生物學特性
研究者的急性髓系白血病(AML)多組學研究主要包括四個部分,即蛋白質表達、基因表達、基因突變和細胞遺傳學分析。首先,利用蛋白質組數據,使用無監督分級聚類方法鑒定到了6個不同的蛋白質組亞群(圖1B)。由于C1和C2都具有線粒體蛋白和線粒體相關過程的高水平表達,與其他四個cluster不同,因此研究者將這2個cluster合并為一個新cluster,命名為C-Mito,并利用GSVA確認了這個合并cluster的獨特線粒體譜和所有5個cluster差異調節的通路富集圖譜(圖1C)。接下來,研究者探索了轉錄因子和激酶的表達模式,發現STAT家族的轉錄因子在 C-Mito 中的表達強度較低和C-Mito 中丙酮酸脫氫酶激酶 (PDHKs) 的顯著上調(圖1D和E)。
在蛋白質組聚類分型后,研究者使用RNA測序技術分析AML的轉錄組特征,發現轉錄組和蛋白質組中5702個基因-蛋白質對中的1588個存在顯著相關性,證實了AML原始細胞中RNA和蛋白質之間的相關性在基因之間存在很大的異質性。然而,對轉錄組數據進行GSVA分析并與蛋白質組GSVA結果比較發現大多數通路和cluster中,除了與抗菌和抗微生物防御機制有關的少數過程外,二者的富集分數沒有顯著相關性,說明在AML中,RNA和蛋白質的表達在很大程度上是不耦合的(圖1C)。
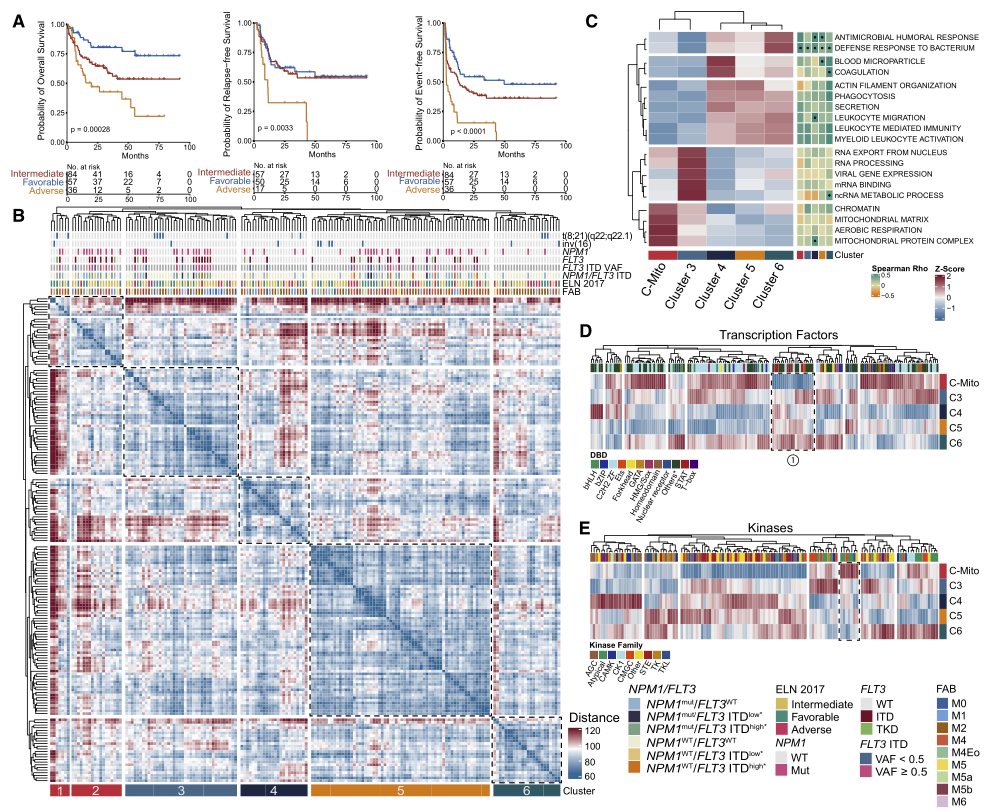
Fig.1 AML的蛋白質組亞型
· 多組學聯合揭示AML的蛋白基因組學特征
接下來,研究者使用MOFA方法來整合并分析多組學數據結果。MOFA在一個可解釋的線性模型中將不同組學數據聯合分解成不同的變異源。這些變異源由廣義主成分意義下的潛在因子(LFs)表示,共確認了28個LFs(圖2A)。其中,LF1在所有數據集中都是活躍的,代表了與NPM1突變和HOX基因相關的AML異質性的特征維度,從而說明大多數病例中共同出現NPM1突變和HOX依賴基因的強表達,因此將這個因素稱為LF1-NPM1/HOX。值得注意的是,LF1-NPM1/HOX還檢測到與蛋白質組和轉錄組中的主要組織相容性復合體相關的協調變異,且NPM1突變與特異的HLA相關的RNA和蛋白質譜之間可能存在分子聯系。(圖2B和C)。使用MOFA來關注僅反映在蛋白質組中的患者之間的變異性。在這里,最主要的因素是LF6;它揭示了與線粒體相關的基因驅動LF6-Mito的變異(圖2D)。而LF6-Mito主要檢測到分配給C-mito的患者(圖2E)。通過量化LF6-Mito和線粒體主成分(PC1-Mito)之間的關聯進一步證實了LF6的線粒體特征,該關聯是基于注釋到線粒體的蛋白質計算得出的,顯示出顯著的相關性(圖2F)。為了進一步證實不能通過轉錄組檢測到具有蛋白質組C-Mito特征的患者,研究者基于蛋白質組和轉錄組的線粒體基因進行了獨立的主成分分析(PCA)。C-Mito患者再次僅通過蛋白質組數據被檢測到(圖2G)。綜上所述,分配給C-Mito的患者亞群僅反映在蛋白質組中,突顯了蛋白質組學作為發現工具的重要性。
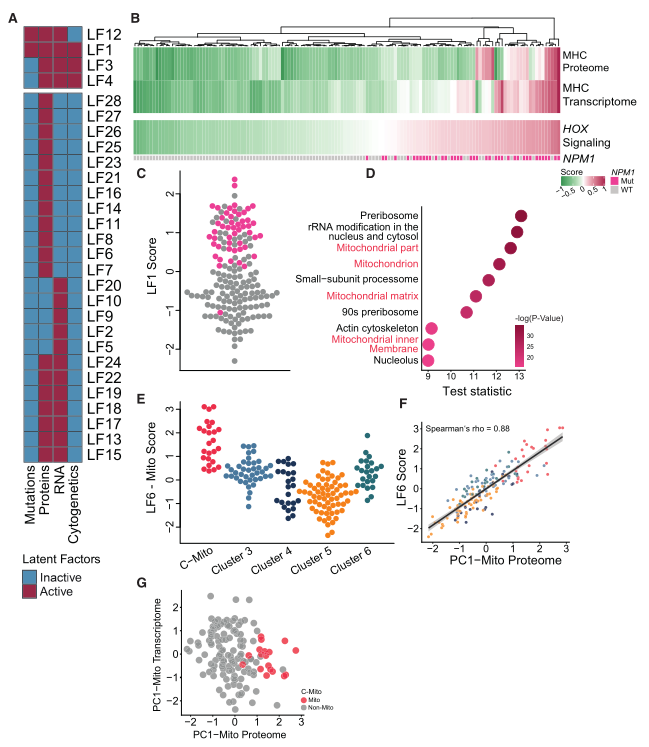
Fig.2 AML的蛋白質組特征
· 蛋白質組AML亞型的臨床和基因組特征
臨床相關性分析顯示,已確定的五種蛋白質組AML亞型中有兩種與預后相關。C-Mito組的患者總體生存時間較短(OS)(圖3A)。Mito組和非Mito組的基本患者特征相似,因為在年齡、性別分布或同種異體干細胞移植比率方面,兩組之間沒有顯著差異。然而,在細胞遺傳學風險組和突變特征方面存在差異(圖3C)。令人驚訝的是,盡管C-Mito的特點是OS較短,但根據ELN風險分類,C-Mito在有利的風險疾病特征中富集,而非Mito AML富集于不利風險特征,包括繼發性AML。C5組的OS比非C5組患者更長,且多因素分析表明C5是一個獨立的有利危險因素(圖3D和E)。C5組患者DNMT3A突變頻率增加,可能會影響該組患者蛋白質組和疾病預后情況(圖3F)。
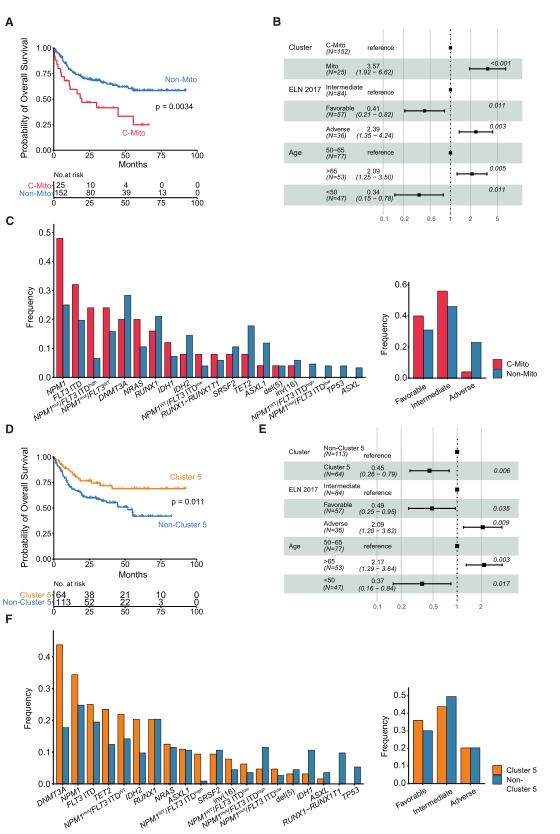
Fig.3 AML蛋白亞型與強化誘導治療后生存期的關系
· Mito-AML亞型在獨立患者隊列中的驗證
在75名具有遺傳特征的獨立隊列中驗證了上述發現結果,該隊列與發現隊列相同,均接受了強化誘導治療。在驗證隊列中,聚類分析獲得了3個亞型。其中一個cluster預測可能是C-Mito,并且富集了NPM1的突變(圖4A和B)。在對C-Mito預測貢獻最大的五個蛋白質中,兩個與線粒體和MRPL19有關,兩個與核孔復合體有關,代表了C-Mito的重要預測特征,也是建立診斷標志物panel的第一步(圖4D)。此外,驗證隊列中無論是用預測方法或是通過無監督聚類確定為C-Mito的患者,其OS均顯著短于非Mito患者(圖4E-G)。
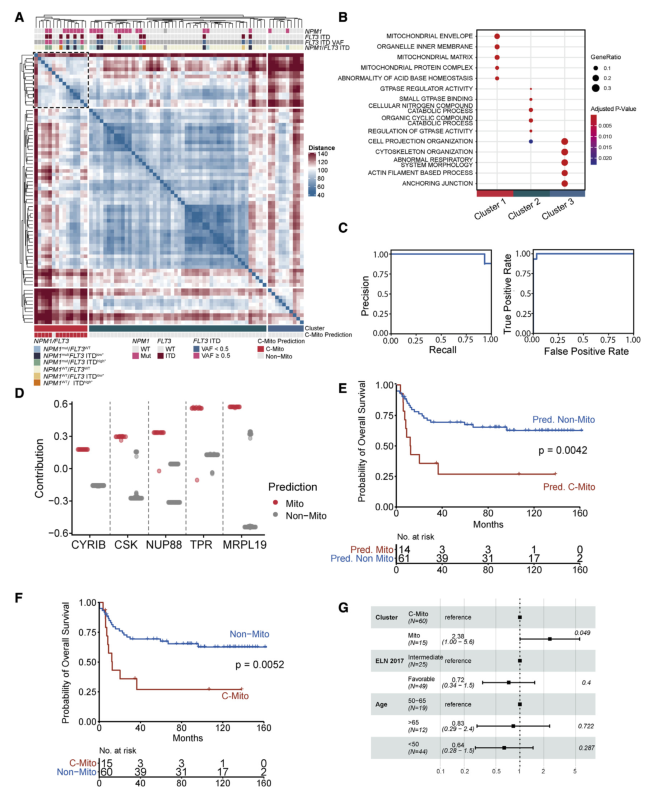
Fig.4 基于驗證隊列和機器學習的C-Mito預測
· Mito-AML定義的蛋白質組網絡
為了進一步了解C-Mito的生物學特性,研究者提取了與其他cluster相比具有顯著表達差異的前100個基因蛋白質。這些蛋白質中大多數屬于線粒體、核膜和染色質調節器這三個生物學類別之一(圖5A)。通過附加前人發表的蛋白質相互作用來獲得具有C-Mito特征蛋白質的相互作用網絡,揭示了這些蛋白質強大的相互連接性。C-mito的特點是幾乎所有線粒體蛋白(包括呼吸復合物I-V)的高表達,根據MOFA分析結果,這種現象僅能在蛋白質水平上檢測到,而RNA水平不行(圖5B-E)。這些結果說明存在一種轉錄后機制導致線粒體蛋白在C-mito中積累,同樣,核孔成分也只在蛋白質水平上調。基于通路表達水平對患者進行無監督聚類分析發現主要包含C-mito的cluster特征是幾乎所有線粒體通路的顯著上調。然而,與其他cluster相比,有絲分裂吞噬和自噬相關的蛋白質表達下調。由于這些是線粒體動力學調控和監測的關鍵過程,這一發現表明,失調的線粒體蛋白質量控制可能有助于解釋C-Mito表型。
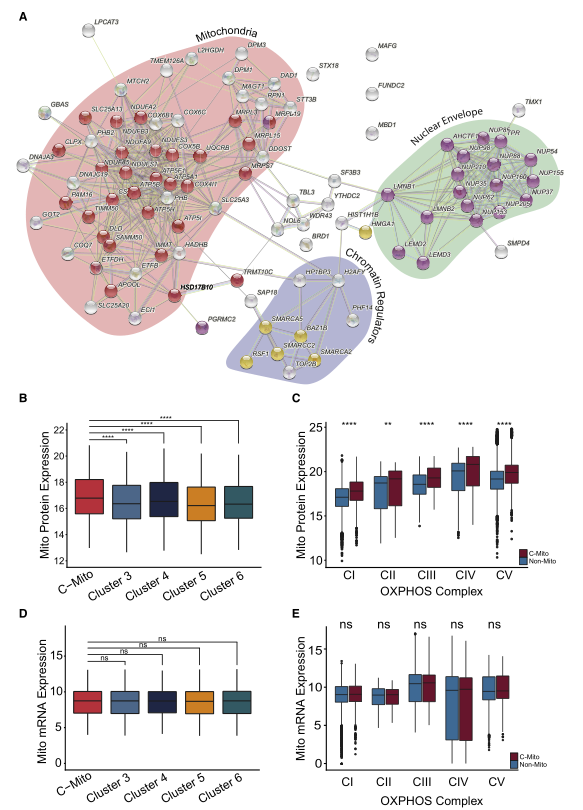
Fig.5 Mito-AML 定義的蛋白質組網絡
· MITO-AML對線粒體復合體I的依賴性
上述研究已將Mito-AML鑒定為高危AML亞型,研究者進一步探究該亞型是否具有特殊的病理機制特征。對25個急性白血病細胞系進行蛋白質組檢測,共鑒定出8573個蛋白質,將14個細胞系鑒定為Mito-high,11個為Mito-low(圖6A)。DepMap CRISPR數據庫中的10個AML系與研究者細胞系蛋白質組數據整合分析發現其中6個是Mito-high,4個是Mito-low,Mito-High系比Mito-low系對線粒體復合體I基因的依賴性更強,而屬于復合體II-V的基因沒有差異(圖6B和C)。除了復合體I,參與DNA修復、組蛋白乙酰化和MTOR信號通路的基因在Mito-High細胞系中具有更強的依賴性。體外實驗部分,研究者驗證了兩個Mito組別對復合體I抑制藥物(以線粒體呼吸為靶點)治療的敏感性,發現Mito-high對這些藥物具有顯著的超敏反應(圖6D)。此外,Seashore代謝分析表明Mito-high AML細胞系表現出更強的依賴復合體I的呼吸(圖6E)。與 Mito-low 細胞相比,venetoclax 治療導致 Mito-high 細胞耗氧率降低程度更高(圖6F),這種更強的依賴復合體I的呼吸也在發現隊列的原始樣品中進行了驗證(圖6G)。治療24h后通過流式細胞術比較膜聯蛋白V-/7AAD-細胞的比例,證實了Mito-AML患者離體的原始細胞對venetoclax的敏感性增加(圖6H)。總之,這些結果表明 Mito-AML 細胞與線粒體呼吸具有特異的聯系,這使得它們更容易受到靶向該代謝途徑的藥物的影響。

Fig.6 Mito-AML 的代謝通路與治療相關靶點
主要結論
本研究對252例接受統一治療的AML患者的骨髓活檢組織進行的全面的蛋白質基因組分析,以闡明AML的分子病理生理學,從而為未來的診斷和治療方法提供信息。除了深入的定量蛋白質組學研究,分析內容還包括細胞遺傳學圖譜和DNA/RNA測序,并鑒定到5種蛋白質組亞型,每種亞型都反映了跨越基因組邊界的特定生物學特征。這些蛋白質亞型中有兩種與患者預后相關,但沒有一種與特定的基因組異常有關。值得注意的是,一種亞型(Mito-AML)僅在蛋白質組中被捕獲到,其以線粒體蛋白高表達為特征,預后較差,在強化誘導化療治療中緩解率降低,總生存期縮短。功能分析表明,Mito-AML在代謝上傾向于更強的依賴復合體I的呼吸,并且對BCL2抑制劑ventoclax的治療更敏感。
參考文獻
Jayavelu, Ashok Kumar et al. “The proteogenomic subtypes of acute myeloid leukemia.” Cancer cell vol. 40,3 (2022): 301-317.e12.





