單細胞多組學再發力!揭秘人卵母細胞成熟的潛在機制


圖1 T&T-seq原理示意圖
研究材料
人GV卵母細胞、MII卵母細胞、桑葚胚;小鼠GV卵母細胞、MII卵母細胞
技術路線
- 描繪人類卵母細胞成熟過程中的轉錄組和翻譯組圖譜;
- 探究高翻譯的基因共有的翻譯調節元件;
- 探究人類與小鼠卵母細胞的獨特翻譯基因;
- 探究OOSP2蛋白對卵母細胞成熟的調控作用;
主要研究結果
1、描繪人類卵母細胞成熟過程中的轉錄組和翻譯組圖譜
研究人員通過T&T-seq對10個、單個人卵母細胞及桑葚胚進行實驗,共得到11756個GV和10559個MII翻譯基因,并將獲得的翻譯組學數據與先前文獻報道中使用100個人類GV或MII卵母細胞的蛋白質組學數據進行比較,結果顯示超過86%的GV蛋白和83%的MII蛋白被檢測到(圖2a)。此外,作者對轉錄組和翻譯組的數據進行PCA聚類分析。結果發現轉錄組的 PCA 中GV和MII卵母細胞有部分重疊,而相同樣本的翻譯組PCA結果明顯地分離了 GV 卵母細胞、MII 卵母細胞和胚胎,這表明翻譯組要比轉錄組更能夠表現GV和MII卵母細胞之間的差異(圖2b)。進一步地,研究者在轉錄組和翻譯組水平上分析了GV和MII卵母細胞中的差異表達基因,結果顯示在卵母細胞成熟過程中,大多數基因的轉錄水平保持不變或降低。此外,在成熟的卵母細胞中,基因的翻譯效率要高于未成熟的卵子。值得注意的是,大多數GV富集的基因參與細胞質過程,而MII富集的基因主要參與細胞核或染色體過程(圖2 h-j),這一結果揭示了卵母細胞成熟過程中基因表達從細胞質到細胞核的順序調節。
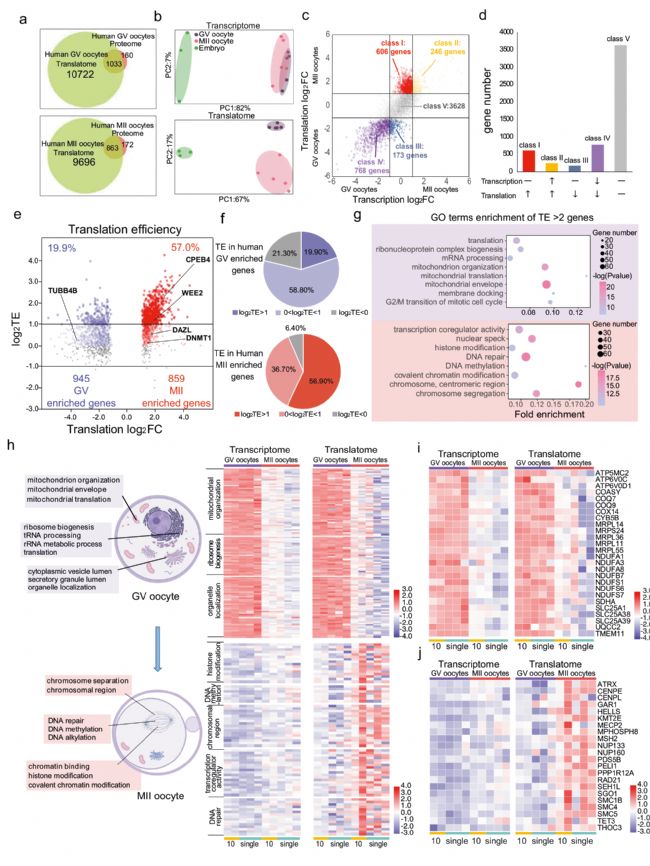
圖2 GV和MII人類卵母細胞的不同轉錄組和翻譯組表達情況
2. 探究高翻譯的基因共有的翻譯調節元件
先前對小鼠的研究表明,卵母細胞成熟過程中的高翻譯表達是由RNA結合蛋白(RBP)與3'UTR結合的翻譯調節元件所調節。然而,由于缺乏翻譯組數據集,目前尚未報道人類卵母細胞中的RBP基序。因此,研究者篩選了人類GV和MII卵母細胞中高翻譯效率[ TE(>1)] 基因的3' UTR,以確定潛在的RBP位點,并研究RBP作為潛在的翻譯調控因子。研究人員篩選出了高TE MII基因中的RBP結合基序,分別為FXR1、PCBP1、DDX3X、CPEB2和CPEB4 的結合基序。此外,研究者鑒定出與卵母細胞成熟相關的GO聚類中的高 TE基因,例如“染色體分離”、“減數分裂細胞周期”和“甲基化”等。
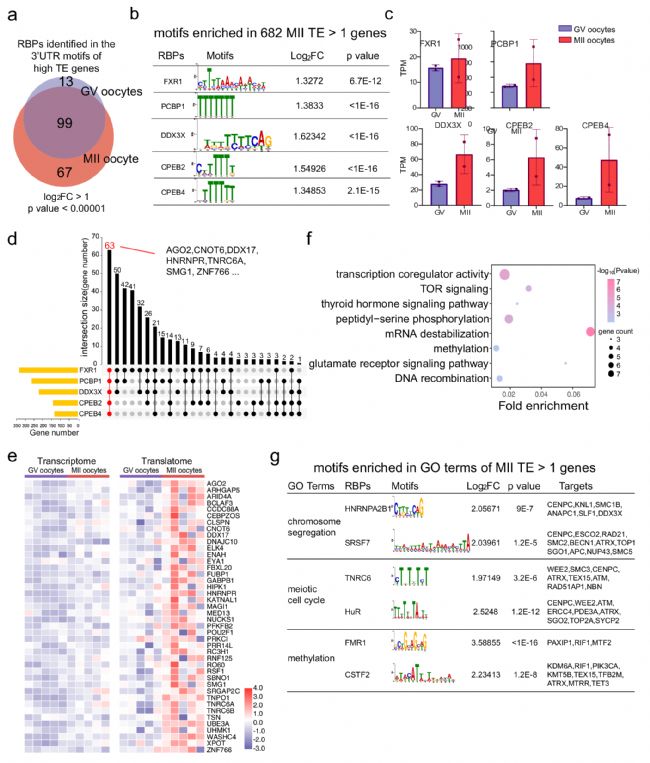
圖3 高翻譯基因3'UTR富集出的RBP結合基序
3. 探究人類與小鼠卵母細胞的獨特翻譯基因
小鼠模型常被用于研究和推斷人類卵母細胞成熟的機制,然而,人類卵母細胞可能存在獨特的翻譯表達和調控。因此,基于小鼠和人類卵母細胞的T&T-seq,研究者通過選擇人類卵母細胞中翻譯水平較高但在小鼠卵母細胞中翻譯相對較低的DEGs,分析了獨特的人類DEGs。結果發現了247個GV特異性基因和259個MII特異性基因,在這些獨特的人類MII基因中,DNMT1、MSH3、CENPK、OOSP2和AGO2在人類和小鼠中的翻譯表達趨勢相反(圖4f)。值得注意的是,在小鼠OOSP家族中,OOSP1和OOSP3蛋白都是在成熟過程中表達上調的,而OOSP2蛋白是在成熟過程中表達下調。然而在人的OOSP家族中卻正好相反。研究者發現小鼠OOSP2基因只有一個PAS基序,而OOSP1和OOSP3均有多個與PAS基序相鄰的CPE基序。相比之下,人類OOSP2是唯一同時攜帶CPE和PAS的OOSP基因(圖4)。
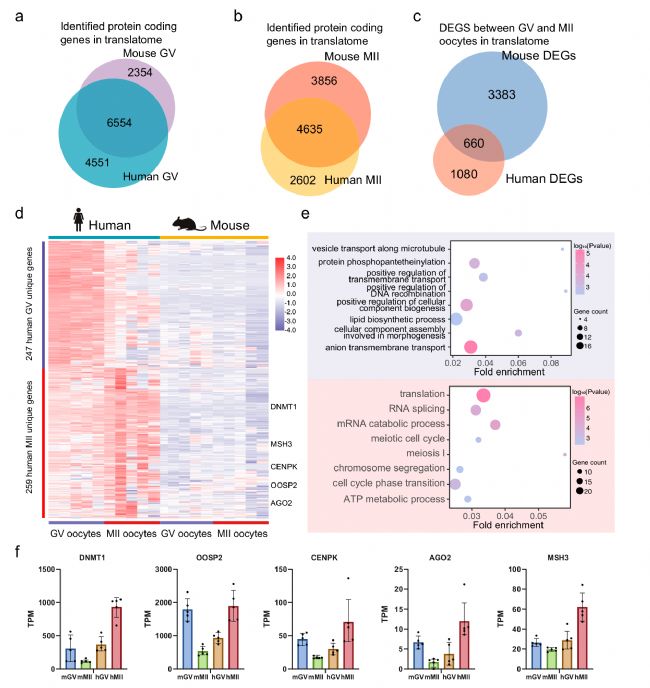
圖4 人與小鼠卵母細胞的翻譯組差異
4. OOSP2蛋白誘導卵母細胞成熟
PPI分析顯示,OOSP2可能參與卵泡產生及卵母細胞成熟。為了探究OOSP2是否對卵子的成熟具有調控作用,研究者收集了GV卵母細胞,并使用帶有延時顯微鏡的孵化器來監測卵母細胞的成熟。結果表明,添加OOSP2蛋白可以提高人卵母細胞體外成熟率,而添加OOSP2的抗體則會阻斷OOSP2蛋白的功能,從而影響卵母細胞的成熟(圖5)。此外,研究者進一步探究了OOSP2的潛在誘導基因或途徑。通過檢測與hReco-OOSP2、α-OOSP2或無任何添加劑共孵育1.5 h的人類GV卵母細胞的轉錄組和翻譯組,結果表明α-OOSP2處理的GV卵母細胞保持不成熟狀態,而hReco-OOSP2處理的GV卵母細胞更接近于成熟卵子。另外,OOSP2可以直接調控下游基因的翻譯,并通過上調特定的信號通路,如小GTPase信號通路、細胞器定位通路等,來促進卵母細胞的核質成熟(圖6)。
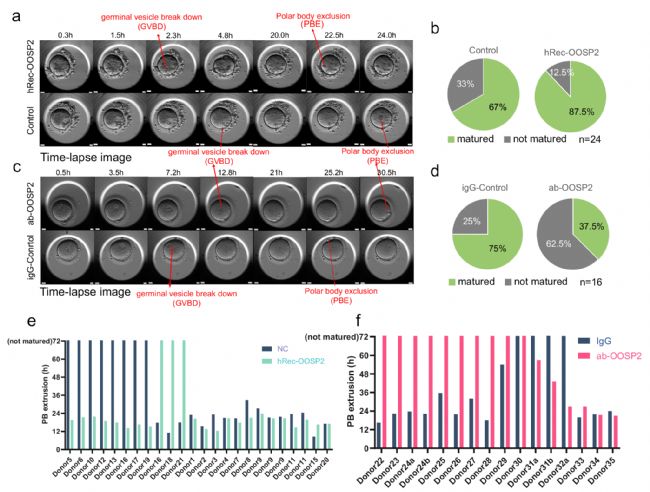
圖5 OOSP2促進人卵母細胞體外成熟
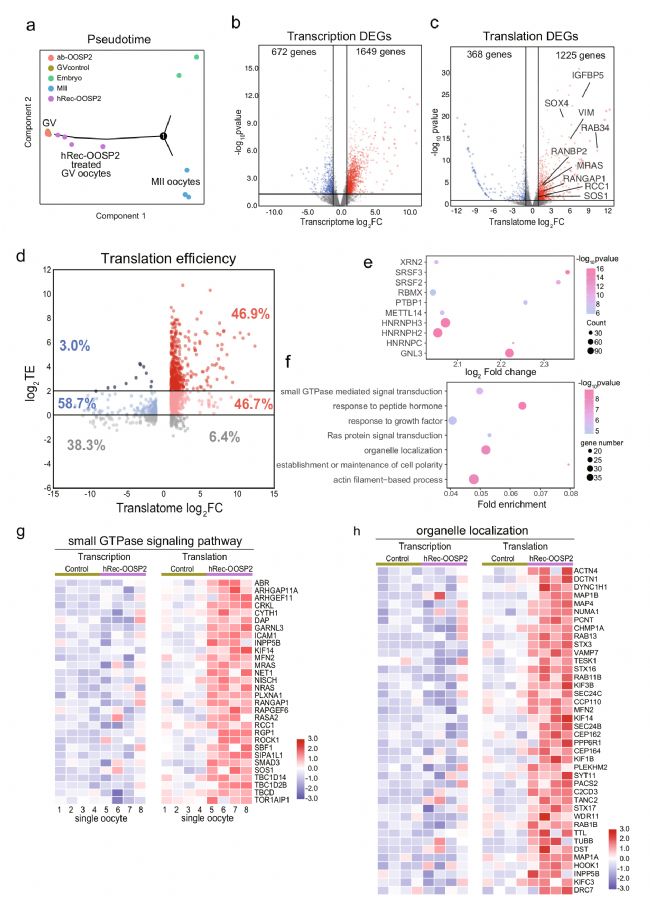
圖6 T&T-seq揭示OOSP2處理人類卵母細胞后的轉錄組和翻譯組變化
小結
研究者通過適用于單個卵母細胞的T&T-seq技術,揭示了人卵母細胞成熟過程中從細胞質到細胞核的時空順序調節; 發現了小鼠和人類的卵母細胞在成熟過程中翻譯的差異化;鑒定出OOSP2分泌蛋白可能通過調控小GTPase信號通路相關蛋白的翻譯來促進卵母細胞成熟,為臨床卵母細胞體外成熟技術提供了新的技術方法及理論依據。
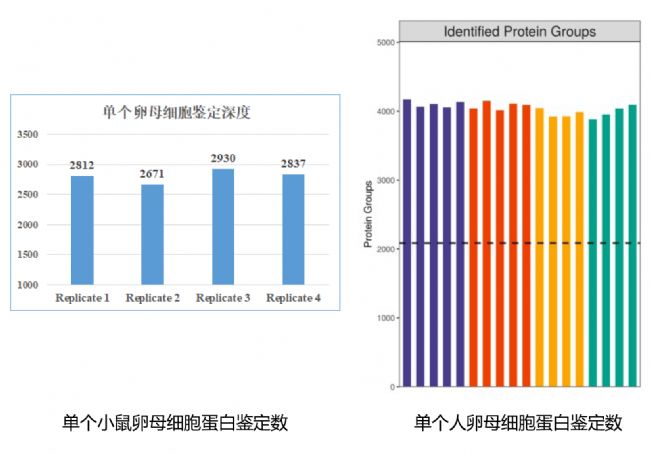
文章中所用的是單細胞翻譯組,而中科新生命自建立單細胞蛋白質組學技術平臺以來,已經在檢測數量,檢測深度上實現重大突破。針對卵母細胞、受精卵、胚胎等生殖領域樣本,中科新生命已可在單個細胞層面實現高深度的蛋白鑒定,如單個小鼠卵母細胞平均2800+蛋白鑒定數,單個人卵母細胞平均4000+蛋白鑒定數。
為了回饋廣大科研工作者的大力支持,即日起至11月30日,只要買單細胞蛋白就送單細胞測序,買一贈一!(單細胞蛋白組學滿600個細胞起贈單細胞測序)





