單細胞轉錄揭示腸道菌群加重脂肪肝


研究材料
技術路線
步驟1:HFHC飲食誘導的NASH小鼠肝臟中存在促炎性B細胞的聚集和活化,而B細胞缺陷小鼠的肝臟炎癥和纖維化得到改善
步驟2:MyD88是B細胞在NASH過程中促進肝臟炎癥、纖維化和損傷所必需的;
步驟3:NASH中的B細胞活化受到B細胞受體信號,提示B細胞活化整合了天然免疫和適應性免疫機制;
步驟4:移植NASH患者糞菌增加了受體小鼠肝臟中的B細胞積累和活化,從而加劇NASH,提示腸道菌群因素驅動了B細胞在NASH中的致病性。
研究結果
為了確定肝內B細胞在NASH進展中的作用,作者用HFHC飲食誘導小鼠NASH,并分離出免疫細胞后識別主要的免疫細胞群,HFHC組的B細胞顯著增加。為了評估B細胞中細胞因子的表達情況,作者發現分別在丙二醇甲醚醋酸酯(PMA)和脂多糖(LPS)刺激后,NASH小鼠表達TNF-α和IL-6的B細胞數量增加。同時,來自NASH小鼠的B細胞也顯示出細胞表面主要組織相容性復合物 (MHC) I類和II類以及CD86的上調,這表明活化和抗原呈遞能力增加。以上結果表明,NASH小鼠中肝內B細胞積累,并釋放促炎細胞因子以及呈遞抗原的能力增加。
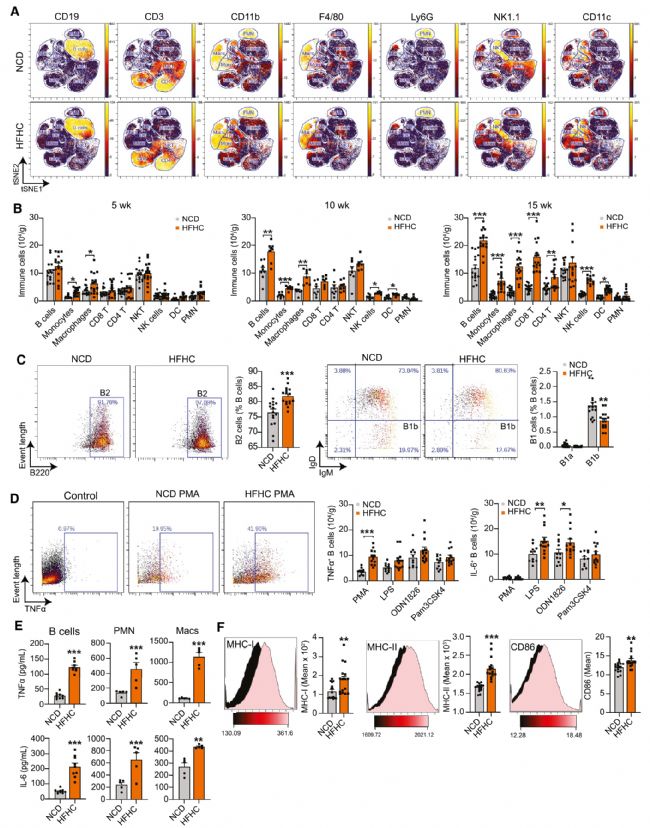
圖1 促炎性B細胞在NASH小鼠的肝臟中積累
2. NASH小鼠肝內B細胞顯示促炎基因譜
為了更好地了解NASH如何改變B細胞的轉錄組譜,作者對來自NCD和HFHC肝臟的免疫細胞進行了單細胞轉錄組測序,發現24個CD45+免疫細胞簇。作者主要關注了B細胞簇的基因表達譜,發現炎癥基因Il1b、S100a8等在HFHC肝臟B細胞中表達增加。為了驗證單細胞轉錄組對B細胞表達譜的檢測能力,作者還對HFHC和NCD小鼠肝臟B細胞進行了常規RNA-seq,同樣驗證了幾個促炎基因在HFHC肝臟B細胞中上調。為了解釋這些數據的生物學意義,作者使用 Ingenuity Pathway Analysis (IPA) 來檢測基因表達模式,發現參與炎癥和TLR信號傳導的上游調節因子的激活,以及IL10RA和SOCS1的抑制,并且富集到活躍的炎癥途徑。以上結果顯示NASH小鼠的B細胞活化和炎癥表型增加。
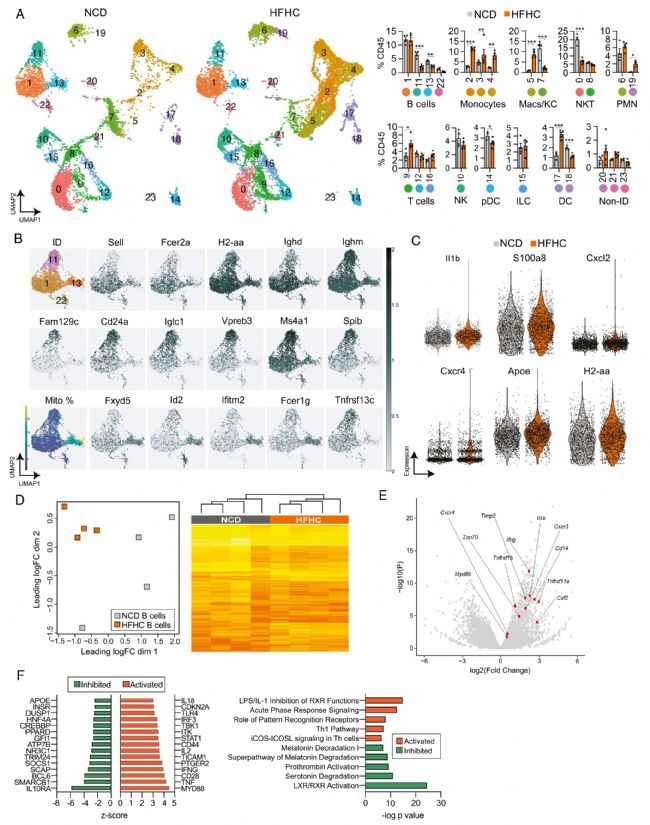
圖2 肝內B細胞在NASH期間顯示出促炎基因譜
3. B細胞缺陷可改善NASH
為了確定B細胞是否在NASH的發病機制中起直接作用,作者評估了HFHC喂養的B細胞缺陷μMT小鼠的NASH進展。HFHC μMT小鼠顯示出NAS評分較低,且轉錄組數據表明,在HFHC μMT小鼠中,促炎基因的表達顯著降低,B細胞數目顯著減少,并且HFHC μMT小鼠纖維化明顯減少,纖維化形成基因表達降低,而這些變化在NCD WT和NCD μMT小鼠中并未檢測到,該結果說明在HFHC喂養后,B細胞可以引起代謝和炎癥紊亂。
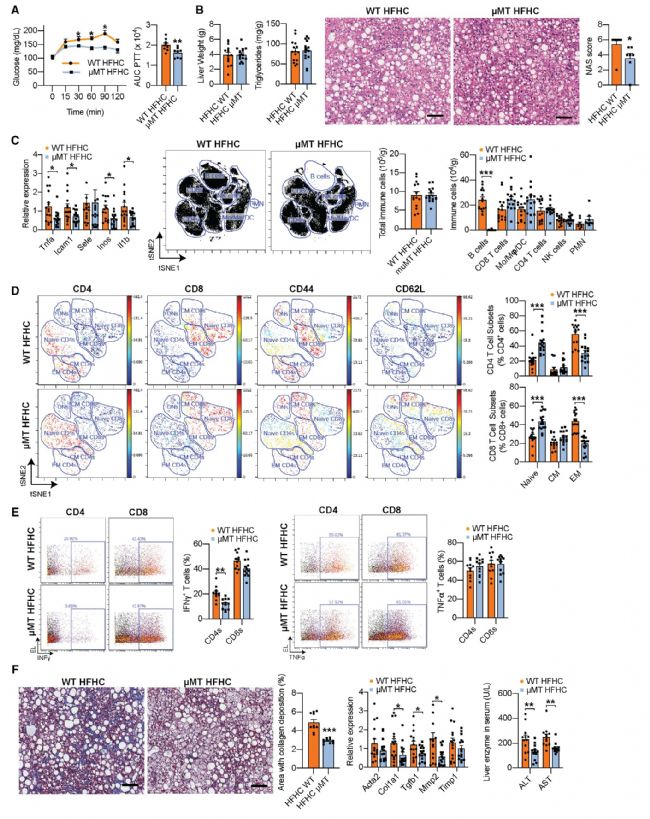
圖3 B 細胞缺乏可改善NASH期間的炎癥和纖維化
4. 促炎基因MyD88介導NASH中B細胞的促炎功能
RNA-seq分析確定MyD88是HFHC小鼠肝B細胞中促炎基因的上游調節因子,為了研究B細胞固有的MyD88信號傳導是否影響NASH進展,作者構建了B細胞特異性缺失 MyD88 (B-MYD) 的小鼠,HFHC喂養后發現B-MYD HFHC小鼠NAS評分較低。雖然B-MYD HFHC和WT HFHC小鼠之間的總數和亞群免疫細胞群沒有差異,但B-MYD HFHC小鼠的肝內B細胞MHC-I和MHC-II減少,這表明TLR介導的激活降低了抗原的呈遞能力。以上結果表明,B細胞需要MyD88來促進NASH的肝臟炎癥、纖維化和損傷。
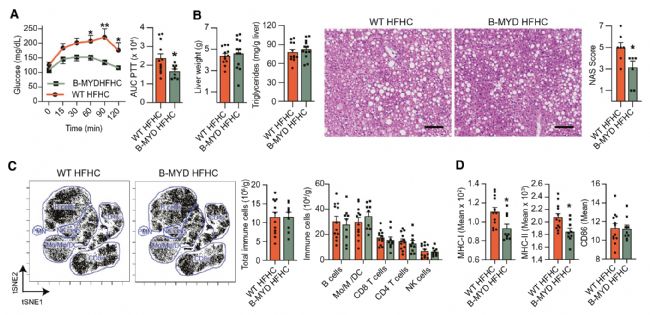
圖4 MyD88介導NASH中B細胞的炎癥功能
5. BCR刺激激活肝內B細胞
BCR與抗原結合產生的激活信號是B細胞活化的第一信號,接下來作者探究了在NASH過程中肝內B細胞的激活是否與BCR信號有關,因BCR信號傳導在Nur77基因的控制下誘導綠色熒光蛋白 (GFP) 表達,作者給Nur77-GFP小鼠喂食NCD或HFHC,結果發現HFHC Nur77-GFP小鼠的GFP+肝內B細胞的頻率和數量顯著增加,表明在NASH期間的激活涉及肝臟中的BCR信號。該結果表明,NASH中,B細胞的活化受到BCR信號刺激。
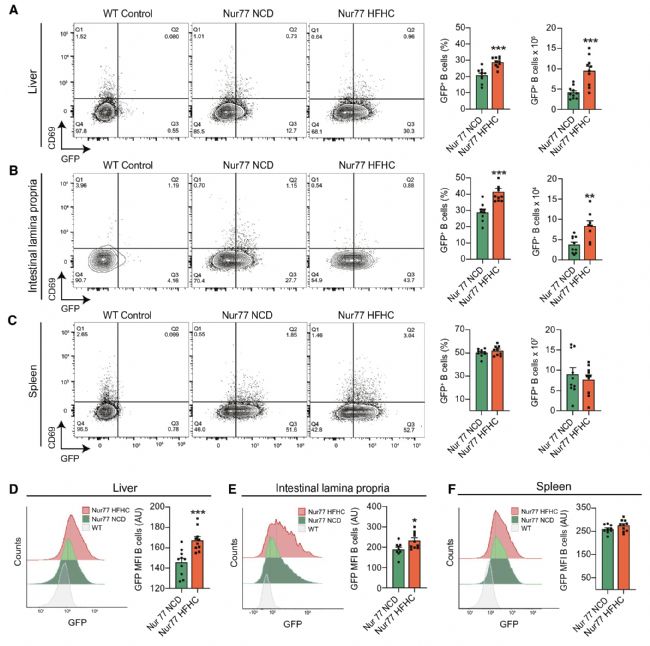
圖5 B細胞通過BCR被激活
6. 腸源性微生物因子促進肝內B細胞活化
為了研究NAFLD相關菌群失調產生的細菌產物是否促進肝內B細胞活化,作者構建了FMT小鼠模型,與健康FMT小鼠相比,NAFLD FMT小鼠表現出擬桿菌門和變形菌門豐度增加,該結果與NAFLD供體的菌群比例具有高度相似性。且NAFLD FMT小鼠NAS評分略有增加,肝內B細胞數量增加,抗原呈遞和共刺激分子的表達增加,纖維化輕微增加。這些數據表明,腸道菌群中與NAFLD相關的變化足以誘導肝臟中B細胞的積累和活化,同時將肝臟病理學的各個方面從人類供體傳遞給受體小鼠。
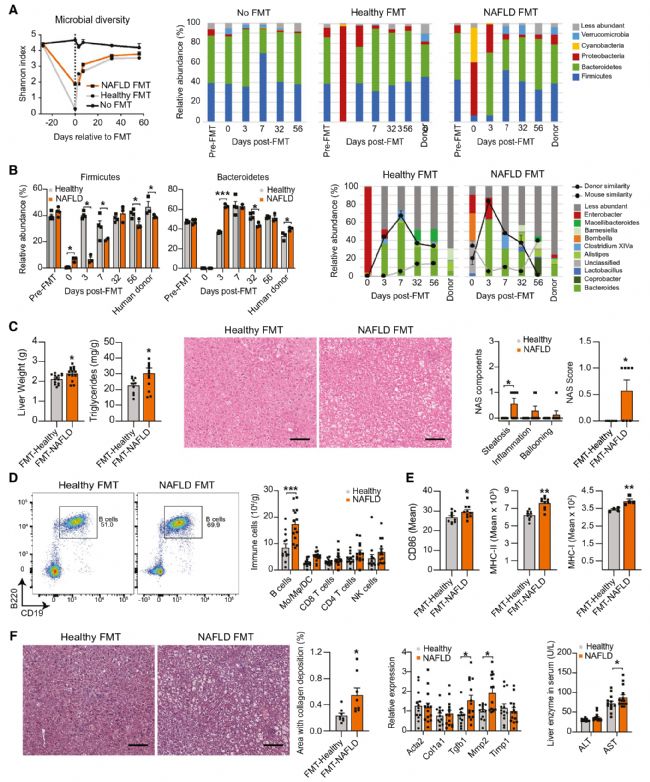
圖6 腸源性微生物因子促進肝內B細胞活化
結論





