非靶代謝組學在光調節代謝神經機制中的應用

對于地球上的生命來說,光是最重要的環境因素之一。在哺乳動物中,光感知主要依賴于視網膜光感受器。光除了激活負責圖像形成視覺的傳統視錐(Cones)視桿(Rods)光感受器外,還可以直接激活表達視黑素的感光視網膜神經節細胞(ipRGCs),其可支配多個下游腦區從而調控瞳孔對光反射、晝夜節律、睡眠和情緒認知功能。公共衛生研究表明,過多人造光源暴露是造成代謝紊亂的高風險因素之一。然而,光調節代謝的神經機制仍然不是很清楚。
2023年1月19日,中國科學技術大學生命科學與醫學部薛天教授研究團隊在Cell上在線發表了題為“Light modulates glucose metabolism by a retina-hypothalamus-brown adipose tissue axis”的重要研究成果。該工作綜合組學技術、大量神經環路示蹤和操控手段、葡萄糖耐受性檢測、肩胛間棕色脂肪組織(iBAT)溫度檢測等方法,深入在小鼠和人上揭示了光感知壓抑棕色脂肪組織產熱并誘發血糖不耐受的神經機制。中科新生命非常榮幸參與了該研究中非靶向代謝組學檢測的相關工作。

研究材料
小鼠、人
技術路線
步驟1:GT的光調控依賴 ipRGCs;
步驟2:ipRGC-下丘腦SON投射介導GT的光調控;
步驟3:GT的光調控依賴SONAVP-PVN投射;
步驟4:GT的光調控需要PVN投射到髓質;
步驟5:光通過阻斷BAT的自適應產熱作用而降低GT;
步驟6:人類GT的光調控依賴于BAT活性。
研究結果
1. GT的光調控依賴 ipRGCs
作者首先在暗/光照射下對小鼠進行了葡萄糖耐量試驗(IPGTT)以確定光對葡萄糖代謝的影響,并將葡萄糖耐量(GT)量化為曲線下面積(AUC)。結果發現與在光照下測試的野生型(WT)小鼠相比,在黑暗條件下測試的小鼠表現出顯著更低的AUC(表明GT增加)。此外還發現當光可以有效激活ipRGCs時,光可調節GT,同時也證實了光對GT的影響與晝夜節律階段(白天或夜晚)無關(圖1)。
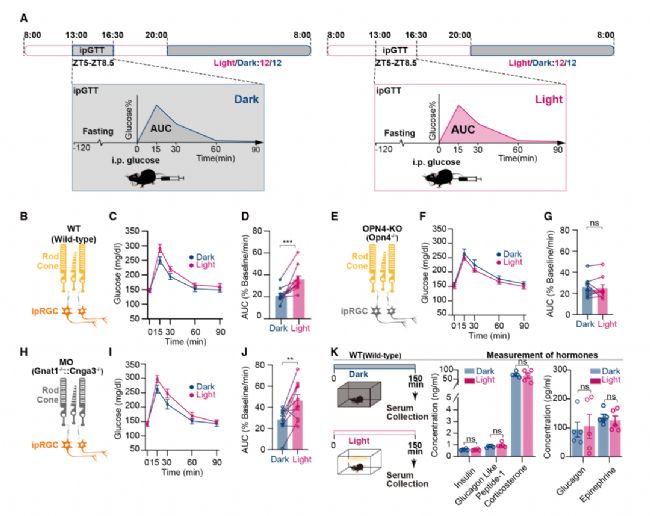
圖1 光通過ipRGCs降低GT
作者進一步研究了光誘導的糖代謝相關激素和營養物質的變化,包括胰島素、皮質酮、胰高血糖素、腎上腺素、乳酸、非酯化脂肪酸、去甲腎上腺素、生長激素、亮氨酸、4-OH-異亮氨酸、纈氨酸和膽固醇等,發現均未發生顯著變化。這些數據表明,GT可能存在直接的神經回路介導光的調節作用(圖2)。
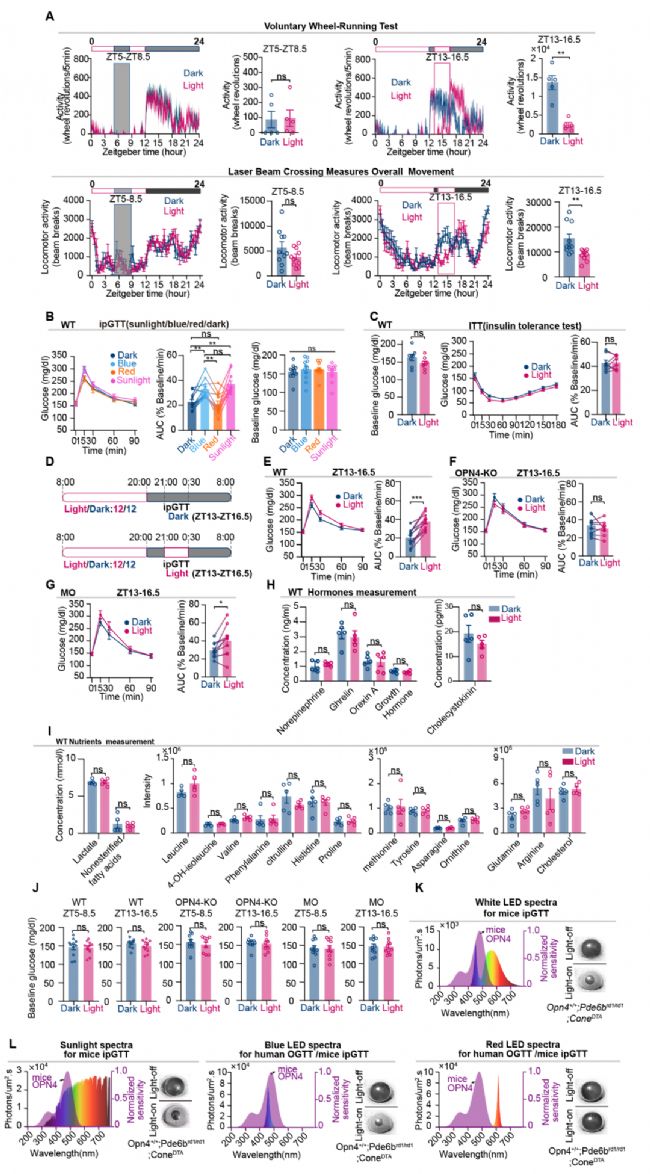
圖2 夜間光照降低GT
2. ipRGC-下丘腦SON投射介導GT的光調控
為進一步確定光顯著下降血糖代謝耐受性這一生理過程是否由光擾亂節律所致,還是光通過直接的神經環路介導。作者對與IpRGCs有較密集連接的下丘腦視交叉上核(SCN)和視上核(SON)核團分別損毀,以評估它們對光介導的GT降低的貢獻。結果發現SCN損傷消除了晝夜節律,但對光誘導的AUC差異沒有影響。而SON損傷則完全阻止了GT的光調控,同時保持晝夜節律不變。進一步通過基因敲除和化學遺傳學手段證實了ipRGCs向SON的投射直接介導了光對GT的影響的結論。同時也發現支配SON的RGCs中,有83%的IpRGCs(圖3)。
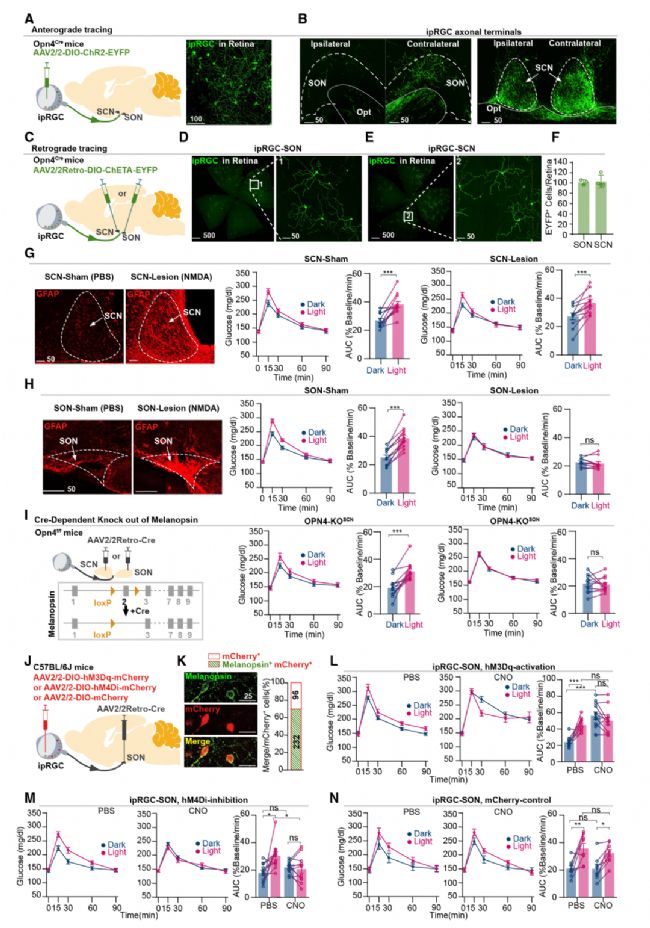
圖3 ipRGC-下丘腦SON投射介導了GT的光調控
3. GT的光調控依賴SONAVP-PVN投射
SON主要包含兩種神經元亞型,抗利尿激素(AVP)和催產素(OXT)能神經元。結合神經環路示蹤和操控手段,發現SONOXT和SONAVP神經元都接收了來自ipRGCs的投射,SONOXT逆行標記的ipRGCs大約是SONAVP的5倍。通過化學遺傳學抑制兩類神經元,發現光照下的AUC降低到黑暗中觀察到的水平。這些數據表明SONOXT和SONAVP神經元都是GT光調控所必需的。此外,也發現了SONAVP和SONOXT神經元之間的相互投射。已知SON會投射到下丘腦室旁核(PVN),這是控制新陳代謝的重要大腦區域。作者也證實了SONAVP神經元是SON到PVN的主要輸出神經元(圖4)。
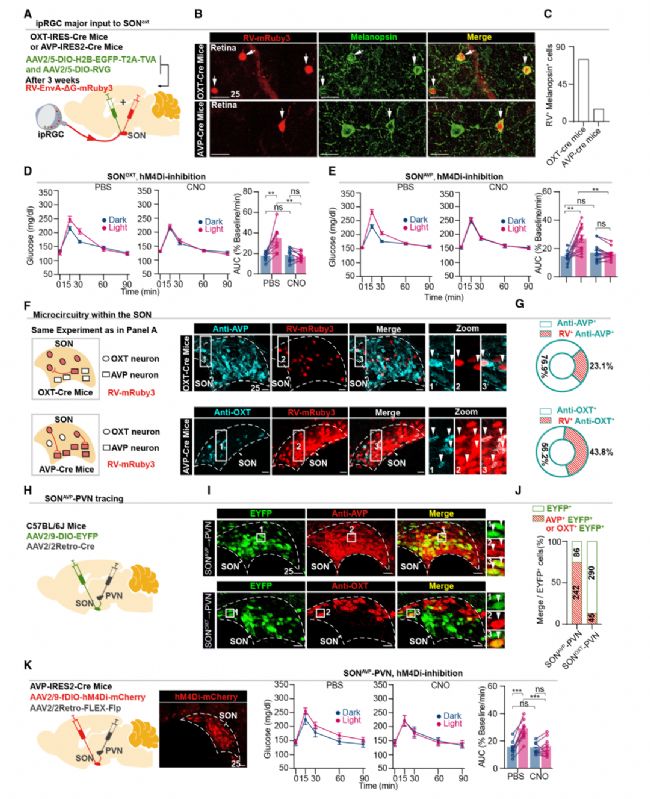
圖4 SONAVP-PVN投射介導GT的光調控
4. GT的光調控需要PVN投射到髓質
作者進一步通過追蹤等實驗研究了光調節GT通路中的下游靶點,使GFP在SON支配的PVN神經元中選擇性表達,發現在髓質的孤束核(NTS)中有密集的GFP陽性軸突末端標記。SONAVP,而不是SONOXT神經元作為輸出神經元,通過PVN控制NTS。追蹤實驗還發現向RPa(中縫蒼白核)傳遞PVN輸入的NTS神經元主要是GABA能神經元。結果表明光通過ipRGC-SONOXT-SONAVP-PVN-NTSVgat(孤束核的GABA能抑制性神經元)-RPa通路調節GT(圖5)。
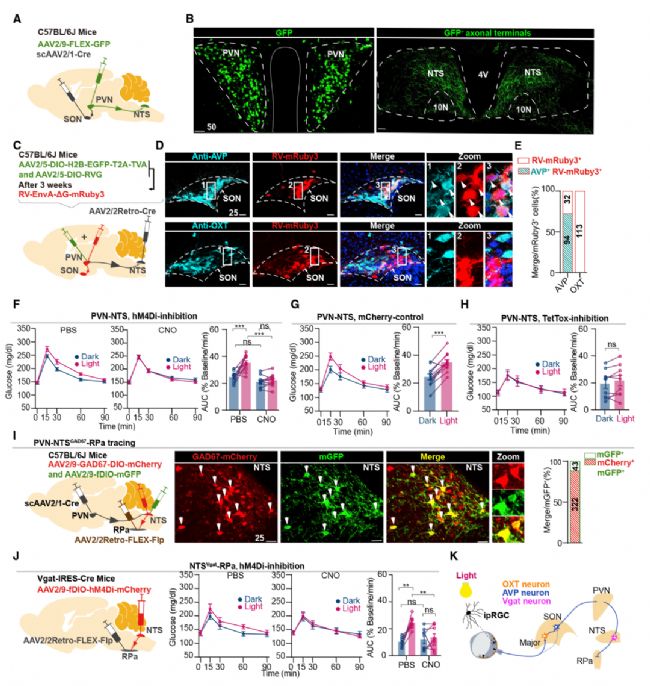
圖5 PVN-NTSVgat-RPa 投射介導GT的光調控
5. 光通過阻斷BAT的自適應產熱作用而降低GT
位于RPa內的交感前運動神經元可直接調節棕色脂肪組織(BAT)產熱,作者進一步研究了光是否調節BAT產熱。在黑暗條件下,單次葡萄糖注射誘導了BAT產熱的適應性變化,iBAT表面溫度升高,而光則阻礙了這種適應性產熱。同時肩胛內表面溫度升高主要由iBAT驅動,而不是由白色/米色脂肪組織驅動。這表明光確實通過交感神經通路調節葡萄糖誘導的BAT產熱。在基因敲除小鼠模型研究中發現光通過β3-腎上腺素能信號通路阻斷BAT介導的適應性產熱,從而降低GT。進一步研究發現當選擇性抑制神經通路,即SONAVP-PVN, PVN-NTS和NTSVgat -RPa時,光壓抑BAT介導的適應性產熱現象消失。表明光通過視網膜ipRGC-SON-PVN-NTS-RPa通路阻斷了BAT的適應性產熱,從而降低了GT(圖6)。
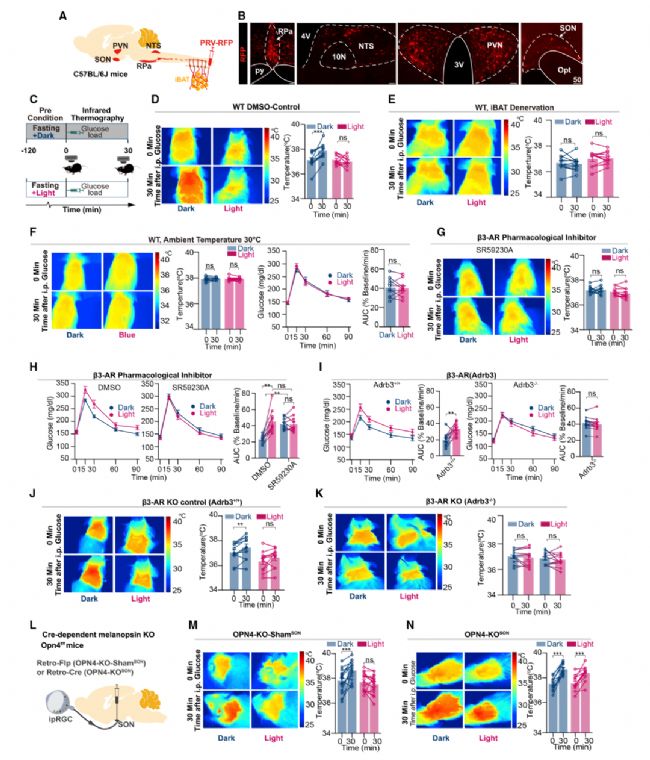
圖6 光通過阻斷BAT介導的適應性產熱降低GT
6. 人類GT的光調控依賴于BAT活性
為了評估光是否同樣降低人類的GT,在暗/光照射下對健康志愿者進行了葡萄糖耐量試驗,發現在光照條件下表現出更高的AUC(降低GT),同時證實光對人類GT的影響與晝夜節律有關,相較于白天,人體在夜晚表現出更差的血糖耐受性。接著研究人員在藍光(ipRGC敏感)與紅光(ipRGC不敏感)下評估了人類的GT,結果顯示僅在藍光照射下人血糖耐受性下降。進一步在熱中性溫度(BAT介導的適應性產熱受到限制)下評估了BAT產熱在人體葡萄糖調節中的相關性,發現AUC不再受光照(白光LED燈)的影響。暗示在人上,光下降血糖耐受性的潛在機制和小鼠一致。即光由人的ipRGC感知,并通過降低脂肪組織活性來下降血糖耐受性(圖7)。
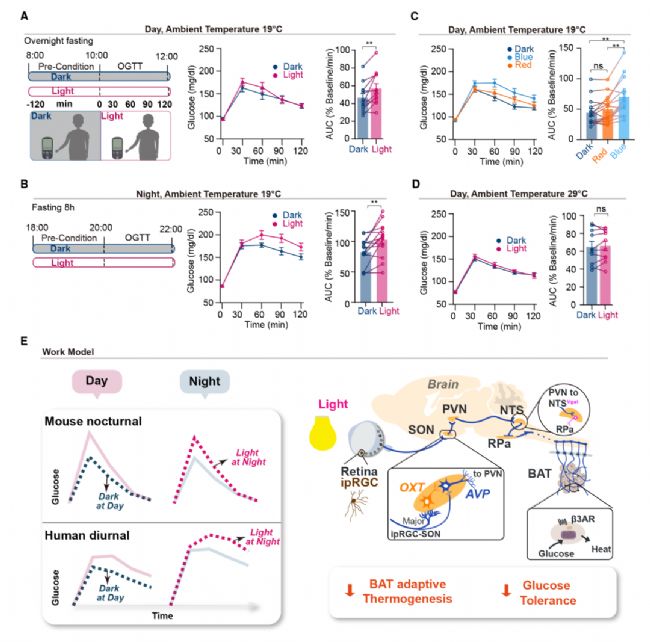
圖7 人類GT的光調控依賴于BAT活性
小結
該項工作在小鼠模型上系統研究了環境光暴露誘發血糖不耐受的感光、神經環路和外周效應機制:光可以直接通過激活支配下丘腦視上核的視網膜神經節細胞,繼續激發室旁核神經元投射到孤束核的GABA能神經元,通過β3-腎上腺素能信號通路阻斷棕色脂肪組織的適應性產熱,導致葡萄糖耐量下降。此外,在人身上也發現一致的現象,這可能解釋了人工光與代謝失調之間的聯系,并揭示了代謝紊亂的潛在預防和治療策略(圖8)。
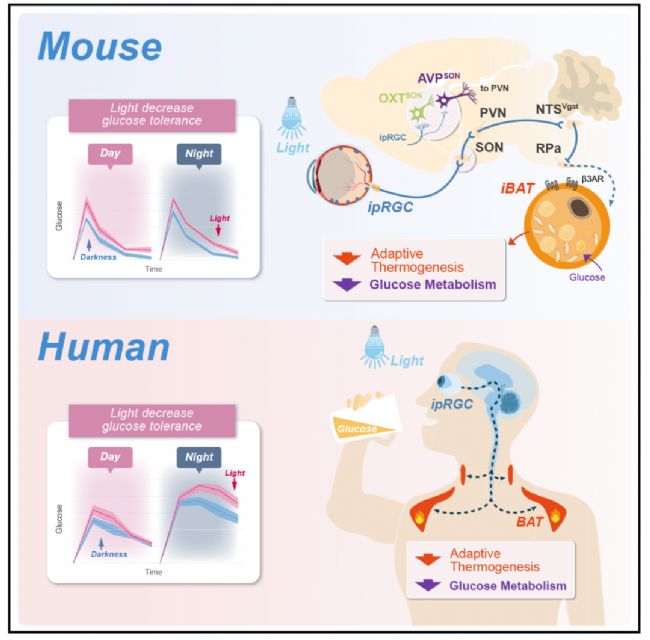
圖8 光感知壓抑棕色脂肪組織產熱并誘發血糖不耐受的神經機制
中科優品推薦
【中科新生命】建立了完整的代謝組學服務平臺,包括空間代謝組學、非靶向代謝組學、靶向/高通量靶向代謝組學、代謝流,單細胞代謝組即將上新,幫助老師從代謝物角度系統地解析數據,挖掘關鍵生物學信息。歡迎感興趣的老師前來咨詢。





