體外血管生成三維培養模型構建應用指南
血管生成(Angiogenesis)是從原有的血管出芽形成新生血管的過程,在許多生理和病理過程中起重要作用,例如腫瘤生長和轉移、炎癥等。血管生成微環境對于開發針對這些病理的療法至關重要,內皮細胞可以從靜止狀態轉變為血管生成狀態,導致遷移,這在常規 2D 培養方法中難以檢測到。重要的是,缺乏精確模擬這種具有可調性質的細胞外基質(ECM)的體外模型,以深入了解這種微環境條件。
目前血管生成的研究高度依賴于天然ECM(如Matrigel),其具有不可調的水凝膠組成成分和性質。這種傳統方法只允許對培養基中的生長因子或抑制劑進行實驗,不支持關于ECM的某些特性如何影響血管生成的研究。因此,非常需要具有可調血管生成微環境的可靠人類血管生成模型,以增加我們對于內皮細胞相關的病理學的理解。這種先進的模型可以提供關于內皮細胞如何經歷形態變化或與鄰近細胞相互作用以響應某些刺激影響血管生成的新信息,并增加我們對血管疾病、中風、高血壓等病理生理學的理解。
TheWell提供兩款VitroGel血管生成試劑盒:
✦ VitroGel Angiogenesis Assay Kit(即用型體外血管生成試劑盒):VitoGel AAK(貨號:VHM06-K),具有固定的水凝膠機械強度,含有不同的生長因子添加物來調節水凝膠內的生長因子;
✦ VitroGel Angiogenesis Assay HC Kit(高濃度體外血管生成試劑盒):AAK-HC(貨號:TWG011-K),具有可調的高濃度水凝膠,可以完全控制水凝膠的機械強度和生長因子添加物來調節水凝膠內的生長因子。
以下實驗數據與結果皆來源于TheWell實驗室。
我們使用即用型VitroGel Angiogenesis Assay Kit和高濃度VitroGel Angiogenesis Assay HC Kit來證明水凝膠特性修飾對人臍靜脈內皮細胞(HUVEC)血管生成檢測的影響。
實驗從2D水凝膠包被培養方法開始,其中我們在細胞培養板底部從VitroGel AAK制備了一層厚厚的水凝膠,并將HUVEC細胞接種在水凝膠層的頂部。HUVEC血管生成對不同的水凝膠組成(血管內皮生長因子(VEGF)陽性,VEGF陰性或無生長因子)表現出顯著差異,即使使用相同的內皮細胞完全培養基,也顯示不同的管腔結構和血管形成。另一方面,我們能夠通過使用VitroGel AAK-HC來調節水凝膠濃度。數據表明,除了基質內的生長因子外,機械性能還會嚴重影響細胞活力和管形成 - 由于依賴于天然ECM的傳統實驗的限制,這種影響以前是未知的。當HUVEC被包裹在水凝膠中時,同樣的觀察結果可以進一步擴展到3D細胞培養。
結果顯示水凝膠的可調節性和機械強度以及使用VitroGel水凝膠的最佳濃度,培養時間和3D血管結構形成的影響。我們證明生長因子不僅存在于培養基中,而且存在于水凝膠本身中,顯著影響管的形成。用無異源可調節的VitroGel水凝膠系統代替天然ECM,研究人員能夠研究微環境的物理、化學、生物學特性與細胞行為之間的關系。
簡而言之,兩種體外水凝膠血管生成試劑盒是研究人員探索血管生成的強大工具。我們希望這些試劑盒能助力研究人員和研究團隊建立復雜的組織模型,以提升藥物篩選過程、細胞侵襲測定以及內皮細胞和血管生成的疾病相關研究。
材料和方法
一、細胞培養
將人臍靜脈內皮細胞(HUVEC)維持在含有10%胎牛血清(FBS)和1x青霉素-鏈霉素抗生素的內皮細胞完全培養基(EGM)中。當細胞達到80-90%融合率時進行細胞傳代。
二、調節水凝膠性能
✦ 01、研究水凝膠中生長因子對血管生成的影響
為了研究水凝膠內生長因子對細胞生長和血管生成的影響,將HUVEC與即用型VitroGel AAK試劑盒一起使用。兩種類型的VitroGel AAK添加物可用于直接與VitroGel AAK混合。VitroGel AAK Supplement 1(不含VEGF)用于制備VEGF陰性水凝膠,VitroGel AAK Supplement 2(含VEGF)用于制備VEGF陽性水凝膠。為了制備不含額外生長因子的水凝膠,我們使用VitroGel AAK水凝膠直接與EGM基礎培養基混合(請閱讀VitroGel AAK試劑盒的操作說明書以了解詳細的水凝膠制備)。
✦ 02、研究水凝膠的機械強度對血管生成的影響
使用高濃度VitroGel AAK-HC試劑盒調節水凝膠的機械強度。將VitroGel AAK-HC水凝膠與VitroGel AAK稀釋溶液分別以1:0、1:1和1:3(v/v)的比例混合。然后將稀釋的水凝膠混合物與VitroGel AAK添加物混合,以根據以下方法說明制備2D水凝膠包被培養物或3D培養物(請閱讀VitroGel AAK-HC試劑盒的操作說明書以了解詳細的水凝膠制備)。
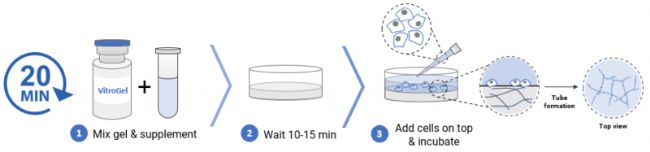
三、2D水凝膠包被培養
使用胰蛋白酶消化細胞,然后以0.5 x106細胞/mL的接種密度重懸于內皮細胞完全培養基+ 10% FBS中。使用以下步驟(以AAK Supplement 1為例)制備用于細胞培養的VitroGel AAK和VitroGel AAK-HC水凝膠。✦ 01、將 1 mL 水凝膠溶液加入 500 μL AAK Supplement 1 中,輕輕上下顛倒 5-10 次以充分混勻。
注意:保持VitroGel AAK溶液和AAK Supplement 1的混合比例為2:1(v / v)。
✦ 02、將 50 μL 水凝膠混合物轉移到 96 孔板中。輕輕旋轉孔板以確保均勻覆蓋孔底部。
✦ 03、室溫下靜置10-15分鐘以形成軟凝膠。
注意:在此期間,不要搖晃孔板干擾軟凝膠的形成。
✦ 04、小心地將 50 μL 細胞懸液添加到凝膠頂部。在 37°C 下孵育。
✦ 05、將細胞在37°C孵育,每隔一天更換50-80%的頂部培養基。
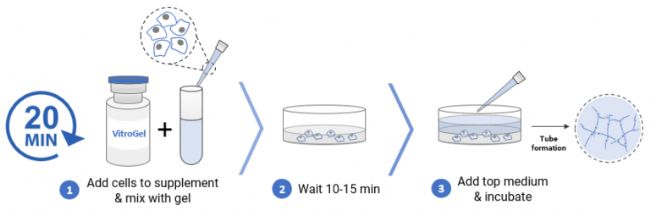
四、3D培養
對于HUVEC的3D培養,使用VitroGel AAK和VitroGel AAK-HC觀察血管的形成和結構。使用以下步驟制備水凝膠-細胞混合物(以AAK Supplement 1為例):✦ 01、在AAK Supplement 1中制備細胞懸液。推薦的細胞濃度為 1-2 x106細胞/mL。
✦ 02、將 1 mL 水凝膠溶液添加到上一步的 500 μL 細胞懸液中。輕輕上下顛倒 5-10 次以徹底混勻,將水凝膠和細胞懸液保持在 2:1 (v/v) 的比例。
✦ 03、將 50 μL 水凝膠混合物轉移到 96 孔板中。輕輕旋轉孔板以確保均勻覆蓋每個孔的表面。
✦ 04、室溫下靜置10-15分鐘以形成軟凝膠。
注意:在此期間,不要搖晃孔板干擾軟凝膠的形成。
✦ 05、小心地在孔頂部添加 50 μL 額外培養基以覆蓋水凝膠。
✦ 06、置于37°C的培養箱中孵育,每隔一天更換50-80%的頂部培養基,以免影響培養板中的水凝膠狀態(或根據實驗設計更換覆蓋培養基)。
五、熒光成像
對于熒光成像,將細胞固定并用Actin Green和NucBlue染色,以標記F-actin以及細胞核。 詳細步驟如下:
✦ 01、用移液管小心地移除水凝膠頂部的培養基。
✦ 02、水凝膠用100 μL DPBS洗滌。將洗滌緩沖液留在水凝膠上1分鐘,然后移除。
✦ 03、將100 μL細胞固定溶液(4%甲醛)加入到水凝膠表面。
✦ 04、孔板置于室溫下孵育15-30分鐘,然后移除固定液。
✦ 05、用 100 μL DPBS 輕輕洗滌水凝膠 3 次,使洗滌緩沖液在兩次洗滌之間靜置1分鐘。
✦ 06、加入 100 μL 0.1% Triton X-100),并在室溫下孵育 5 分鐘。
✦ 07、小心地移除Triton X-100,用100 μL DPBS洗滌孔三次,使洗滌緩沖液在兩次洗滌之間靜置1分鐘。
✦ 08、向水凝膠中加入 100 μL 封閉液(3% BSA的DPBS溶液),并在室溫下孵育 60 分鐘。
✦ 09、去除封閉液,添加ActinGreen 488或DRAQ5 ReadyProbes 試劑(ThermoFisher,按照操作說明添加)。
✦ 10、將孔板孵育30分鐘,然后加入NucBlue Fixed Cell Stain Ready Probes試劑(ThermoFisher)。
✦ 11、孔板避光孵育5分鐘并進行熒光成像。
六、結果和討論
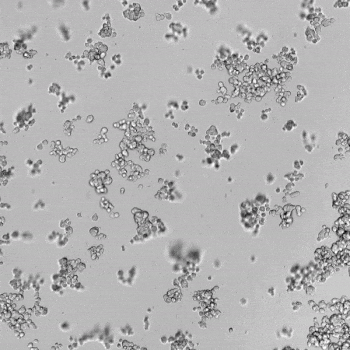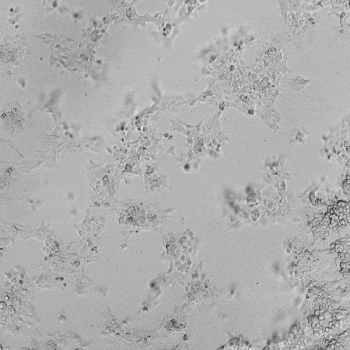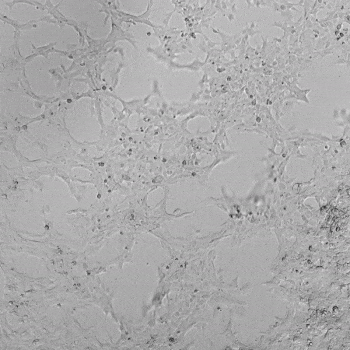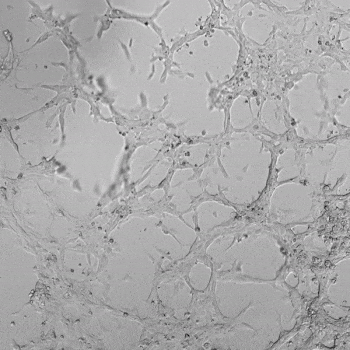
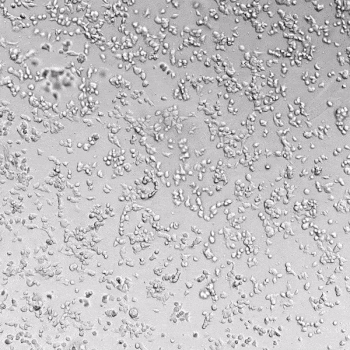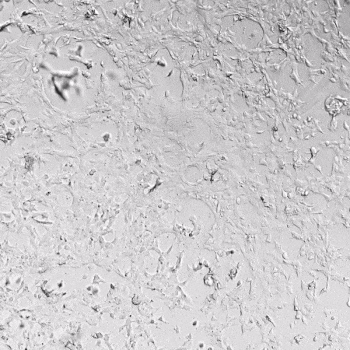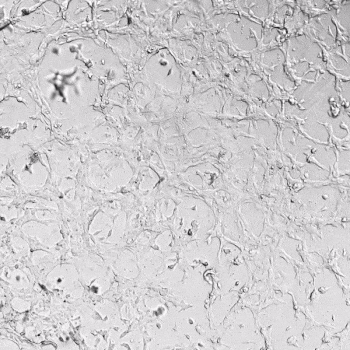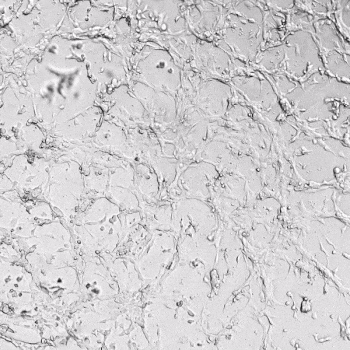
圖1. VitroGel AAK水凝膠頂部內皮細胞的血管生成
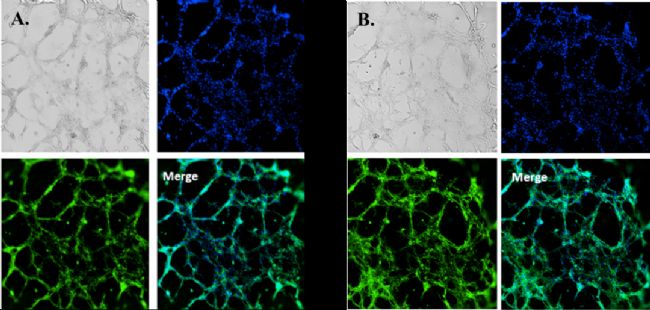
圖2. HUVEC細胞在VitroGel AAK水凝膠(A)/VitroGel AAK-HC水凝膠(B)與AAK Supplement 2上的管狀形態。將細胞固定并用DAPI(藍色)和actin green(綠色)染色。
✦ 當使用VEGF陰性添加物(VitroGel AAK Supplement 1)的水凝膠時,在VitroGel AAK和VitroGel AAK-HC水凝膠的兩種情況下,HUVEC能夠在表面上附著和生長而不會形成管(圖3)。圖2和圖3表明,盡管在兩種水凝膠條件下使用了相同的完全培養基,但水凝膠中的VEGF生長因子會顯著影響管的形成。

圖3.HUVEC細胞在VitroGel AAK水凝膠(A)/VitroGel AAK-HC水凝膠(B)與AAK Supplement 1上的生長形態。將細胞固定并用DRAQ5(紅色)和actin green(綠色)染色。
✦ 接下來,我們旨在比較在補充或不補充生長因子的情況下制備的VitroGel AAK水凝膠上的HUVEC生長,以突出生長因子對水凝膠血管生成的影響。在該實驗中,在水凝膠頂部使用相同的完整內皮生長培養基進行細胞培養。在圖4的不同時間點獲得具有VitroGel AAK Supplement 2或不含生長因子的水凝膠頂部的HUVEC細胞生長。圖4B和4D顯示了在水凝膠表面上生長的細胞,其中不含生長因子添加物,而圖4A和4C顯示了給予VitroGel AAK-Supplement 2的細胞的圖像。
有趣的是,盡管在兩種培養條件下都使用了完整的細胞培養基,但與未從水凝膠中補充生長因子的細胞相比,延時視頻顯示,添加細胞生長因子后,水凝膠中的細胞附著和血管生成有顯著改善。
這些圖像為水凝膠添加物對HUVEC增殖和活力的益處提供了進一步的證據,因為與接受水凝膠生長因子支持的細胞相比,沒有補充生長因子的細胞清楚地顯示出更少的管腔結構(圖4D紅色箭頭)。
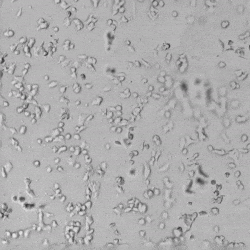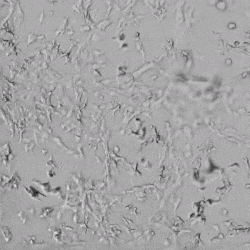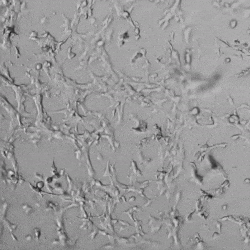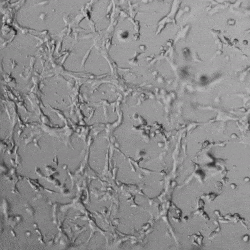
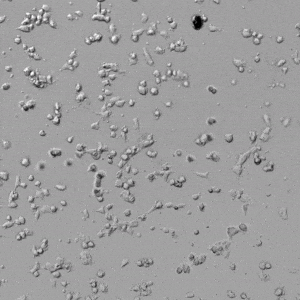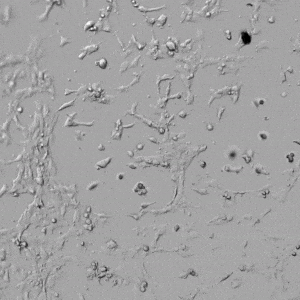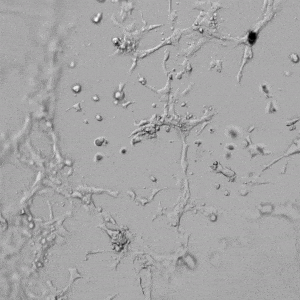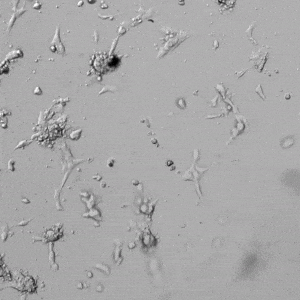
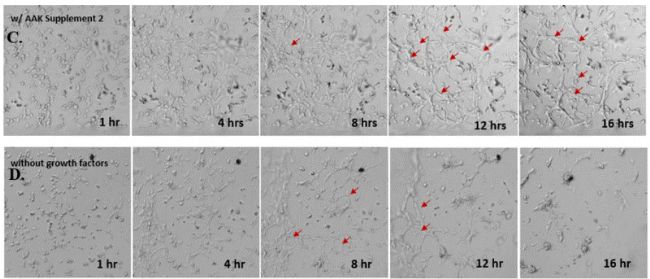
圖4.有和沒有生長因子添加物的VitroGel AAK水凝膠頂部內皮細胞生長的比較。左上)實時視頻顯示HUVEC接種在含有VEGF的AAK Supplement 2中培養18小時的血管生成圖;右上)實時視頻顯示沒有細胞生長因子的HUVEC接種;C)HUVEC細胞在不同時間點在具有AAK Supplement 2的VitroGel AAK水凝膠頂部生長;D)沒有細胞生長因子的不同時間點的HUVEC細胞生長。紅色箭頭表示管狀結構形成。
✦ 對于VitroGel AAK-HC水凝膠的研究,我們旨在提供基質的機械性能如何影響HUVEC血管生成的新方案。因此,我們制備了不同濃度的水凝膠,以實現水凝膠基體的各種機械強度。VitroGel AAK Supplement 2用于制備所有水凝膠,以消除生長因子對細胞生長的影響,以專注于機械性能的影響。這些分析的結果如圖5所示。
更強的水凝膠機械強度(即較低的稀釋比,例如1:0)導致血管生成減少,因為細胞更容易聚集導致細胞死亡。與較軟的水凝膠混合物(如 1:1 稀釋或 1:3 稀釋)相比,1:0 稀釋比例的管結構形成明顯減少。特別是,在血管生成后,1:0稀釋水凝膠表面上的細胞在大約12小時的時間點開始聚集并形成細胞球狀體。在16:1稀釋的1小時時間點觀察到類似的觀察結果,而對于最柔軟的水凝膠(1:3稀釋),細胞能夠附著在水凝膠表面并在18小時逐漸形成管結構。
水凝膠的理想情況應該是它幫助細胞適應特定物質的能力,并最終使細胞能夠很好地擴散并附著在基質上,最終誘導血管生成。總體而言,這些數據表明高機械強度對于管結構的形成和血管生成特性并不是最佳的。同樣,這些數據表明,較軟的水凝膠濃度在較長時間內為細胞附著和活力提供了更好的支持。

圖5 水凝膠機械強度對血管生成的影響
結
語
應用中描述的數據為無異源水凝膠血管生成試劑盒 VitroGel Angiogenesis Assay Kits 作為HUVEC 細胞 2D 水凝膠包被和 3D 培養研究工具的實用性提供了證據。
這些數據表明,水凝膠中的生長因子(例如VEGF)會顯著影響血管的形成。同樣,水凝膠濃度本身對于生長,增殖和血管生成也很重要,因為具有較高機械強度的水凝膠導致血管生成大大減少,而較軟的水凝膠促進這種生長。
總之,水凝膠血管生成試劑盒 VitroGel Angiogenesis Assay Kits 可以精確地模擬體內內皮細胞微環境,血管生成的細胞-細胞間和細胞-環境間的相互作用。我們希望這些工具可以助力研究人員探索血管生成過程的更全面的機制,以及建立組織模型,用于藥物篩選、細胞侵襲和癌癥研究等應用。
參考文獻
1、Amann, A., Zwierzina, M., et al (2017) Development of a 3D angiogenesis model to study tumour – endothelial cell interactions and the effects of anti-angiogenic drugs. Scientific Reports, 7(1).
2、Jacobs, K. A., & Gavard, J., (2018) 3D Endothelial Cell Migration. Methods in Molecular Biology , 1749, 51–58.
3、Stepanova, D., Byrne, H. M.,et al. (2021). A multiscale model of complex endothelial cell dynamics in early angiogenesis. PLOS Computational Biology, 17(1), e1008055.
4、Rajendran, P., Rengarajan, T., Thangavel, J., et al. I. (2013). The Vascular Endothelium and Human Diseases. International Journal of Biological Sciences, 9(10), 1057–1069.
注:文中提及的所有的品牌,產品,商標和公司名稱都是屬于商標或注冊商標各自的擁有者。





