類器官的培養及在科研領域中的應用盤點
類器官并不是這兩年的才興起的研究熱點,早在2013年,《Science》雜志就將類器官評為“年度十大技術”,2017年類器官榮獲《Science methods》生命領域的“年度技術”,到了2019年,類器官甚至成功登上了《Science》雜志的封面。
作為前沿熱點技術之一,類器官不僅獲得了諸多學術界頂刊的推薦,還早已獲得我國的官方推薦。早在2018年,類器官模型就已經被國自然基金委列為項目指南的推薦技術。2021年國家科技部下發的《關于對“十四五”國家重點研發計劃6個重點專項2021年度項目申報指南征求意見的通知》中,也把“基于類器官的惡性腫瘤疾病模型”列為“十四五”國家重點研發計劃中首批啟動重點專項任務。
近幾年類器官在國自然項目申請中的數量也不斷攀升,從2021年的46個到2022年的67個。類器官相關研究也必將成為國自然申請中的大熱門,中標項目數量可能會繼續增長。2023年上半年,“Organoid”相關文章就有2194篇,遠超前幾年同期水平,意味著該領域的研究熱度還在升溫。

類器官相關文章數量趨勢(數據來源:PubMed)
類器官(organoid)是體外分化培養的3D細胞培養物,可以通過與對應器官的類似的空間組織重現對應器官的部分功能,從而提供一個高度生理相關系統。
3D細胞培養系統是類器官產生的基礎,它通過懸浮培養建立,使用支架或無支架技術以避免細胞與塑料盤的直接物理接觸。
➢支架是類似于天然ECM的生物凝膠或合成水凝膠,最常用的Matrigel,是由Engelbreth-Holm-Swarm(EHS)小鼠肉瘤細胞分泌的異質凝膠狀蛋白質混合物,它主要包含粘附蛋白,如膠原蛋白、巢蛋白、層粘連蛋白和硫酸肝素蛋白聚糖,類似于細胞外環境,能夠為細胞提供結構支持和ECM信號。
➢無支架技術則是細胞在重力和表面張力作用下懸掛在平板上的特定培養基液滴中培養的技術。此外,類器官的3D結構也可以通過“氣液界面”建立,在這種情況下,細胞在最初浸沒在培養基中的成纖維細胞或基質膠基底層上培養,培養基逐漸蒸發并將上層細胞層暴露在空氣中以允許極化和分化。
相較于傳統2D細胞培養或者昆蟲以及哺乳動物等模型,類器官模型在各方面都給予了更大的想象空間。
類器官的培養
類器官可來源于胚胎干細胞(ESC)、誘導多能干細胞(iPSC)、成體干細胞(ASC),或者腫瘤組織。
➢對于ESC/iPSC衍生的類器官,ESC/iPSC在各種細胞生長因子或小分子化合物(抑制劑/激活劑)以及基質膠和細胞培養添加劑的逐步分化方案下,能夠按照類似于原腸胚形成和器官發生過程中的發育線索,從三個胚層生成類器官。
➢對于ASC來源的類器官,ASC需要從胎兒或成人組織中產生;獲得單個ASC或含有ASC的組織單元之后,再通過3D培養方案形成類器官。
➢對于腫瘤組織來源的類器官,腫瘤組織內含有小部分具有干細胞活性的腫瘤細胞,通過將腫瘤來源的組織細胞或者分離出的腫瘤干細胞等進行3D培養,能夠衍生出腫瘤類器官(Tumoroids)。
類器官的應用
類器官作為一個新興的技術,在科學研究領域潛力巨大,包括發育生物學、疾病病理學、細胞生物學、再生機制、精準醫療以及藥物毒性和藥效試驗。

類器官的多種應用方向(PMID: 32459504)
類器官培養使研究人體發育提供了不受倫理限制的平臺,為藥物篩選提供了新的平臺,也是對現有2D培養方法和動物模型系統的高信息量的互補 。此外,類器官為獲取更接近自然人體發育細胞用于細胞治療成為可能。通過類器官繁殖的干細胞群取代受損或者患病的組織,類器官提供自體和同種異體細胞療法的可行性,未來這一技術在再生醫學領域也擁有巨大的潛力。使用這項技術,采用CRISPR/Cas9能夠糾正體外遺傳異常并能夠將健康的轉基因細胞再次回輸入患者體內,并在后期整合入組織內。
在精準醫學應用中,患者衍生的類器官也被證明為有價值的診斷工具。在進行治療之前,采用從患者樣本來源的類器官篩查患者體外藥物反應,旨在為癌癥和囊胞性纖維癥患者的護理提供指導并預測治療結果。隨著類器官培養系統以及其實驗開發技術的不斷發展,類器官應用到了各大研究領域。

1、通過類器官對發育和疾病進行建模
研究人員可以通過類器官來模擬人類發育和疾病,因為類器官是從人類干細胞或成年細胞產生的誘導性多能干細胞生長而來的,它們的成分和結構也與原發組織相似,并且易于操作和冷凍保存。這意味著類器官可以用于研究源自干細胞的人體組織且難以通過動物模型模擬的人類疾病分析,研究人員僅需少量的起始物質即可培養類器官。
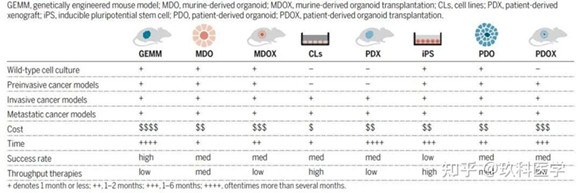
因其與對應的器官擁有類似的空間組織、保持一些關鍵特性并能夠重現部分生理功能,而被認為是檢測人類生物學和疾病方面的新模型。相較于細胞系(cell lines)、基因工程鼠(genetically engineered mouse models, GEMMs)和人源化異種移植鼠(patient-derived xenografts, PDX)這些傳統的研究模型,類器官模型(鼠源類器官mouse-derived organoids, MDO和人源類器官patient-derived organoids, PDO)不但能夠取自正常組織和組織癌變過程中各個階段的腫瘤組織,而且其培養體系簡單易操作,時間和金錢成本較低,且具有較高效率,因而得到廣大研究人員的親賴,被Nature Methods評為2017年生命科學領域年度技術。
2、干細胞類器官工程
干細胞生物工程技術的進步提高了控制細胞類型,組織和相互作用的能力,而類器官工程正需要通過直接修飾干細胞或控制微環境來操縱每個結構層。現在,科學家已經開發了更精確的合成環境,通過用信號蛋白修飾基質的生物惰性區域,可以更好地控制干細胞的活性。類器官工程技術對于一些體內環境成分復雜、需要精確建模的發育研究特別有用。
3、類器官與精準醫療
類器官技術正在成為個體化治療的工具,運用類器官技術進行個體化治療是指,通過體外對類器官進行藥物篩選和基因型分析,制定適合這個個體的治療藥物和方法。
截至到目前,不同腫瘤PDOs對傳統和正在研發的藥物所產生的反應是各種各樣的。對目前有限的資源研究發現,大部分PDOs所展現的治療反應和相對應的病人剛開始對治療的反應是一致的。PDOs也可以用于針對被動或獲得性耐受開發新的藥物。更重要的是,PDOs對具有細胞毒性的藥物敏感性較強,因而可以更好的預測病人使用后的臨床反應。接下來,研究人員對大量個體PDOs的藥物反應數據進行整合分析,找出共同特征,進而對一類相似病人進行生物標記物開發研究。
➢3.1藥物篩選
類器官培養物可用于藥物篩選,這可將腫瘤的遺傳背景與藥物反應相關聯。來自同一患者健康組織的類器官的建立提供了通過篩選選擇性殺死腫瘤細胞而又不損害健康細胞的化合物來開發毒性較小的藥物的機會。自我更新的肝細胞類器官培養物可用于測試潛在新藥的肝毒性(臨床試驗中藥物失敗的原因之一)。
3.1.1 類器官藥物篩選的優勢
速度快:類器官構建成功率高以及培養速度快。常規來說,在類器官培養一周之后就可以進行藥篩。從樣本采集到出具藥敏結果的全流程已經可以很好地控制在2周之內。
通量高:從可篩查的藥物通量來說,利用類器官不僅可以在孔板上進行多種藥物的篩查,每個藥物還可以測試不同的濃度,多個實驗平行開展。
臨床相關性強:類器官用于癌癥藥篩的臨床相關性和預測有效性在多篇研究中都已經得到了較為充分的證實。Vlachogiannis G團隊在Science發表了腫瘤類器官體外藥敏測試指導臨床用藥的里程碑式研究,在71位轉移性胃腸道癌提取了110份組織構建了類器官,共測試了55種抗癌藥物。研究結果顯示,類器官藥篩達到了93%的特異性,100%的靈敏度、88%的陽性預測率和100%的陰性預測率,展現了極高的臨床相關性。

3.1.2 類器官進行藥篩的流程
藥物篩選流程包括類器官的構建、評估、藥敏檢測三大方面:
類器官構建:類器官的樣本來源通常為腫瘤組織或者胸腹水等惡性積液,主流的培養方法包括較為常用的正置膠滴法、適用于腫瘤和睪丸類器官培養的倒置膠滴法、適用于有氣體接觸的黏膜類器官(腸、呼吸道)培養的氣液界面法以及需要較大擴增(腦類器官)的生物反應器法等。首先將患者來源的腫瘤樣本組織通過機械剪切得到腫瘤細胞團,再將細胞團酶消化成單細胞。分離消化后,將細胞嵌入到基質膠中并在96/384孔板上進行膠滴的種接,再覆蓋以培養基和細胞因子培養。類器官培養至直徑幾百微米的細胞小球即可用于藥篩。類器官培養特有的重要試劑包括消化液、培養基(例如Wnt、R-Spondin、Noggin等細胞因子)、基質膠(Matrigel等)。
評估:在培養好類器官之后,對于類器官的評估和驗證也至關重要。通過基因測序、免疫熒光、HE染色等方法,從形態學、組織病理學以及分子遺傳學等多個維度對類器官進行鑒定。評估的目的是確定類器官和原腫瘤具有一致性,這也是進行后續藥篩的前提。
藥物檢測:類器官目前可篩選的藥物種類包括化療藥、小分子靶向藥、抗體藥物等。藥篩的核心檢測檢測指標通常為IC50以及細胞抑制率,根據這些指標在篩查的藥物中選取對腫瘤抑制效果最佳的藥物。在中國的注冊臨床中,類器官以化療藥的敏感性檢測作為主流應用,類器官用于檢測靶向藥和免疫治療的敏感性在未來還有極大的發揮空間和應用潛力。
3.1.3 類器官藥篩的發展方向
類器官藥篩與二代測序作為組合產品使用,二者在臨床上可以有機結合,很好地相輔相成。二代測序從基因層面上檢測出患者的靶點突變情況和潛在的藥物敏感靶點,為醫生和患者提供初步用藥選擇,但是單憑二代測序結果無法保證完全的臨床療效。部分研究報道和臨床案例指出,二代測序篩出的潛在靶向藥并沒有在實際臨床上反應出有效性,這一部分的不確定性通過類器官可以很好排查。
➢3.2 基因型分析
來自不同健康器官的類器官的生長,然后對培養物進行全基因組測序,可以分析器官特異性突變譜。通過生長來自同一腫瘤不同區域的類器官,可以用于研究腫瘤內異質性。區域特異性突變譜可以通過類器官的全基因組測序來揭示。使用與上述相似的方法,可以利用類器官來研究特定化合物對健康細胞和腫瘤細胞突變譜的影響。
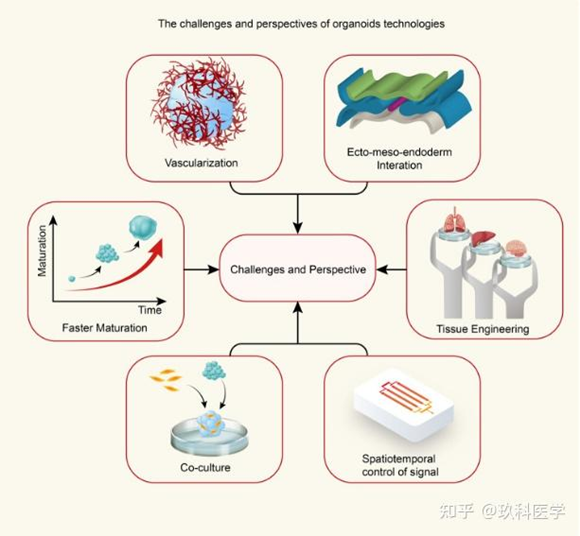
類器官的挑戰
類器官培養技術目前正處于技術爆發和科研成果井噴的階段,行業發展具有很大的前景,但也面臨較大的挑戰。比如如何利用好人體胚胎的干細胞建立持久穩定的體外模型;培養條件和環境刺激如何更真實的模擬還原人體微環境;科研屬性的產品如何實現量產,如何轉化為臨床產品等。
類器官作為新型的藥篩模型,成本雖然較PDX更低,但還是遠高于細胞系。類器官成本占比較高的包括培養使用的基質膠,常用的基質膠為美國BD Biosciences公司的Matrigel®,在行業內處于較為壟斷的地位,價格較高。Matrigel可以產生類似于哺乳動物細胞基底膜的生物活性基質材料,幫助多種類型的細胞達到附著和分化。Matrigel的來源是小鼠肉瘤細胞系,除了成本較高的問題,同時批次間存在一定的變異性。且由于是動物來源,對于有機類的藥物的檢測有局限性。考慮到小鼠來源的細胞外基質對于藥物篩選實驗結果存在一定的干擾,因此基質的工程技術開發用于合成外源差異較小的、非動物來源的基質膠用于成本下降和性能優化將是類器官產業化需要解決的關鍵性問題之一。基質膠以外,培養也涉及多種細胞因子組合使用,細胞生長因子通常也價格不菲。選擇效果更好的細胞因子以及嘗試減少使用細胞因子的數量也可以帶來成本下降的空間。
目前大多類器官本身并不具備血管化的結構。因此,隨著類器官體積的增長,類器官受限于氧氣的缺失以及代謝廢物的增加,可能導致的組織壞死。已有研究構建血管內皮細胞微環境的腫瘤類器官,將類器官腫瘤細胞和血管內皮細胞在Matrigel上共同培養,生成血管結構以期解決類器官血管化缺失的問題。
血管化以外的難點還包括模擬腫瘤和免疫環境的相互作用關系。2019年Nature Protocol發表了腫瘤類器官和免疫細胞共同培養的相關protocol,可以體現和模擬出腫瘤微環境的部分特征。以上皮類器官和免疫細胞共培養模型為例,可通過在培養基中添加活化的免疫細胞、在組織消化成單細胞后和免疫細胞共同生長、添加ECM中的重組細胞因子等方法重塑類器官和免疫細胞的相互作用。
相比于單個類器官,類器官系統的構建能夠對藥物療效和潛在毒性做出更完整全面的評估。目前類器官僅能檢測出藥物對于腫瘤的抑制效果,對于其他器官組織是否存在其他副作用和安全性風險并不能做出預判。為了解決這一問題,2017年Skardal et al.構建了有心臟、肺部、肝臟組成的集成于閉合循環關注體中的類器官系統,以達到全面揭示藥物對不同器官的毒性和藥效的目的。
重復性(reproducibility)和一致性(consistency)也是類器官發展的重大瓶頸,這很大程度上由于過程控制的欠缺與行業標準的空白。類器官培養過程中人為因素的過多參與、自動化程度低導致因為系統偶然性造成的誤差較大。同時,類器官檢測手段十分匱乏,活體觀察主要集中在形態學觀察,斷點觀察集中在基于熒光的各類指標的檢測,能夠活體實時對類器官各項指標進行檢測的光學、電化學等手段仍較為欠缺。當前,類器官很多研究者致力于制造更新的類器官,做出之前未能做出的類器官,我們可以制作海馬體、垂體、腺體、脾、腎的類器官,卻難以確定一個符合要求的類器官需要滿足那些個體的諸如尺寸、形狀、基因表達量等,群體的諸如類器官之間的方差等統計學指標。這將限制類器官的高效研究與向臨床研究的轉化。
對于類器官培養過程中的工程控制也是亟待解決的問題。當前類器官培養大多使用Matrigel水凝膠作為培養基質,Matrigel是康寧生命科學公司生產的Engelbreth-Holm-Swarm (EHS)小鼠肉瘤細胞分泌的膠狀蛋白混合物。Matrigel因其含有外源成分,難以應用在人的很多治療場景。另一方面,雖然類器官與微流控技術已有一些結合研究的例子,但使用微流控芯片對類器官生存的流體環境進行模擬仍不成熟,如何使用微流控等技術對類器官培養時流體微環境進行控制是亟待解決的問題。同時,現有類器官的直徑約在100-500μm之間,雖然具有一定程度的尺度效應,但還是難以模擬真實組織、器官的場景。倘若要制造尺度更大的類器官,類器官的血管化也是十分重要的問題。
總體而言,新興的類器官技術已經對生物醫學研究、個體化醫學中的藥物篩選以及與基因組編輯技術相結合的基因治療有用。類器官的廣泛應用尚處于探索的初期階段。廣泛的研究將使3D類器官系統能夠補充現有的模型系統,這將在未來加強基礎和臨床研究。





