用于細胞培養和細胞提取的可逆鍵合微流控裝置
與傳統的2D細胞培養相比,微流控芯片能夠支持細胞在3D中采用更多生理相關的形態,因此微流控芯片已成為細胞培養中的重要工具。目前,在制造過程中通常使用不可逆鍵合方法,即芯片不能在不破壞結構的情況下從其基板上分離,這使得很難對在芯片上培養的細胞進行進一步分析。盡管已經開發出一些可逆粘合技術,但它們要么僅限于某些材料,例如玻璃,要么需要復雜的加工程序。香港科技大學化學與生物工程系研發了一種簡單且可逆的聚二甲基硅氧烷 (PDMS)-聚苯乙烯(PS)鍵合技術,該技術允許器件在加壓時承受長時間操作,并支持長期穩定的細胞培養。更重要的是,它支持快速、溫和地提取活細胞,以便在長期芯片培養后進行下游操作和表征,甚至進一步傳代培養。該方法可以極大地促進基于微流控芯片的細胞和組織培養,克服當前的分析局限性,并為芯片上培養物的下游使用開辟新的途徑,包括用于生物醫學應用的3D工程組織結構。
微流控設備在細胞生物學領域得到了廣泛的應用。如使用微流控技術成功構建了3D腫瘤模型、細胞相互作用模型和器官芯片,以闡明生物學機制和促進藥物研發。傳統的聚二甲基硅氧烷(PDMS)芯片通常不可逆地粘合到基板上,因此除非器件被破壞,否則無法“打開”。這使得此類設備適用于長期細胞培養,但即使在胰蛋白酶的幫助下,也難以從設備中有效提取大量活細胞進行下游操作。因此,這一障礙限制了在微流控設備中分析細胞的方法,將它們限制在成像、批量分子分析或簡單的片上染色測定中。
在PDMS和基板之間實現可逆鍵合是解決這一限制的可能方法。雖然通過等離子體處理和化學改性(如1%APTES處理)可以很容易地實現器件的緊密不可逆粘合,但仍然很難開發穩定、長期的可逆粘合方法。現有的可逆粘合方法適用于有限范圍的器件-基板材料對,或者需要復雜的加工程序。例如,創建可逆鍵的最簡單方法是增加PDMS的厚度,并在不進行等離子處理的情況下粘接到玻璃上。但這種方法不太可靠,并且存在低壓耐受性,在加壓或長時間使用下泄漏的風險很高,這使得它不適合長期細胞培養或需要加壓泵送和控制的場景。最近,研究人員提出了一種基于玻璃的器件制造方法,以實現可逆鍵合和溫和的細胞提取。這種方法中的可逆鍵是通過兩個高清潔度的玻璃玻片之間的水脫水而產生的,因此需要中性清潔劑和持續施加外力來形成粘結。但是,該方法與PDMS設備不兼容。因此,對適用于常用器件基板材料的通用且簡單的可逆粘合方法的需求仍然存在。
創建可逆鍵的另一種常見方法是在器件內提供犧牲層,該犧牲層可以使用多種材料進行設計,例如聚甲基丙烯酸甲酯 (PMMA)、聚碳酸酯 (PC)、聚苯乙烯 (PS) 和聚對苯二甲酸乙二醇酯 (PET)。Thompson等人使用膠帶在復雜設備中建立可逆粘合,但低生產量和尚未確定的生物相容性限制了該方法的使用。類似地,有機硅基軟皮膚粘合劑可以與PDMS混合,在PDMS器件及其基材之間形成一個犧牲層,用于長期細胞培養。但這種粘合劑的低粘附特性可能會影響器件上的細胞附著,從而影響細胞生物力學或芯片功能。
香港科技大學化學與生物工程系的研究人員提出了一種制造可逆粘合微流控器件的新方法(為方便起見,以下稱為“可逆器件”;類似地,以下“不可逆器件”是指其基板無法手動從蓋板中分離的常規PDMS玻璃器件),這是通過用低濃度(≤0.5%)(3-氨丙基)三乙氧基硅烷(APTES)溶液處理熱塑性塑料(聚焦PS)來實現的。低濃度APTES溶液引入少量胺基團進行共價鍵合,并使PS表面粗糙,從而增強范德華力,總體上導致PS和PDMS之間穩定且可逆的鍵合(圖1)。除了臺式等離子清洗機外,該過程不需要其他設備,并且可以在潔凈室外進行,這使得大多數制造PDMS設備的實驗室都可以使用,并且與大多數基于PDMS的設備制造工作流程兼容。研究人員通過在具有高細胞活力的芯片上進行長期穩定的細胞培養,以及在芯片上顯示腫瘤球狀體形成作為附加應用,證明了這種類型的可逆鍵合器件的生物相容性。此外,通過芯片上的血管細胞培養和血管網絡形成實驗說明了這種表面處理的生物相容性。接下來,通過PDMS板的快速手工剝離從芯片中取出細胞,并通過細胞計數、細胞回收實驗和流式細胞術驗證了活細胞提取的高效性。最后,研究人員使用具有多個隔室的設備設計來共培養不同的細胞類型,展示了可逆鍵合設備兼容2D和3D細胞培養,這進一步擴展了這種鍵合方法的多功能性。這種可逆鍵合方法提供了一種強大且可擴展的芯片制造工藝,具有高度的生物相容性,并允許從微流控器件中溫和地提取細胞,有助于理解細胞行為及其背后的機制。
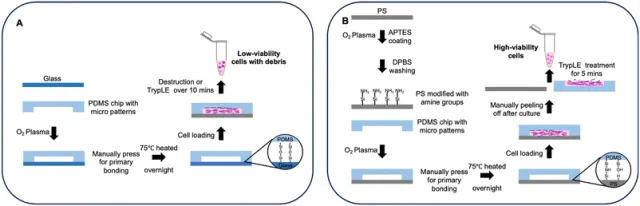
圖1.A.常規不可逆粘接裝置和細胞提取的工藝流程
B.可逆鍵合裝置和快速細胞提取的工藝流程
總體而言,這種用于微芯片的可逆鍵合方法是微流控技術的重要補充,可實現更廣泛的器官芯片研究。開發這種用于可逆鍵合制造和高效細胞提取的多功能和用戶友好型方法可能會對微流控的生物醫學應用產生重大影響,推動細胞培養和器官芯片的進一步發展以及藥物發現、疾病建模和細胞相互作用分析等后續研究。
參考文獻:
Feng X, Wu Z, Cheng LKW, et.al. Reversibly-bonded microfluidic devices for stable cell culture and rapid, gentle cell extraction. Lab Chip. 2024 Jul 1.
Kirkstall 智能3D細胞類器官培養系統設備功能用途
利用培養基循環流動,模擬血流,低剪切應力環境,結合3D培養構建細胞類器官體外模型,更貼近人體的體內環境。通過將流動引入體外環境,精準提高了您研究的生理相關性,為類器官研究提供了理想的工具,使您能夠生成更準確的模型,大大提高對結果有效性的信心。從而研究者能夠更高效、可靠地培養類器官,加速藥物研發和生物醫學研究的進程。廣泛應用于干細胞培養和分化,癌癥研究,藥物和毒性篩選及組織工程等領域。
全球使用Kirkstall Quasi Vivo® 3D細胞類器官培養系統的學術及研究機構已超過100+個,遍布美國、英國、法國、瑞典、奧地利、意大利、荷蘭、瑞士、日本等。目前Quasi Vivo智能3D細胞類器官培養系統被成功用于下列三維細胞類器官培養:
品牌制造商簡介
Kirkstall Ltd.成立于2006年,是Braveheart Investment Group plc的子公司,總部位于英國約克。Kirkstall開發了一種創新的3D細胞類器官培養微生理系統Quasi Vivo®。作為3D細胞類器官技術的領導者,Kirkstall已經建立了牛津大學生物醫學工程研究所等著名的大學實驗室的龐大用戶群,產品在全球范圍內享有盛譽。
微流控設備在細胞生物學領域得到了廣泛的應用。如使用微流控技術成功構建了3D腫瘤模型、細胞相互作用模型和器官芯片,以闡明生物學機制和促進藥物研發。傳統的聚二甲基硅氧烷(PDMS)芯片通常不可逆地粘合到基板上,因此除非器件被破壞,否則無法“打開”。這使得此類設備適用于長期細胞培養,但即使在胰蛋白酶的幫助下,也難以從設備中有效提取大量活細胞進行下游操作。因此,這一障礙限制了在微流控設備中分析細胞的方法,將它們限制在成像、批量分子分析或簡單的片上染色測定中。
在PDMS和基板之間實現可逆鍵合是解決這一限制的可能方法。雖然通過等離子體處理和化學改性(如1%APTES處理)可以很容易地實現器件的緊密不可逆粘合,但仍然很難開發穩定、長期的可逆粘合方法。現有的可逆粘合方法適用于有限范圍的器件-基板材料對,或者需要復雜的加工程序。例如,創建可逆鍵的最簡單方法是增加PDMS的厚度,并在不進行等離子處理的情況下粘接到玻璃上。但這種方法不太可靠,并且存在低壓耐受性,在加壓或長時間使用下泄漏的風險很高,這使得它不適合長期細胞培養或需要加壓泵送和控制的場景。最近,研究人員提出了一種基于玻璃的器件制造方法,以實現可逆鍵合和溫和的細胞提取。這種方法中的可逆鍵是通過兩個高清潔度的玻璃玻片之間的水脫水而產生的,因此需要中性清潔劑和持續施加外力來形成粘結。但是,該方法與PDMS設備不兼容。因此,對適用于常用器件基板材料的通用且簡單的可逆粘合方法的需求仍然存在。
創建可逆鍵的另一種常見方法是在器件內提供犧牲層,該犧牲層可以使用多種材料進行設計,例如聚甲基丙烯酸甲酯 (PMMA)、聚碳酸酯 (PC)、聚苯乙烯 (PS) 和聚對苯二甲酸乙二醇酯 (PET)。Thompson等人使用膠帶在復雜設備中建立可逆粘合,但低生產量和尚未確定的生物相容性限制了該方法的使用。類似地,有機硅基軟皮膚粘合劑可以與PDMS混合,在PDMS器件及其基材之間形成一個犧牲層,用于長期細胞培養。但這種粘合劑的低粘附特性可能會影響器件上的細胞附著,從而影響細胞生物力學或芯片功能。
香港科技大學化學與生物工程系的研究人員提出了一種制造可逆粘合微流控器件的新方法(為方便起見,以下稱為“可逆器件”;類似地,以下“不可逆器件”是指其基板無法手動從蓋板中分離的常規PDMS玻璃器件),這是通過用低濃度(≤0.5%)(3-氨丙基)三乙氧基硅烷(APTES)溶液處理熱塑性塑料(聚焦PS)來實現的。低濃度APTES溶液引入少量胺基團進行共價鍵合,并使PS表面粗糙,從而增強范德華力,總體上導致PS和PDMS之間穩定且可逆的鍵合(圖1)。除了臺式等離子清洗機外,該過程不需要其他設備,并且可以在潔凈室外進行,這使得大多數制造PDMS設備的實驗室都可以使用,并且與大多數基于PDMS的設備制造工作流程兼容。研究人員通過在具有高細胞活力的芯片上進行長期穩定的細胞培養,以及在芯片上顯示腫瘤球狀體形成作為附加應用,證明了這種類型的可逆鍵合器件的生物相容性。此外,通過芯片上的血管細胞培養和血管網絡形成實驗說明了這種表面處理的生物相容性。接下來,通過PDMS板的快速手工剝離從芯片中取出細胞,并通過細胞計數、細胞回收實驗和流式細胞術驗證了活細胞提取的高效性。最后,研究人員使用具有多個隔室的設備設計來共培養不同的細胞類型,展示了可逆鍵合設備兼容2D和3D細胞培養,這進一步擴展了這種鍵合方法的多功能性。這種可逆鍵合方法提供了一種強大且可擴展的芯片制造工藝,具有高度的生物相容性,并允許從微流控器件中溫和地提取細胞,有助于理解細胞行為及其背后的機制。

圖1.A.常規不可逆粘接裝置和細胞提取的工藝流程
B.可逆鍵合裝置和快速細胞提取的工藝流程
參考文獻:
Feng X, Wu Z, Cheng LKW, et.al. Reversibly-bonded microfluidic devices for stable cell culture and rapid, gentle cell extraction. Lab Chip. 2024 Jul 1.
Kirkstall 智能3D細胞類器官培養系統設備功能用途
利用培養基循環流動,模擬血流,低剪切應力環境,結合3D培養構建細胞類器官體外模型,更貼近人體的體內環境。通過將流動引入體外環境,精準提高了您研究的生理相關性,為類器官研究提供了理想的工具,使您能夠生成更準確的模型,大大提高對結果有效性的信心。從而研究者能夠更高效、可靠地培養類器官,加速藥物研發和生物醫學研究的進程。廣泛應用于干細胞培養和分化,癌癥研究,藥物和毒性篩選及組織工程等領域。
全球使用Kirkstall Quasi Vivo® 3D細胞類器官培養系統的學術及研究機構已超過100+個,遍布美國、英國、法國、瑞典、奧地利、意大利、荷蘭、瑞士、日本等。目前Quasi Vivo智能3D細胞類器官培養系統被成功用于下列三維細胞類器官培養:
品牌制造商簡介
Kirkstall Ltd.成立于2006年,是Braveheart Investment Group plc的子公司,總部位于英國約克。Kirkstall開發了一種創新的3D細胞類器官培養微生理系統Quasi Vivo®。作為3D細胞類器官技術的領導者,Kirkstall已經建立了牛津大學生物醫學工程研究所等著名的大學實驗室的龐大用戶群,產品在全球范圍內享有盛譽。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





