通過構建腫瘤分子分型新算法Themis實現腫瘤精準診療分子分型方法評估
01 研究背景
隨著分子生物學和基因組學等領域的不斷進步,精準醫學在癌癥領域的應用越來越重要。傳統的癌癥分類方法主要依賴于臨床和病理參數,其中包括一系列標準生物標志物。然而,這種傳統方法無法全面揭示腫瘤發展的復雜分子動態。目前腫瘤分子分型方法研究較多從基因組數據出發,轉向基于基因表達譜的分類方法。這種轉變使得我們不再僅僅依賴于組織學特征進行癌癥分類,而是更加注重腫瘤的分子特征和基因改變。在精準腫瘤學中,腫瘤分子分型的研究在臨床實踐中對患者的個性化管理中發揮著至關重要的作用。盡管在腫瘤分子分型方面取得了很多研究進展,但該領域仍面臨著重要挑戰,其中最重要的是缺乏對現有腫瘤分型方法的全面比較評估。此外,雖然各分型方法有其優勢,但尚未實現將這些不同方法整合起來以發揮它們的共同優勢。這個空白突顯了對當前分型技術進行臨床定量評估比較的緊迫性,需要開發出一個平臺,以比較不同方法在不同臨床場景下的優劣,并且進行優化整合這些他們的優勢。
02 研究思路
Themis利用了38個來源于癌癥基因組圖譜(TCGA)和已有研究的測試數據集(如GEO),并集成了多種現有研究的腫瘤分型方法,包括基于特征基因(如Stemness、Anoikis、Metabolism)、基于腫瘤微環境細胞組成特征和基于通路的分型方法。通過將已有分型方法應用于多個測試數據集并進行定量分析,Themis對每種方法的穩健性進行了嚴格評估。通過比較生存預后(總生存期(OS)、無進展生存期(PFS))、免疫浸潤分數(ESTIMATEScore、ImmuneScore和StromalScore)和治療預測(免疫檢查點阻斷,ICB)等指標,Themis能夠揭示不同分型方法的相對優勢和局限性。如圖1所示。
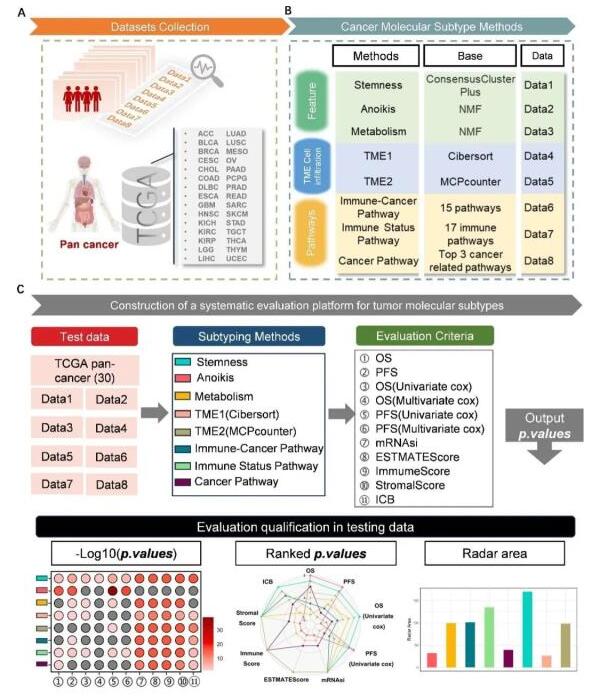
圖1. Themis流程
03 研究結果
1、綜合評價多種腫瘤分子分型方法:Themis框架
我們首先整合了8種已有研究的方法Stemness、Anoikis、Metabolism、TME1(Cibersort)、TME2(MCPcounter)和三種基于通路的分型方法Immune-Cancer Pathway、Immune Status Pathway和Cancer Pathway,分別通過使用不同的R包ConsensusClusterPlus、NMF、hclust進行聚類分析。隨后圍繞上述聚類的分型結果進行定量分析,以探索分子分型結果與各種臨床表型之間的相關性,包括總生存期(OS)、無進展生存期(PFS)、信使核糖核酸干細胞指數(mRNAsi)、免疫浸潤分數(ESTIMATEScore、ImmuneScore和StromalScore),以及TIDE算法預測的免疫治療反應(免疫檢查點阻斷,ICB)和pRRophentic R包預測的化療藥物反應。

圖2. 測試數據結果。(A)穩健性方面的表現(紅色)包括K-M分析(OS/PFS,對數秩檢驗)、單變量Cox分析(OS/PFS,Wald檢驗)、mRNAsi評分、免疫浸潤評分和TIDE免疫療法(ICB)的統計分析結果(ANOVA檢驗)。(B) 穩健性(紅色)方面的表現包括化療藥物的統計分析結果(ANOVA檢驗)。不同分類患者組的定量結果比較的p值為表的內容。對負對數轉換后的p值(-Log10(p.value))進行記錄,并使用氣泡圖對結果進行可視化。列出了每個數據集的相應色塊、每個定量方法的相應序號以及總體性能(彩色梯度)。對于所有彩色點,陰影越深表示性能越好,灰色點表示p>0.05,即結果在統計學上不顯著。如果為空白且沒有點,則意味著沒有相應的臨床信息可用于該數據集的定量計算。
2、Themis在精準腫瘤學研究中的應用
為評估已建立的分型方法的實用性,我們在TCGA的30種不同腫瘤類型的數據集上進行了系統應用。這項分析旨在辨別這些方法在各種癌癥中的適應性和相關性,重點關注分子異質性和臨床表型相關性。氣泡圖中總結的結果(圖3A)強調,適當分型方法的選擇在很大程度上取決于固有的腫瘤異質性和臨床表型的相關性(圖3)。
例如,在TCGA腎上腺皮質癌(ACC)數據集中,發現Stemness、Anoikis、Metabolism、TME2和Cancer Pathway等分型方法可以預測生存結果(①-⑥),其中大多數方法產生了具有統計學意義的預后定量結果。對于與腫瘤mRNAsi和微環境相關的評分(⑦-⑩),Stemness、Anoikis、Metabolism、TME2和Immune Status Pathway等分型方法顯示出與這些因素的顯著相關性。然而在TIDE免疫治療(⑪)結果方面,只有Anoikis和TME2提供了具有統計學意義的預測。對這些因素的綜合分析表明,ACC腫瘤樣本可能受益于使用Anoikis和TME2分型方法(圖3A)。這種綜合分析表明可以根據特定的臨床和分子標準,為不同的腫瘤類型量身定制分型方法。此外,我們舉例說明了如何使用雷達圖來比較ACC數據集上分型方法的性能。K-M分析(OS①/PFS②)表明Anoikis法在ACC中最具統計學意義。OS③和PFS⑤的單變量cox分析顯示,Cancer Pathway方法在ACC中顯著(圖3B)。這些分型方法的綜合性能,以包括所有評估維度的雷達圖面積為代表,將Stemness、Metabolism和TME2定位為ACC的主要方法(圖3C)。
3、Themis在個性化的分型方法設計中的應用
Themis可以進一步優化分型方法。例如,通過結合ACC、Stemness和Metabolism中表現最好的方法,我們設計了一種新的分型策略,稱為“Stemness-Metabolism”(圖3D)。隨后與其他方法比較分析顯示,“Stemness-Metabolism”方法在多個定量指標上都有顯著的增強(圖3E)。此外,通過計算雷達圖下的總面積,“Stemness-Metabolism”方法總體的分子分型效果超過了Stemness和Metabolisms方法(圖3F-3G)。我們方法的優化結果并非偶然,因為通過隨機組合的方法無法獲得優化的結果。當結合兩種性能較差的方法時,Anoikis和TME1(稱為Anoikis-TME1);以及性能良好的方法Stemness和性能較差的方法TME1(稱為Stemness-TME1),獲得了較差的結果(圖3E-3G)。這些結果證明了Themis在指導個性化治療方案的分型方法設計方面的潛力。
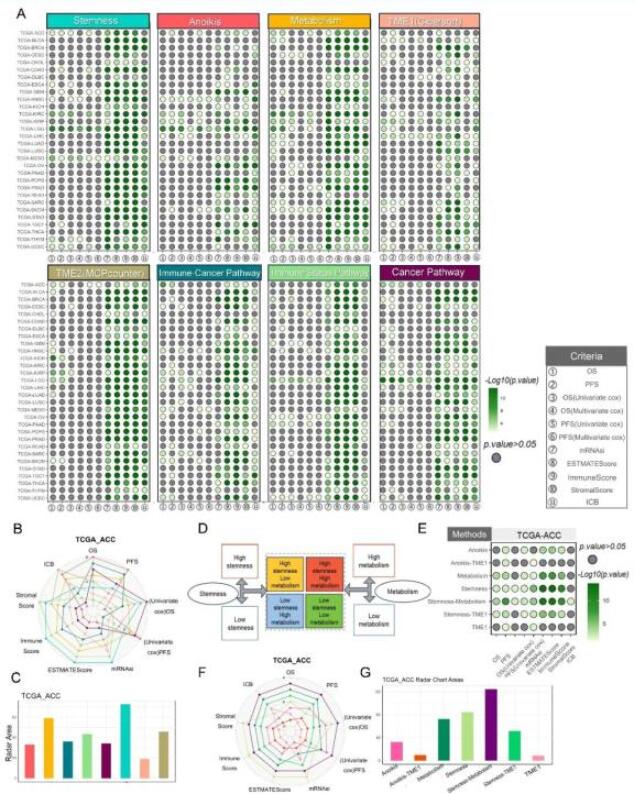
圖3. Themis用于泛腫瘤分子分型研究。(A)根據泛癌癥可用性(綠色)對其性能進行了可視化。對于所有彩色點,陰影越深表示性能越好,灰色點表示p>0.05。(B) 雷達圖顯示了使用所有方法可視化的ACC數據集與臨床表型相關的定量結果。(C)條形圖顯示了ACC數據集中方法定量結果的雷達繪圖區域的定量比較。(D)使用兩種分型方法(Stemness和Metabolism)的組合優化結果(將高干性和低干性與高代謝和低代謝特征相結合)。(E)氣泡圖顯示了“Stemness-Metabolism”方法與其他方法之間的性能比較分析。(F)雷達圖顯示了在相同數據(ACC)中使用這些不同的分型方法與臨床表型相關的定量結果。(G)條形圖顯示了ACC數據集中“Stemness-Metabolism”方法和其他方法的定量結果之間的雷達繪圖區域的定量比較。
Themis同樣可以應用于某種新的生物學特征相關的分子分型方法的評估(圖4)。使用Themis評估比較上皮-間充質轉化(EMT)相關特征的方法,我們可以系統地評估與該分型方法結果有關聯的臨床表型相關性,進而推斷出該特征相關方法在特定腫瘤類型或臨床場景下的作用。
基于不同分類算法的EMT(Consensus)和EMT(NMF)方法的結果顯示,二者在大多數癌癥類型中具有很高的一致性(圖4A)。將這兩種EMT相關的亞型分類方法與八種現有的分子亞型分類方法進行比較,雷達圖結果和雷達圖面積計算(圖4B)顯示,考慮到多個臨床相關的表型,如綜合生存預后、腫瘤免疫浸潤得分、干細胞狀態和免疫治療預測,EMT的亞型分類方法在ACC、BLCA、COAD、GBM、LGG、LUSC、OVCA、PRAD、STAD和UCEC中表現最佳(圖4B)。這意味著EMT可能在這些癌癥中發揮重要作用,并且對EMT相關進展的研究對于理解腫瘤的生物特性和預后可能非常重要。
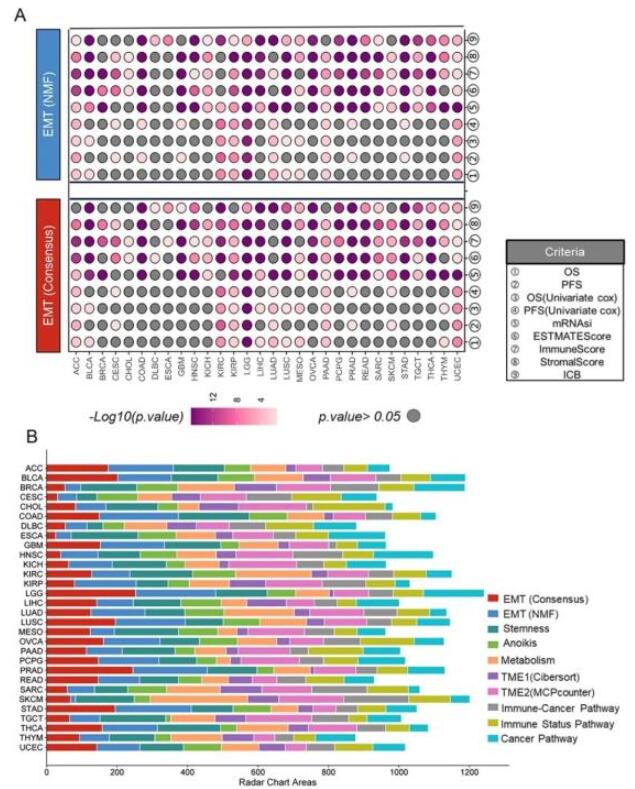
圖4. Themis比較了EMT特征在不同腫瘤的分子分型中的應用。
4、Themis指導個性化醫療策略
Themis能夠選擇適合特定數據集的最佳分型方法,并有助于對用戶的分子分型方法進行性能評估。我們使用Themis,將一項針對乳腺癌分型方法(Denise et al)研究與已有方法進行比較,以確定其是否適用于特定數據集。比較腫瘤分型在與患者藥物反應(patient drug responses,pCR)相關的分析中的應用,對不同患者亞型的治療效果進行量化分析。除了上述藥物反應指標外,還利用免疫浸潤評分和TIDE免疫療法預測作為定量指標。隨后,應用平臺現有的分型方法對Denise等人的研究數據進行分子分類。可視化了每種方法的定量結果的p值。
對于全部組藥物治療(All arm),所有方法的結果在統計學上都是顯著的(p <0.05,ANOVA檢驗)。三種最顯著p值的方法是Denise et al,Immune-Cancer Pathway和Stemness研究方法(圖5A)。雷達圖結果顯示了綜合表現最好的三種亞型方法分別是Denise et al,Immune-Cancer Pathway和Stemness(圖5B、5C)。此外,我們呈現了不同分型方法在每種藥物預測指標中的統計顯著性排名(圖5D)。研究結果體現了Denise等人的方法在全部組藥物(All arm)治療中的優勢,對于特定的AMG386藥物治療的患者分類策略,Immune-Cancer Pathway方法成為最合適的選擇,說明了用戶可以根據其個性化醫療策略的需求選擇患者的分子分型方法(圖5D)。
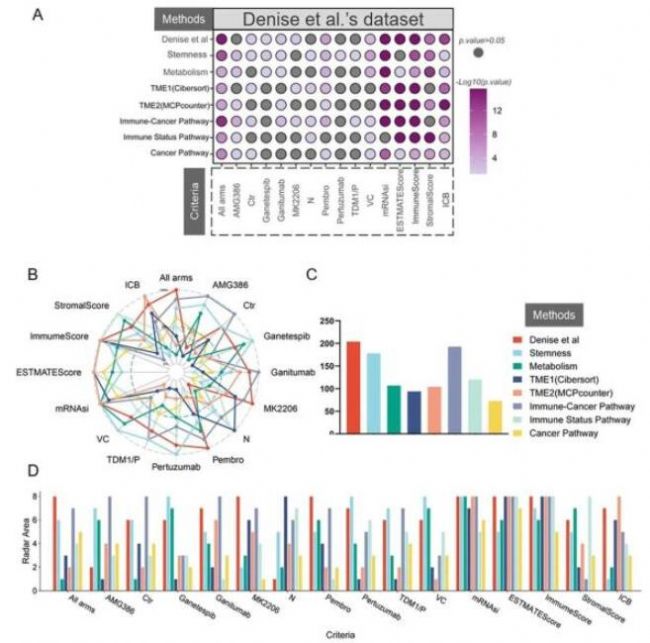
圖5. Denise et al方法的Themis應用示例數據。
奚悅為本文唯一第一作者,論文的通訊作者為復旦大學附屬中山醫院郝潔研究員,上海生物芯片鄒欣研究員,山東第一醫科大學附屬中心醫院張意茗主任。該研究得到了國家自然科學基金(82170045,31800253),上海交通大學醫學院高水平地方高校創新團隊 (SSMU-ZLCX20180502)的支持。





