白介素IL-10、IL-12、IL-17家族全面解讀及其在免疫反應中的應用
01
免疫"和事佬"IL-10 家族
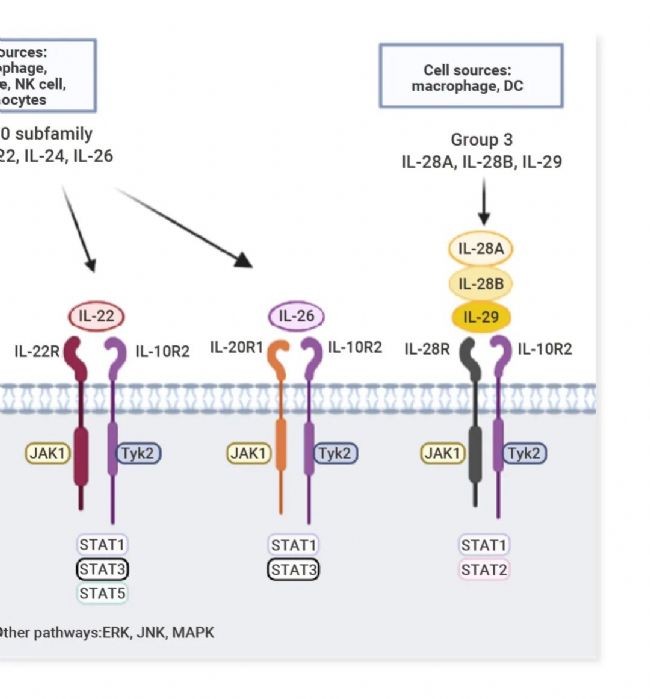
▐ 細胞因子成員:IL-10、IL-19、IL-20、IL-22、IL-24、IL-26、IL-28A (IFN-λ2)、IL-28B (IFN-λ3)、IL-29 (IFN-λ1)
▐ 特征:同屬一基因簇;蛋白質一級和二級結構相似, 所有成員都由六個 α 螺旋 (A–F) 及連接環構成,其中四個螺旋緊密排列形成經典的左旋四螺旋束;使用相似的受體復合物。
IL-10 家族細胞因子是免疫系統中不可或缺的效應與調節因子,具有限制過度炎癥反應,上調先天免疫和促進組織修復機制的作用,對抗感染、調控炎癥、維護組織穩態、影響自身免疫及癌癥進程至關重要。其信號傳導主要通過激活 Jak 激酶和 STAT 轉錄因子通路實現,家族成員多依賴 Jak1 和 Tyk2,激活下游關鍵轉錄因子 STAT3,介導靶基因的表達。特別地,IL-10 和 IL-22 還能在某些特定細胞中激活 STAT1 和 STAT5。根據功能 IL-10 家族進一步被細分為三個亞家族:IL-10 亞家族 (僅有 IL-10),IL-20 亞家族 (IL-19、IL-20、IL-22、IL-24、IL-26),遠親相關細胞因子 (即 III 型干擾素, IL-28A/IFN-λ2、IL-28B/IFN-λ3 和 IL-29/IFN-λ1)[1][2][3]。
| 因子 | 炎癥相關 |
| IL-10 | 抗炎 |
| IL-19 | 抗炎 |
| IL-20 | 主抗炎,某些疾病如腫瘤中促炎 |
| IL-22 | 抗炎/促炎雙重作用 |
| IL-24 | 抗炎/促炎雙重作用 |
| IL-26 | 促炎 |
| IL-28A (IFN-λ2) | 促炎 |
| IL-28B (IFN-λ3) | 促炎 |
| IL-29 (IFN-λ1) | 促炎 |
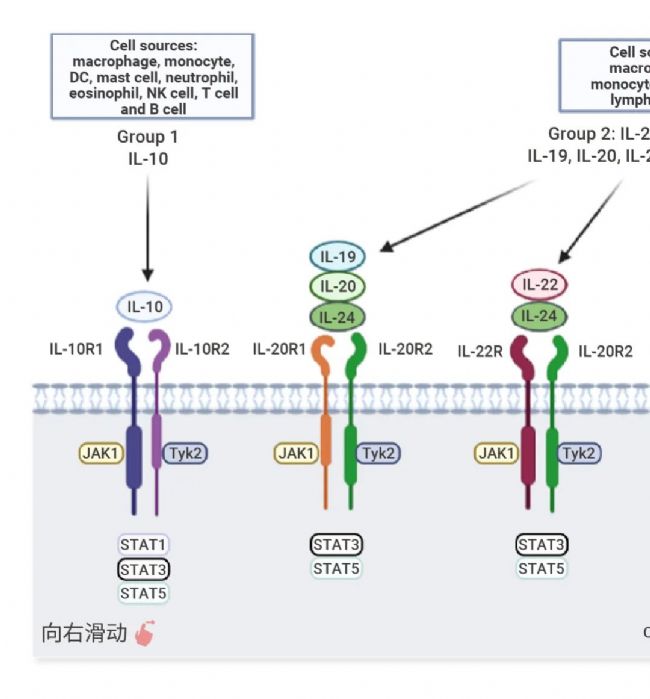
免疫系統的"和平使者" IL-10
IL-10 由多種免疫細胞合成,主要包括 CD4+ Th1、Th2、Th17 細胞、Treg 細胞、DC 細胞、單核細胞、巨噬細胞,另外,小膠質細胞和心臟巨噬細胞也能產生 IL-10。IL-10 同二聚體與 IL-10RA 結合,誘導受體二聚化,進而 IL-10R2 與 IL-10-IL-10R1 復合物結合,導致 Jak1 和 Tyk2 磷酸化,繼而觸發 STAT3 的磷酸化并激活、二聚化并入核,調控目標基因的表達[5]。IL-10 被認為是典型的免疫抑制細胞因子,作為免疫系統的“和平使者”,具有強效抗炎特性,有效遏制過度免疫反應,同時參與傷口愈合、自身免疫調控和體內穩態[6]。由于 IL-10 強大的抗炎和免疫調節特性,其臨床應用前景廣闊,在類風濕性關節炎、炎癥性腸病、腫瘤免疫治療和慢性病毒感染等領域都有臨床試驗,盡管面臨系統給藥副作用及耐受性等挑戰,但 IL-10 的醫學潛力仍值得深入探索與挖掘[7]。
02
"成雙成對"的 IL-12 家族
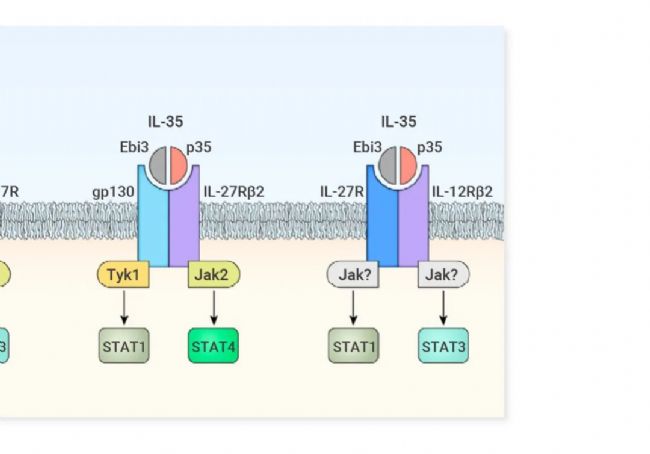
▐ 細胞因子成員: IL-12、IL-23、IL-27、IL-35、IL-39
▐ 特征:均由異二聚體構成,具體為 α 亞基 (p19、p28、p35) 和 β 亞基 (p40、Ebi3) 的不同組合:構成 IL-12 (p35/p40)、IL-23 (p19/p40)、IL-27 (p28/Ebi3)、IL-35 (p35/Ebi3)、IL-39 (p19/Ebi3)。α 亞基具有 IL-6 超家族的四螺旋束結構特征,β 亞基與 1 型細胞因子受體胞外區結構相關。
盡管這些細胞因子都通過 JAK-STAT 信號通路發揮功能,但它們在生物學活性上卻大相徑庭。IL-12 與 IL-23 主要作為促炎/促刺激細胞因子,強化炎癥信號,對免疫平衡及炎癥反應至關重要。而 IL-27 兼具促炎和抗炎雙重特性,促進 Th1 分化同時抑制 Th17 細胞發育,由于 IL-27 通過結合 gp130 受體發揮作用,也時常被歸類為 IL-6 家族。IL-35 主要由調節性 T 細胞分泌,具有抗炎作用[8]。2016 年 Wang 等人首次報道了 IL-39,并在后續研究中證明了脂多糖 (LPS) 激活的 B 細胞能分泌天然形式的 IL-39[9]。基于 IL-12 家族亞基不同組合,科研界還假設并合成了 IL-Y (p40/p28),用于探索自身免疫性疾病[10][11]。
| 因子 | 炎癥相關 |
| IL-12 | 促炎 |
| IL-23 | 促炎 |
| IL-27 | 促炎/抗炎 |
| IL-35 | 抗炎 |
| IL-39 | 促炎 |
家族"雙星"IL-12 和 IL-23
IL-12 作為重要促炎細胞因子,主要由抗原提呈細胞 (如樹突狀細胞和巨噬細胞) 分泌,亦見于其他造血細胞類型[8]。它能促進 Th1 細胞分化,增加 IFN-γ 產生,從而增強細胞介導的免疫反應。靶向 IL-12 在抗腫瘤領域展現出巨大潛力,曾一度被廣泛認為是腫瘤治療的有效突破口,但因其脫靶毒性和給藥效率問題,其臨床轉化受到局限。2023 年以來,多家 MNC 舍棄 IL-12 管線,但也有部分企業不懈地尋求解決毒性和半衰期問題的辦法。近期,部分科研人員將目光轉向脂質納米顆粒 (LNP)/外泌體高效遞送,這些局部給藥途徑成為探索熱門方向[12][13][14][15][16]。

IL-23 與 IL-12 同屬促炎細胞因子,也是由活化的樹突狀細胞和巨噬細胞在響應微生物病原體時產生的。二者差異在于,IL-23 通過誘導 IL-17 表達和 Th17 表型的擴增/穩定,在 Th17 發育中發揮關鍵作用,但不直接觸發 Th17 細胞的分化[8]。在多種臨床前癌癥模型中,IL-23 表現出促進腫瘤生長特性,并導致癌癥患者的不良預后,使針對 IL-23 的免疫治療策略具有巨大潛力[16][17]。
IL-12 和 IL-23 共同亞基 p40 及其受體 IL-12Rβ1 亞基, 且 IL-23 主要在真皮細胞表達,銀屑病中 p40 的免疫反應性增加,支持 p40 亞基作為治療靶點。已有多款靶向 p40 的單克隆抗體,如烏司奴單抗 (Ustekinumab) 和布雷奴單抗 (Briakinumab) 獲 FDA 批準用于中度至重度斑塊型銀屑病治療。而針對 IL-23 特異性 p19 亞基的抗體,如瑞莎珠單抗 (Risankizumab)、古塞庫單抗 (Guselkumab) 獲 FDA 批準用于中度至重度斑塊型銀屑病和銀屑病關節炎治療,布雷庫單抗 (Brazikumab) 和米吉珠單抗 (Mirikizumab) 目前處于臨床研究階段。此外,烏司奴單抗還被批準用于治療銀屑病關節炎和克羅恩病,展現了靶向 IL-12/IL-23 路徑治療的廣泛前景[18][19][20]。
03
抗感染/促炎"先鋒隊" IL-17 家族
▐ 細胞因子成員: IL-17A、IL-17B、IL-17C、IL-17D、IL-17E (IL-25)、IL-17F
▐ 特征:均包含四個高度保守的半胱氨酸殘基。所有成員以同二聚體或異二聚體 (IL-17A/F) 形式存在,通過結合具有同源序列的五種受體 (IL-17RA/RB/RC/RD/RE) 二聚體發揮功能。
IL-17 家族成員由多種細胞類型產生,包括 Th17 輔助 T 細胞、巨噬細胞、樹突狀細胞、NK 細胞、先天淋巴樣細胞及上皮細胞。它們通過結合相應受體激活下游信號通路,如 NF-κB、MAPK 和 C/EBP,誘導抗菌肽、細胞因子和趨化因子的表達[21]。IL-17RA 作為多種 IL-17 配體共用受體,在多種組織和細胞中廣泛表達,賦予 IL-17 家族細胞因子多效性。該家族因子主要具有促炎作用,對宿主防御微生物感染及炎癥疾病的發展具有至關重要的作用[21][22][23][24]。
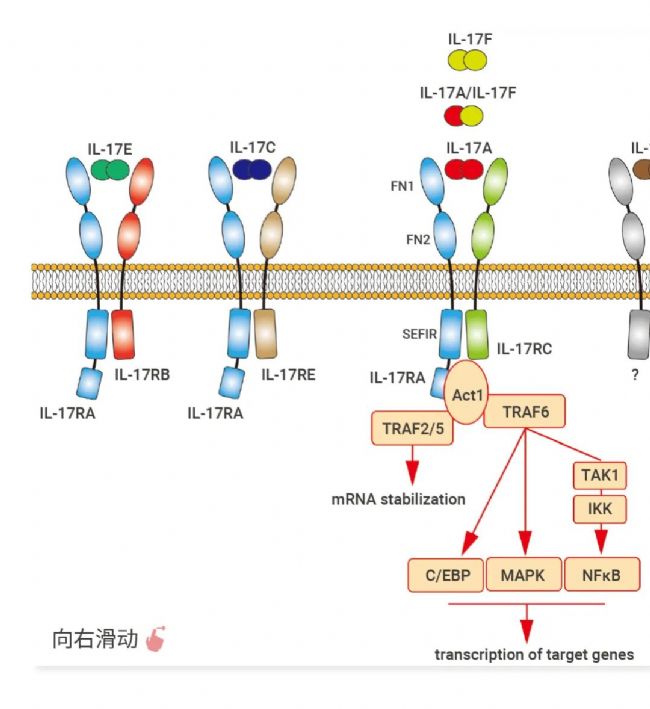
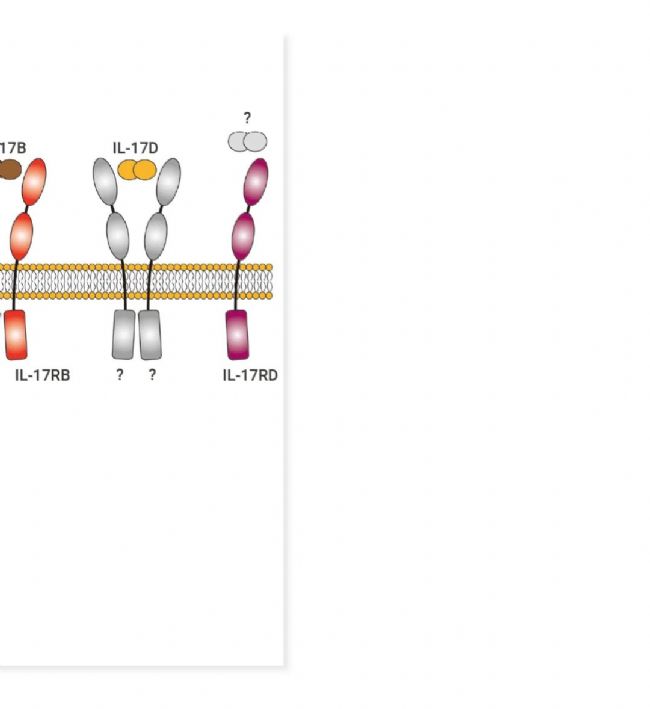
自免領域明星靶點 IL-17
IL-17A 作為家族中研究最深入的成員,已被確認為銀屑病的關鍵致病因子。IL-17A、 IL-17F 同二聚體和 IL-17A/F 異二聚體與 IL-17RA/RC 受體復合物結合,但結合能力各異:IL-17A/A > IL-17A/F > IL-17F/F。IL-17RA 還作為其他家族成員的輔助受體,凸顯其在信號通路中的核心作用[23][26]。IL-17 抑制劑,如伊西貝單抗 (Ixekizumab)、司庫奇尤單抗 (Secukinumab) 和 AMG 827 (Brodalumab),已有效應用于銀屑病、銀屑病關節炎 (PsA)、強直性脊柱炎 (AS) 和類風濕性關節炎 (RA) 的生物治療。今年 7 月,國內首款 IL-17A/IL-17F 單抗——比奇珠單抗 (Bimekizumab) 成功上市,并已在多國獲準用于治療中重度斑塊型銀屑病。
相關細胞因子
04
小結
好啦~上期小 M 為大家介紹了 IL-1、IL-2、IL-6 家族,本期與大家探討的是同樣值得關注的 IL-10、IL-12、IL-17 家族,有需要的小伙伴關注收藏,不要錯過喔~
鉅惠活動進行時!
現 MCE 全線重組蛋白 65 折!清單 2600+ 個重組蛋白,可享半價優惠!涵蓋多種生長因子、白介素、趨化因子、激素、酶類、受體蛋白、腫瘤免疫/細胞治療相關靶點,以及無動物源成分細胞因子和 GMP 級蛋白~

戳一戳:獲取 MCE 細胞因子海報~.pdf
參考文獻:
[1] Ouyang W, O’Garra A. IL-10 family cytokines IL-10 and IL-22: from basic science to clinical translation. Immunity. 2019 Apr 16;50(4):871-91.
[2] Sabat R. IL-10 family of cytokines. Cytokine & growth factor reviews. 2010 Oct 1;21(5):315-24.
[3] Burmeister AR, Marriott I. The interleukin-10 family of cytokines and their role in the CNS. Frontiers in cellular neuroscience. 2018 Nov 27;12:458.
[4] Xuan L, Zhang N, Wang X, Zhang L, Bachert C. IL-10 family cytokines in chronic rhinosinusitis with nasal polyps: From experiments to the clinic. Frontiers in Immunology. 2022 Aug 8;13:947983.
[5] Carlini V, Noonan DM, Abdalalem E, Goletti D, et al. The multifaceted nature of IL-10: regulation, role in immunological homeostasis and its relevance to cancer, COVID-19 and post-COVID conditions. Frontiers in immunology. 2023 Jun 8;14:1161067.
[6] Iyer SS, Cheng G. Role of interleukin 10 transcriptional regulation in inflammation and autoimmune disease. Critical Reviews™ in Immunology. 2012;32(1).
[7] Wang X, Wong K, Ouyang W, Rutz S. Targeting IL-10 family cytokines for the treatment of human diseases. Cold Spring Harbor perspectives in biology. 2019 Feb 1;11(2):a028548.
[8] Vignali DA, Kuchroo VK. IL-12 family cytokines: immunological playmakers. Nature immunology. 2012 Aug;13(8):722-8.
[9] Lu Z, Xu K, Wang X, Li Y, Li M. Interleukin 39: a new member of interleukin 12 family. Central European Journal of Immunology. 2020 Apr 1;45(2):214-7.
[10] Flores RR, Kim E, Zhou L, Yang C, et al. IL‐Y, a synthetic member of the IL‐12 cytokine family, suppresses the development of type 1 diabetes in NOD mice. European journal of immunology. 2015 Nov;45(11):3114-25.
[11] Sun L, He C, Nair L, Yeung J, Egwuagu CE. Interleukin 12 (IL-12) family cytokines: Role in immune pathogenesis and treatment of CNS autoimmune disease. Cytokine. 2015 Oct 1;75(2):249-55.
[12] Liu M, Hu S, Yan N, Popowski KD, Cheng K. Inhalable extracellular vesicle delivery of IL-12 mRNA to treat lung cancer and promote systemic immunity. Nature Nanotechnology. 2024 Apr;19(4):565-75.
[13] Xu Y, Sun X, Tong Y. Interleukin-12 in multimodal tumor therapies for induction of anti-tumor immunity. Discover Oncology. 2024 May 16;15(1):170.
[14] Minnar CM, Lui G, Gulley JL, Schlom J, Gameiro SR. Preclinical and clinical studies of a tumor targeting IL-12 immunocytokine. Frontiers in Oncology. 2024 Jan 8;13:1321318.
[15] Hamza T, Barnett JB, Li B. Interleukin 12 a key immunoregulatory cytokine in infection applications. International journal of molecular sciences. 2010 Mar;11(3):789-806.
[16] Nguyen KG, Vrabel MR, Mantooth SM, Hopkins JJ, Wagner ES, Gabaldon TA, Zaharoff DA. Localized interleukin-12 for cancer immunotherapy. Front Immunol. 2020; 11: 575597.
[17] Mirlekar B, Pylayeva-Gupta Y. IL-12 family cytokines in cancer and immunotherapy. Cancers. 2021 Jan 6;13(2):167.
[18] Verstockt B, Salas A, Sands BE, Abraham C, Leibovitzh H, Neurath MF, Vande Casteele N. IL-12 and IL-23 pathway inhibition in inflammatory bowel disease. Nature Reviews Gastroenterology & Hepatology. 2023 Jul;20(7):433-46.
[19] Yang K, Oak AS, Elewski BE. Use of IL-23 inhibitors for the treatment of plaque psoriasis and psoriatic arthritis: a comprehensive review. American journal of clinical dermatology. 2021 Mar;22:173-92.
[20] Teng MW, Bowman EP, McElwee JJ, Smyth MJ, Casanova JL, Cooper AM, Cua DJ. IL-12 and IL-23 cytokines: from discovery to targeted therapies for immune-mediated inflammatory diseases. Nature medicine. 2015 Jul;21(7):719-29.
[21] Gu C, Wu L, Li X. IL-17 family: cytokines, receptors and signaling. Cytokine. 2013 Nov 1;64(2):477-85.
[22] Song X, He X, Li X, Qian Y. The roles and functional mechanisms of interleukin-17 family cytokines in mucosal immunity. Cellular & molecular immunology. 2016 Jul;13(4):418-31.
[23] Huangfu L, Li R, Huang Y, Wang S. The IL-17 family in diseases: from bench to bedside. Signal Transduction and Targeted Therapy. 2023 Oct 11;8(1):402.
[24] Liu S, Song X, Chrunyk BA, Shanker S, Hoth LR, Marr ES, Griffor MC. Crystal structures of interleukin 17A and its complex with IL-17 receptor A. Nature communications. 2013 May 21;4(1):1888.
[25] Liu S, Song X, Chrunyk BA, Shanker S, et al. Crystal structures of interleukin 17A and its complex with IL-17 receptor A. Nature communications. 2013 May 21;4(1):1888.
[26] Brembilla NC, Senra L, Boehncke WH. The IL-17 family of cytokines in psoriasis: IL-17A and beyond. Frontiers in immunology. 2018 Aug 2;9:1682.





