放射性核素RDC在腫瘤診斷與治療中應用和發展前景
01
加配“導航”的核藥—RDC
放射性核素?嗯......一個聽起來略帶恐慌的詞匯。其實吧,放射性核素偶聯藥物 (Radionuclide-drug conjugates,RDCs) 是目前核藥最具潛力的發展方向之一,它們可以將目標劑量的輻射直接輸送到腫瘤及其轉移病灶,從而使正常的健康組織免受傷害。
隨著 FDA 批準 Lutathera (177Lu-dotatate) 和 Pluvicto (177Lu-PSMA-617) 的上市,放射性核素偶聯藥物 (RDCs) 因療效顯著而銷售火爆,在全球掀起了 RDC 研究熱潮,開啟放射性核素藥物用于腫瘤精準診療的新時代。
RDC 的組成結構
經典的 RDC 由靶向載體 (Targeted carrier)、連接子 (Linker)、螯合劑 (Chelator) 與放射性核素 (Radionuclide) 偶聯而成 (圖 1)。靶向載體識別腫瘤細胞后將攜帶的核素運輸到靶細胞的位置,釋放輻射以起到成像或治療的目的[1]。
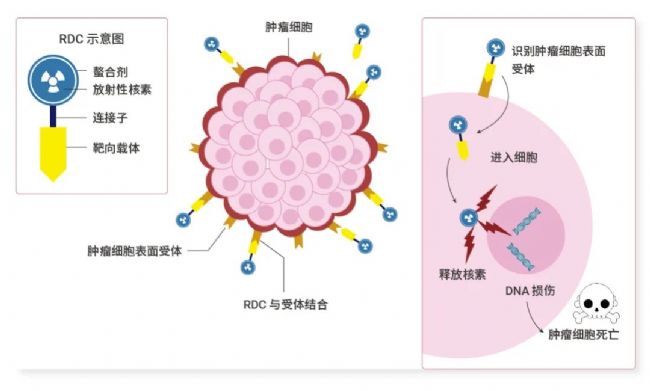
圖 1. RDC 的結構與靶向放射性治療的作用機制。
- ADC 依賴于細胞內吞,RDC 可不進入細胞,利用衰變時產生的射線殺死目標細胞。
- 具有更好的抗耐藥性,RDC 通過輻射方式殺傷癌細胞,在輻射半徑內,腫瘤細胞即使沒有相應抗原,也能通過作用于腫瘤基質細胞,通過損傷或殺死基質細胞,進而切斷基質細胞向腫瘤細胞提供營養支撐,起到間接治療作用。
RDC 在前期診斷、治療及術后腫瘤評估等方面具有優勢,相同的配體可以分別連接用于疾病診斷和治療的核素,促成 RDC 藥物的診療一體化。
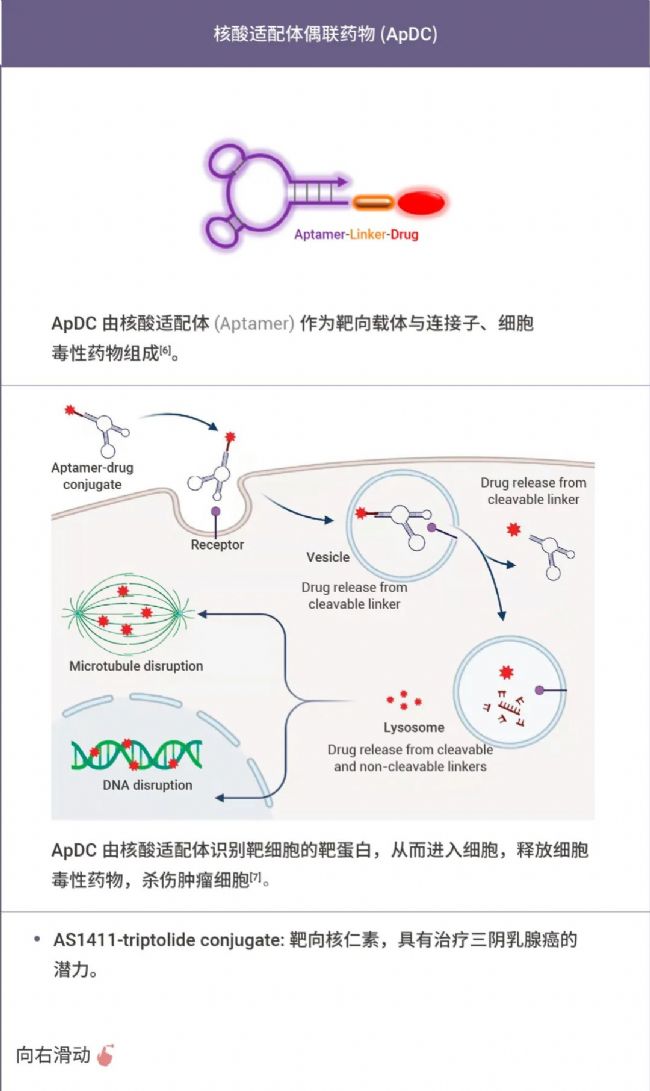
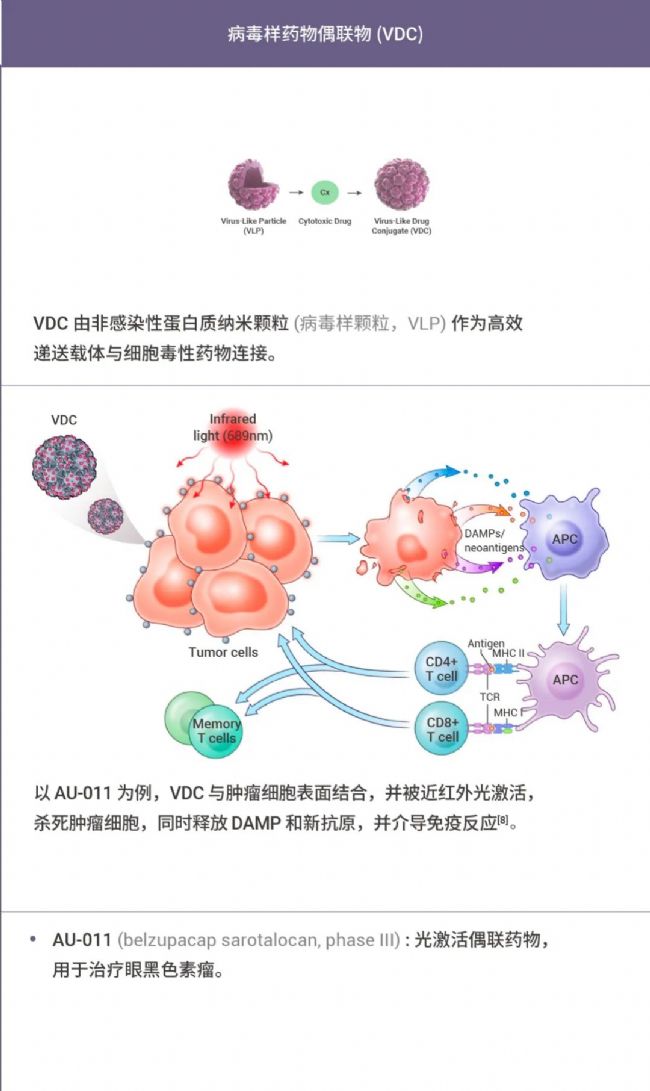
此外,RDC 也是藥物明星家族 XDC 的重要一員。對對對~沒錯! 就是那個基于 ADC 藥物催生 "萬物皆可偶聯",衍生出的 XDC!
XDC 是各種偶聯藥物的統稱,即借助靶向載體將治療介質選擇性地遞送到疾病灶點處發揮治療效果。感興趣的同學也可以和小 M 一起簡單了解下 XDC 家族其他成員~
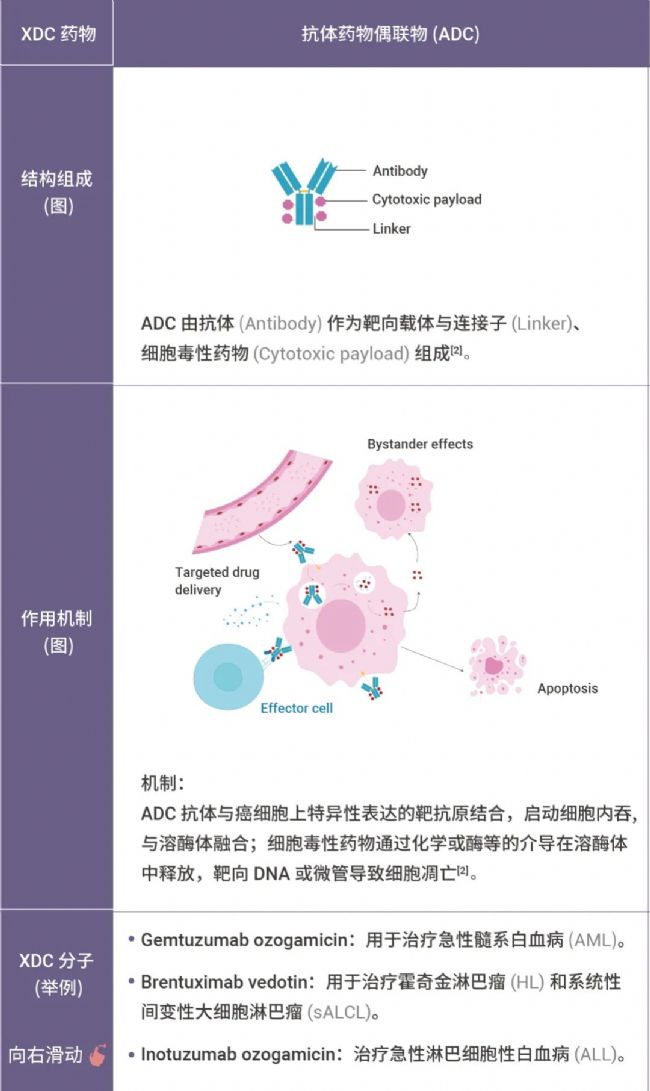
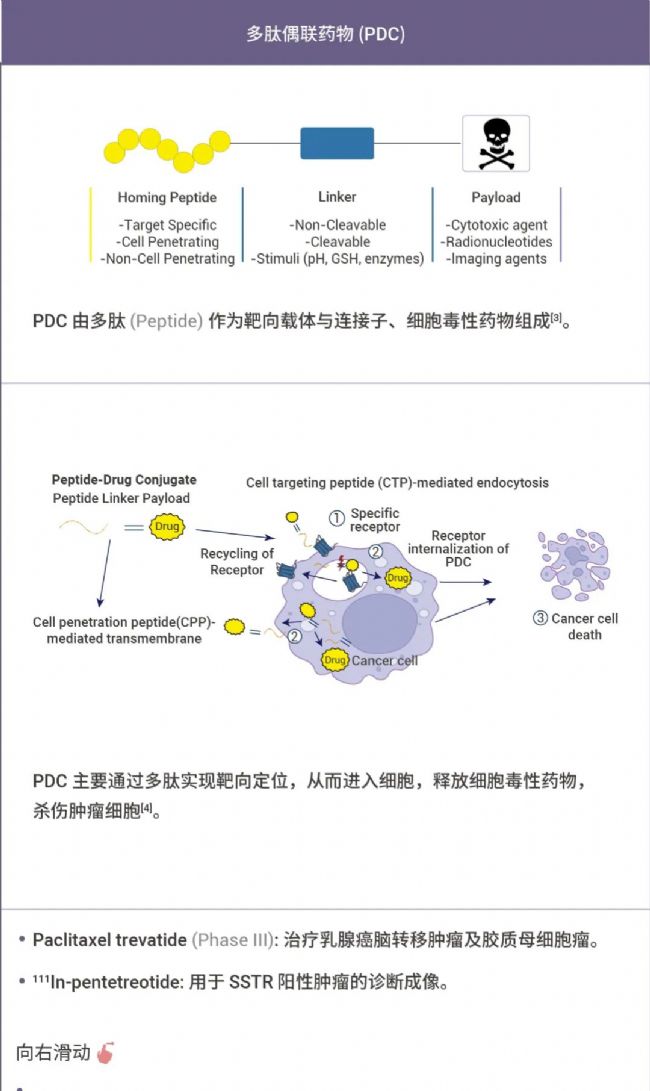
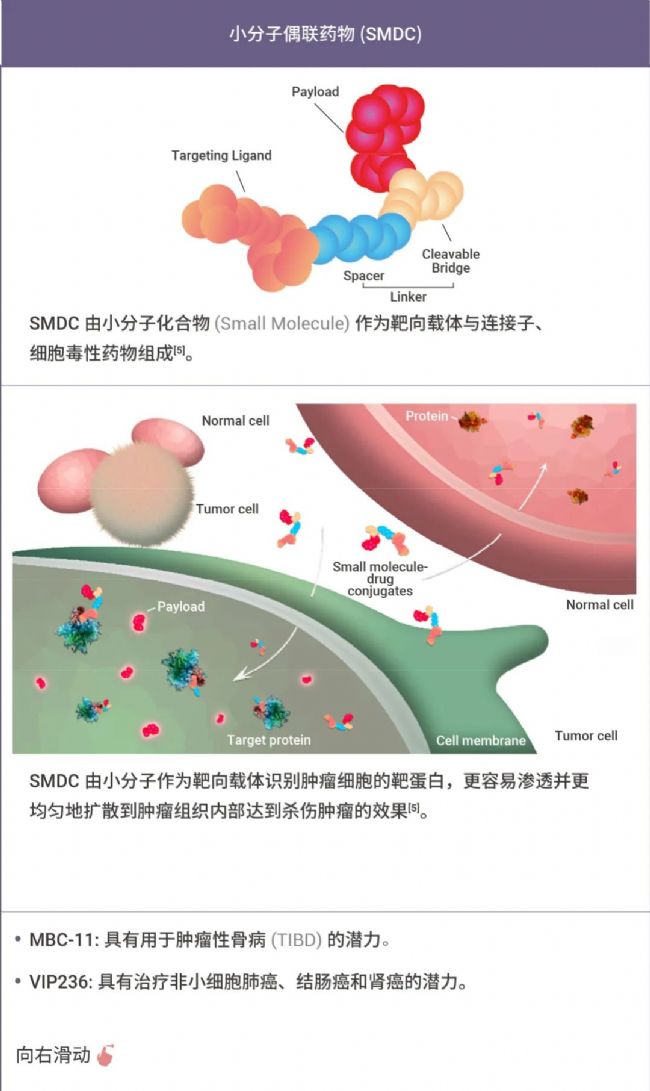
表 1. 部分 XDC 偶聯藥物[2-8]
02
“拆解”RDC
放射性核素
與其他偶聯藥物的最大不同是,RDC 選用放射性核素作為細胞殺傷毒素。
核素是指具有一定核電荷數和質量數,并且具有同一能態的原子核或原子。
放射性核素,又稱作放射性同位素。同位素由于質子數相同而中子數不同,導致彼此具有不同的結構方式,從而表現出不同的核性質。相對于穩定核素,放射性核素的原子核不穩定,經衰變能自發地放出 α 射線、β 射線等輻射。放射性核素藥物可通過釋放不同類型的射線對腫瘤部位進行顯像或直接殺傷[9]。
目前主要有診斷型核素藥物和于治療型核素藥物。
核素藥物: 診斷型 VS 治療型?
- 對于診斷型核素藥物,根據腫瘤的發生、發展階段選擇諸如化療、靶向藥物、抗體藥物、細胞治療等多種不同的方式對其進行殺傷清除后,可以通過核醫學顯像診斷對腫瘤細胞進行定位追蹤與治療效果評價[9]。
- 對于治療型核素藥物,不僅可以利用核素釋放出的高能射線對腫瘤細胞進行輻射治療,即傳統的放射療法,還可通過放射性核素偶聯藥物 (RDC),即將核素通過連接子 (Linker) 與載體 (Ligand),如單抗、多肽或小分子等偶聯在一起,利用載體的靶向作用將核素精準遞送到腫瘤內部,在對腫瘤進行高劑量殺傷的同時降低對正常組織的輻射,從而減少副作用。也可將治療型核素換成診斷型核素,從而實現其診斷功能,用于腫瘤的掃描、成像和診斷[9]。
常用于放射性核素治療的有 α、β 粒子與 Auger 電子。根據核素的輻射能量、輻射距離與半衰期的不同可以選擇不同類型的治療型核素用于不同腫瘤的治療[9]。

靶向載體
載體主要負責識別靶點,將放射性核素遞送至靶細胞或者靶器官,提高靶點處放射性核素的作用濃度,從而能精準定位并殺死靶細胞。腫瘤細胞會表達一種或多種在正常組織或其他疾病中不表達或低表達的蛋白,通過識別這些蛋白,RDC能精準定位腫瘤細胞,實現靶向治療,減少對健康組織的損害。
理想的載體一般要求高選擇性、無毒、易于生產與修飾。常用的靶向載體包含抗體、多肽、核酸、小分子、納米顆粒等 (圖 2)。抗體是最早被開發的 RDC 載體,自 90Y-ibritumomab tiuxetan 和 131I-tositumomab 分別于 2002 年與 2003 年分別被 FDA 批準用于非霍奇金淋巴瘤,大量研究評估了放射性標記抗體在腫瘤中的療效。相對抗體,多肽穩定性更高、也更易于在實體瘤內擴散,177Lu-DOTATATE 與 177Lu-PSMA-617 先后被批準用于臨床。近年來,核酸與小分子也被積極探索作為放射性藥物的載體[11]。
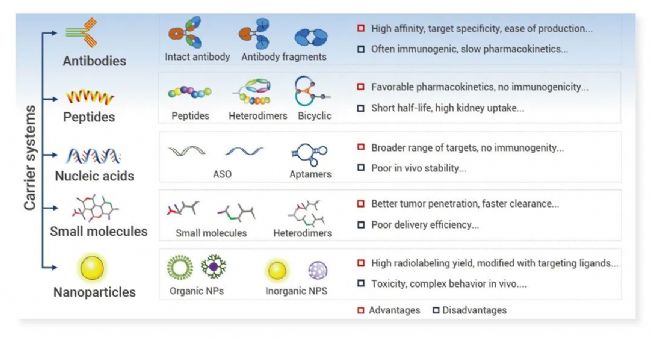
圖 2. 主要的 RDC 靶向載體與其優劣勢[11]。
螯合劑與連接子
連接子常見于藥物偶聯物,可將細胞毒素藥物與靶向載體部分偶聯。那螯合劑又是什么呢?
不同于 ADC 與 PDC 等其他偶聯藥物,RDC 使用放射性核素作為細胞毒素,現在熱門的放射性核素多為金屬離子形態,常需要與螯合劑絡合,以提高其穩定性,同時防止金屬核素與體內其他蛋白結合。絡合物還需與靶向載體偶聯,因此常使用雙功能螯合劑 (Bifunctional chelator),如 DOTA、NODAGA 等,既可以與金屬核素絡合,也具備活性基團可與靶向載體反應[12]。
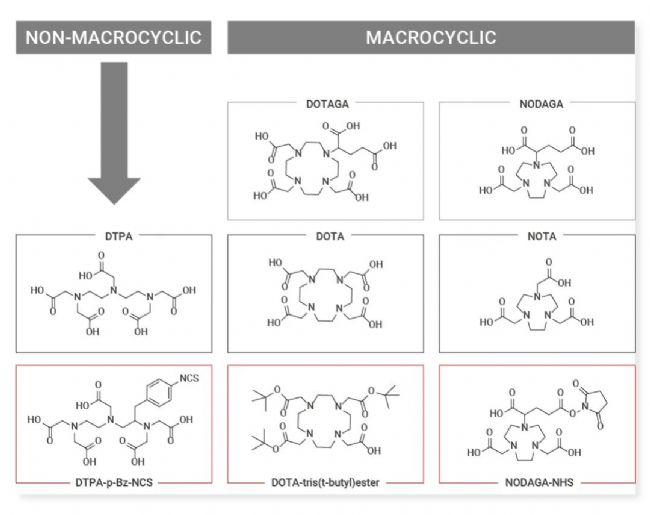
圖 3. 部分雙功能螯合劑[13]。
03
用于臨床的核素藥物
隨技術發展,90Y-ibritumomab tiuxetan、177Lu-DOTATATE 與 177Lu-PSMA-617 等 RDC 藥物先后被批準用于腫瘤治療。其中 177Lu-PSMA-617 自 2022 年被批上市后便迅速取得市場成功,已成長為 10 億美元級別的重磅藥物。
案例分享:177Lu-PSMA-617
177Lu 是一種 β 核素,與其他放射性核素相比具有更高的射程和能量,同時它發射的 γ 射線也有助于監測腫瘤反應,常用于肽受體放射性核素治療 (Peptide receptor radionuclide therapy, PRRT)。
177Lu-PSMA-617 由靶向載體 PSMA-binding ligand,螯合劑 DOTA 與放射性核素 177Lu 偶聯而成 (圖 4)。
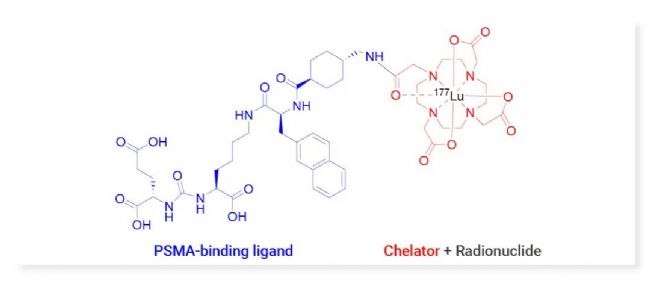
圖 4. 177Lu-PSMA-617 結構示意圖[14]。
由于前列腺特異性膜抗原 (PSMA) 在前列腺癌和轉移性去勢抵抗性前列腺癌 (mCRPC) 中高度表達,即可利用 PSMA 靶向放射性配體對癌細胞進行分子靶向。PSMA-617 與 β 發射體 177Lu 的結合可以將 β 粒子輻射定向遞送至表達 PSMA 的細胞和周圍微環境,進而誘導 DNA 損傷,最終導致細胞死亡。
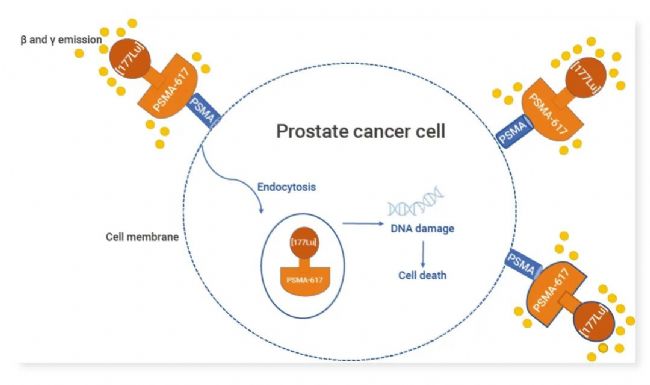
圖 5. 177Lu 標記前列腺特異性膜抗原的作用機制[15]。
用 [177Lu] 放射性標記的 PSMA-617 靶向載體與前列腺癌細胞膜上的 PSMA 分子結合,177Lu 原子釋放 ß 和 γ 粒子,DNA 損傷,細胞死亡。
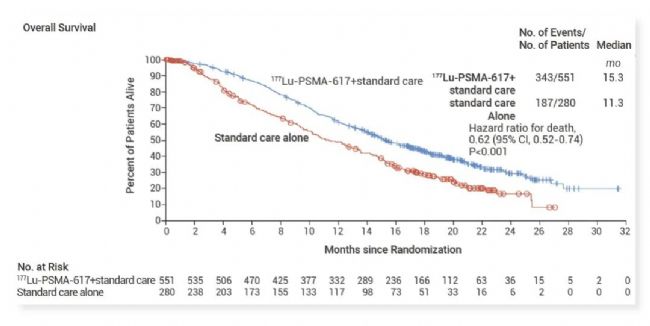
圖 6. 177Lu-PSMA-617 VISION 研究中位 OS 結果[16]。
04
小結
作為一種新型的靶向藥物,RDC 在腫瘤診斷與治療中表現出巨大潛力,明星分子 177Lu-DOTATATE 和 177Lu-PSMA-617 的成功也證明了 RDC 在臨床與商業端的前景,目前各大海內外藥企都在加快布局這一藍海市場,加速臨床轉化。
關于 MCE
MCE 提供高質量的靶向肽、螯合劑、抗體抑制劑等產品,助力藥物研發!同時還支持多肽定制、抗體定制、多肽-螯合劑偶聯等一站式定制服務哦~
| 產品推薦 |
| DOTATATE (HY-106244)
DOTATATE 是一種 DOTA 偶聯肽,可以被放射性核素標記以用于正電子發射斷層掃描 (PET) 成像和肽受體放射性核素研究 (PRRT)。 |
| DOTA-cyclo(RGDfK) (HY-P10732)
DOTA-cyclo (RGDfK) 是一種 DOTA-RGD 偶聯肽,可以被放射性核素標記用于腫瘤成像或治療。 |
| Cyclo(-RGDfK) (HY-P0023)
Cyclo (-RGDfK) 是一種選擇性的整合素 αvβ3 抑制劑,可通過與細胞表面 αvβ3 整合素的特異性結合,有效靶向腫瘤微血管和癌細胞。 |
| Octreotide (HY-P0036)
Octreotide 是一種生長抑素受體激動劑,可靶向生長抑素受體陽性的細胞。 |
| DOTA-NHS-ester (HY-128890)
DOTA-NHS ester 是一種 DOTA 衍生物,可標記放射核素或者成像探針用于腫瘤診斷或治療。 |
| DTPA-tetra (t-Bu ester) (HY-A0074) DTPA-tetra (t-Bu ester) 是一種用于腫瘤預靶向的大環 DPTA 衍生物,可用于多肽和放射性核素的偶聯。 |
| 多肽定制服務
MCE 可提供線性肽、環肽、熒光肽、多肽-螯合劑等多種多肽合成定制服務。 |
| XDC 定制服務
MCE 可提供 ADC、PDC、POC、XDC linker、RDC 等相關產品的一站式服務。 |
參考文獻:
[1] Li M, et al. Advances in macrocyclic chelators for positron emission tomography imaging. View. 2023 Oct;4(5):20230042.
[2] Fu Z, et al. Antibody drug conjugate: the "biological missile" for targeted cancer therapy. Signal Transduct Target Ther. 2022 Mar 22;7(1):93.
[3] Cooper BM, et al. Peptides as a platform for targeted therapeutics for cancer: peptide-drug conjugates (PDCs). Chem Soc Rev. 2021 Feb 15;50(3):1480-1494.
[4] Heh E, et al. Peptide Drug Conjugates and Their Role in Cancer Therapy. Int J Mol Sci. 2023 Jan 3;24(1):829.
[5] Zhuang C, et al. Small molecule-drug conjugates: A novel strategy for cancer-targeted treatment. Eur J Med Chem. 2019 Feb 1;163:883-895.
[6] Zhu G, et al. Aptamer-Drug Conjugates. Bioconjug Chem. 2015 Nov 18;26(11):2186-97.
[7] Dai H, et al. Pancreatic Cancer: Nucleic Acid Drug Discovery and Targeted Therapy. Front Cell Dev Biol. 2022 May 16;10:855474.
[8] Kines RC, et al. Harnessing Human Papillomavirus' Natural Tropism to Target Tumors. Viruses. 2022 Jul 28;14(8):1656.
[9] 江艷君, et al. 核素藥物在腫瘤細胞治療中的應用研究進展. 藥學進展. 2023;47(1):16-34.
[10] Grzmil M, et al. An overview of targeted radiotherapy. Radiopharm Chem. 2019:85-100.
[11] Zhang T, et al. Carrier systems of radiopharmaceuticals and the application in cancer therapy. Cell Death Discov. 2024 Jan 9;10(1):16.
[12] Brechbiel MW. Bifunctional chelates for metal nuclides. Q J Nucl Med Mol Imaging. 2008 Jun;52(2):166-73. Epub 2007 Nov 28
[13] Roesch F, et al. Radiometal-theranostics: the first 20 years. J Radioanal Nucl Chem. 2023 May;332(5):1557-76.
[14] Al Musaimi O. Peptide Therapeutics: Unveiling the Potential against Cancer-A Journey through 1989. Cancers (Basel). 2024 Mar 2;16(5):1032.
[15] Fu Z, et al. Antibody drug conjugate: the "biological missile" for targeted cancer therapy. Signal Transduct Target Ther. 2022 Mar 22;7(1):93.
[16] Sartor O, et al. VISION Investigators. Lutetium-177-PSMA-617 for Metastatic Castration-Resistant Prostate Cancer. N Engl J Med. 2021 Sep 16;385(12):1091-1103. doi: 10.1056/NEJMoa2107322. Epub 2021 Jun 23.





