MicroFab Inkjet噴墨打印制備人體皮膚等效物在體外免疫診斷的應用
近年來隨著人體組織工程學的發展,人體組織模型(細胞、組織、器官等)在藥物測試和安全性評估以及化妝品和新療法開發領域有許多潛在的應用,然而,適合于高通量篩選生物制劑的模型種類非常有限。為了更等效人體組織,近日,紐卡斯爾大學基礎學院Stefan Przyborski教授帶領團隊在《International Journal of Bioprinting》發表了影響因子30.20的高分文章,已被引用2953次。根據生物打印原理,該研究使用MicroFab的噴墨打印系統Jetlab 4對自體皮膚細胞進行生物打印和培養,在停留時間為1000μs,背壓為150mmHg,每滴體積為103±1nL的條件下,能夠打印自體細胞并產生人體皮膚等效物(HSE),在生產效率和輸出一致性之間取得了良好的平衡。研究證明了成纖維細胞和角化細胞可被高精度地生物打印并保持生物活性,組織學染色顯示HSE與人類皮膚相當,可廣泛應用于體外鑒定單克隆抗體的免疫毒性,以建立潛在免疫反應的細胞因子譜。
正文
隨著組織工程學的迅猛發展,使人類替換病損組織的夢想成為現實,人體皮膚等效物的研究,將給燒傷、大面積潰瘍及皮膚缺損患者在臨床的檢測、診斷、治療帶來福音。然而,HSE存在體外培養過程周期較長、難以及時滿足臨床需要等問題。本研究使用MicroFab的噴墨打印系統Jetlab 4對自體皮膚細胞進行生物精準打印和培養,先將20µL濃度為25×106個細胞/mL的纖維細胞懸液直接打印到96孔板內的Alvetex支架(膜厚200µm)上,如圖1,培養18天形成皮膚等效物,再將20μL濃度為20×106個細胞/mL的人表皮角質細胞均勻打印在培養的皮膚等效物上,誘導培養表皮層分化2周,開發出一種可擴展、大規模制備的方法來制造HSE,能夠保持皮膚等效性和活性,可應用于識別臨床前不良免疫反應。
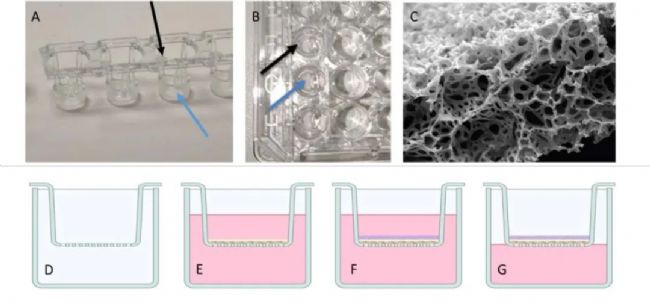
▲ 圖1 皮膚等效模型的開發
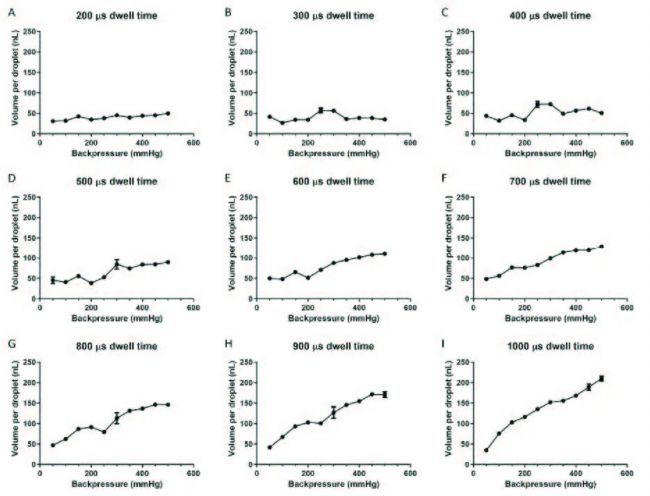
▲ 圖2 在不同的停留時間和正氣壓下,每個液滴所分配的平均介質體積
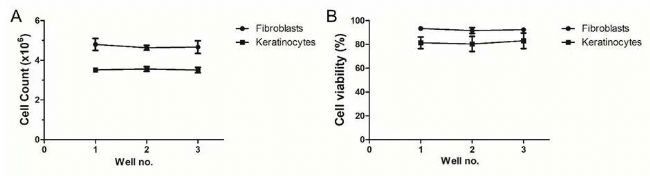
▲ 圖3 在靜置時間1000μs和背壓150 mmHg下,生物打印成纖維細胞和角化細胞的(A)細胞計數和(B)細胞活力
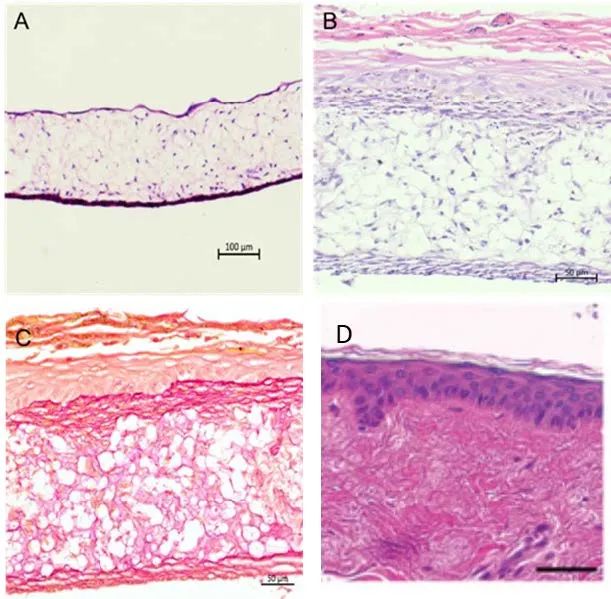
▲ 圖4 生物打印真皮和全層皮膚等效物的代表性染色
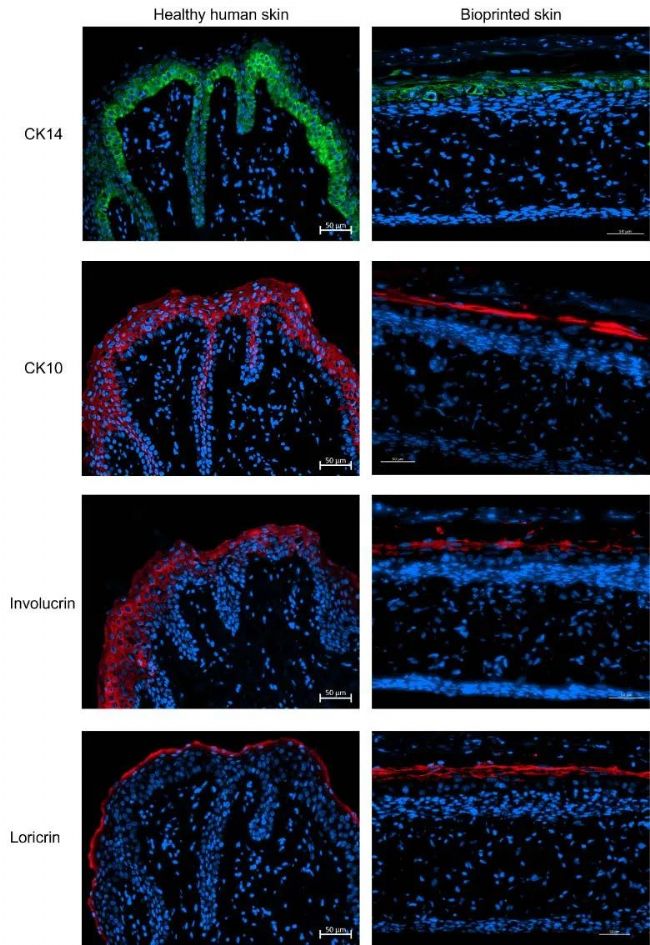
▲ 圖5 健康人體皮膚和生物打印皮膚的代表性染色
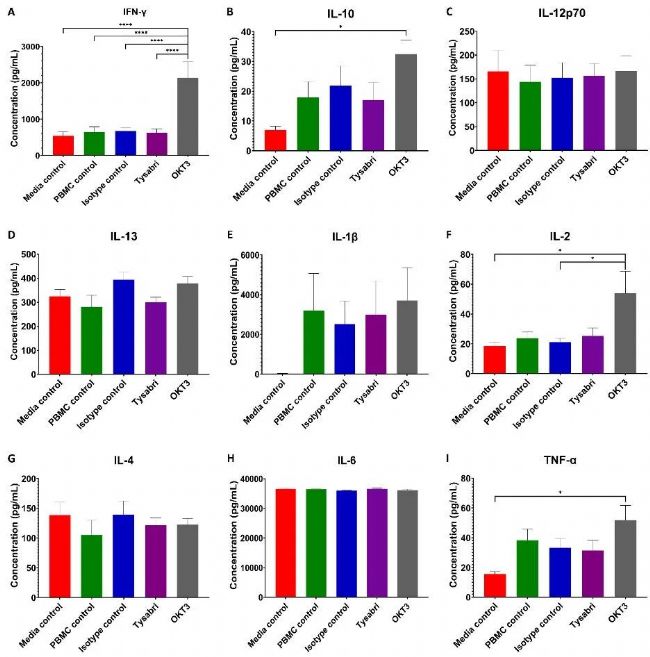
▲ 圖6 自體共培養的平均促炎細胞因子濃度
結語
本研究使用MicroFab噴墨打印系統Jetlab 4基于96孔板惰性支架生物打印,成功制備了人體皮膚等效物,可用于確定診斷單克隆抗體的不良免疫反應。證實了人源皮膚細胞生物打印的可行性,并保留細胞的生物功能形成完整的HSE,與人體健康皮膚效果相當,能夠成功地鑒定出陽性和陰性治療抗體的不良免疫反應。這項研究表明,生物打印的人體組織可以在體外識別由治療性抗體引發的不良免疫反應,從而在臨床測試之前加強對新型生物制劑的臨床前評估,如疾病建模和傷口愈合建模,未來工作的一個具體方面將涉及使用神經元和Swann細胞系對3D皮膚模型進行神經刺激,以進一步驗證模型并評估止痛藥物,對制藥工業的藥物開發過程非常有益。
參考文獻:
[1]Ahmed M, Hill D, Ahmed S, et al. Bioprinted autologous human skin equivalents for in vitro testing of therapeutic antibodies[J]. International Journal of Bioprinting, 2024, 10(2).
[2]Ahmed M M. Bioprinting of skin equivalents for immunotoxicity testing[D]. Newcastle University, 2020.
[3] Mazzocchi A, Soker S, Skardal A. 3D bioprinting for high-throughput screening: Drug screening, disease modeling, and precision medicine applications[J]. Applied Physics Reviews, 2019, 6(1).





