果聚糖測定方案K-FRUC(含重組菊粉酶和左旋糖酶)使用說明書
果聚糖測定方案K-FRUC(含重組菊粉酶和左旋糖酶)
每個試劑盒100次檢測
AOAC方法
999.03AACC方法
32-32.01法典II類方法
簡介:
果聚糖被定義為一個或多個果糖基-果糖鍵構成大部分鍵的任何化合物1。這是指聚臺物材料以及與二糖,菊粉糖一樣小的低聚物。該定義中包含的材料可能包含也可能不包含D-葡萄糖基取代基。果聚糖研究人員使用術語低聚物和聚合物來區分可以特定表征的材料和不能表征的材料1。果聚糖在植物界廣泛分布。它們存在于單子葉物,雙子葉植物和綠藻中果聚糖的分子結構和分子量不同。它們可分為三種主要類型:菊粉基團,果聚糖基團和分支基團。菊粉組由主要或完全具有(2→1)果糖基果糖鍵。Levan是一種主要或完全含有(2→6)果糖基果糖鍵。支鏈基團具有大量的(2→1)和(2→6)果糖基-果糖鍵(例如來自禾本科的禾本素)。
已經描述了幾種用于測量植物材料和食品中果聚糖的方法,但通常認為它們最好在水解成D-果糖和D-葡萄糖后測量。這引入了獨立去除或測量蔗糖,D-果糖和D-葡萄糖的挑戰。Pontis(1966)2用結晶酵母轉化酶水解蔗糖,并通過用氫氧化鈉煮沸破壞所得的D-葡萄糖和D-果糖以及現有的單糖。然而,酵母轉化酶也水解較低聚合度(DP)的低聚果糖(FOS )。濃度為10 mg/mL時 ,1-酮糖的水解率約為蔗糖的20% ,1,1-酮四糖的水解率約為蔗糖的10%。3
在McCleary和Blakeney(1999)引入的果聚糖測定程序中,樣品中的蔗糖用特定的蔗糖酶水解,釋放的D-葡萄糖和D-果糖以及樣品中的所有其他還原糖通過硼氫化物還原成相應的糖醇(不用PAHBAH試劑測量)。然后用高度純化的內菊粉酶和外菊粉酶菊型和支鏈型果聚糖水解成D-葡萄糖和D-果糖。隨后,重組產生超純的外切和內切菊粉酸并將其引入該方法。這些酶的使用消除了痕量B-葡萄糖苷酶和非重組酶中存在的B-葡糖寡糖部分水解的問題。在最近的發展中,重組內切果聚糖酶已被摻入果聚糖酶混合物中,將該方法的使用擴展到測量草中存在的果聚糖型果聚糖,如蒂莫西,雞冠,黑麥草和紅羊茅。在沒有內切果聚糖酶的情況下,果聚糖型果聚糖被低估了(表1)4,5
本手冊中描述的方法采用超純重組酶,專門測量菊苣、大麗花、菊芋中的菊粉型果聚糖等果聚糖;洋蔥和小麥莖葉中高度分枝的果聚糖;以及來自帝汶草等牧草的levan型果聚糖。這種方法低估了商業上部分水解的果聚糖產品,如Raftilose P-95®(約20%),其程度與果聚糖的水解程度有關。如果果聚糖/FOS成分的樣本可用,則很容易通過分析確定實際低估的程度(見附錄A)。龍舌蘭果聚糖是定量測量的。商業龍舌蘭果聚糖制劑含有高達20%的果糖、葡萄糖和蔗糖(蔗糖不是果聚糖,因此未被測量)。
原理:
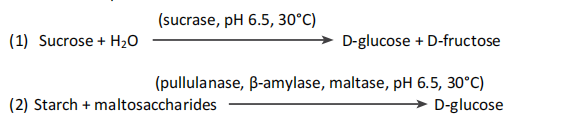
蔗糖被一種特定的蔗糖酶水解,這種酶對低聚合度(DP)的FOS(如1-果糖和1,1-酮四糖)沒有作用3。淀粉和麥芽糊精被普魯蘭酶和β-淀粉酶水解為麥芽糖和麥芽三糖,然后這些低聚糖被麥芽糖酶水解為D-葡萄糖(1&2)。由于蔗糖酶在30°C下更穩定,因此現在這是該培養步驟的推薦溫度。
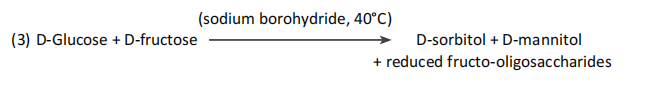
D-葡萄糖和D-果糖被硼氫化鈉還原為相應的糖醇、D-山梨醇和D-甘露醇。在這個反應中,水解菊粉制劑中低聚果糖還原端的D-果糖基殘留物也被還原為糖醇。天然果聚糖和非還原性FOS,如Neosugs®,不受此反應的影響(3)。
FOS、果聚糖和硼氫化物還原的FOS被內切和內切菊粉酶和內切左旋酶特異性水解為D-葡萄糖和D-果糖(4)。
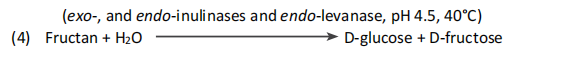
使用PAHBAH還原糖法測量來自果聚糖的D-果糖和D-葡萄糖。6這種方法使用簡單,D-果糖和D-葡萄糖的顏色響應相同(5)。

特異性、敏感性、線性和精密度:
該測定是在AOAC International和AACC International的主持下成功進行的實驗室間評估的主題。7該測定對所有類型的果聚糖都有特異性,包括:;主要或僅含有(2→1)果糖基-果糖鍵(菊粉)的那些;具有大量(2→1)和(2→6)果糖基-果糖鍵的那些(例如來自洋蔥、禾本科和龍舌蘭的那些);以及主要或僅含有(2-6)果糖基-果糖鍵(levan)的那些。硼氫化物還原的FOS被水解,從“還原端”末端釋放出D-甘露醇。谷物中果聚糖的微量水平可以通過混合連接β-葡聚糖的部分水解來測量,而不會降低糖水平。如果樣品可能含有半乳糖基蔗糖低聚糖(如棉子糖),應通過α-半乳糖苷酶水解將其去除。
該測定的最小區分吸光度為0.010吸光度單位。這相當于被分析樣品提取物中12.8μg/mL的D-葡萄糖和D-果糖。
檢測限為每毫升樣品提取物25.6μg D-果糖和/或D-葡萄糖,這是由0.02的測定吸光度差得出的。
該測定在每次測定2.3至55μg D-果糖或D-葡萄糖的范圍內呈線性。在使用一種樣品溶液進行兩次測定時,可能會出現0.005至0.010的吸光度差,這對應于每次測定的D-果糖或D-葡萄糖水平為0.023-0.046μg。
干擾:
被分析樣品中的干擾物質可以通過加入菊粉或左旋內標來識別。預計該標準的定量回收。樣品處理和提取過程中的損失是通過進行回收實驗來識別的,即在初始提取步驟中向樣品中添加菊粉或果聚糖。
安全:用于測定果聚糖的試劑不是《危險物質條例》意義上的危險物質。應遵守適用于化學物質的一般安全措施。
套件內容:
Megazyme提供適用于進行100次檢測的試劑盒。試劑盒包含完整的檢測方法以及:
瓶子1. 蔗糖酶加β-淀粉酶、普魯蘭酶和麥芽糖酶凍干粉。儲存溫度低于-10°C。有效期見單獨標簽。
瓶子2. 果糖酶。凍干粉狀重組外旋和內切菊粉酶以及重組內切(x2)左旋酯酶。儲存溫度低于-10°C。有效期見單獨標簽。
瓶子3. 菊粉控制面粉。菊粉在α-纖維素存在下冷凍干燥。在室溫下儲存。有效期見單獨標簽。
瓶子4. Levan控制面粉。提摩太草在α-纖維素存在下凍干。在室溫下儲存。有效期見單獨標簽。
瓶子5. 蔗糖控制面粉。蔗糖在α-纖維素存在下冷凍干燥。在室溫下儲存。有效期見單獨標簽。
瓶子6. D-果糖標準溶液(1.5 mg/mL)在0.2%(w/v)苯甲酸中的溶液。在室溫下儲存。有效期見單獨標簽。
酶的制備:
1.將瓶子1的內容物(蔗糖酶和β-淀粉酶等)溶解在22 mL緩沖液1中[馬來酸鈉(100 mM,pH 6.5加牛血清白蛋白(0.5 mg/mL)](酶溶液A)。分成適當體積的等分試樣,儲存在聚丙烯管中。
在-10°C以下穩定≤2年。
2. 將瓶子2(果糖酶)中的一個內容物溶解在11 mL緩沖液2[乙酸鈉(100 mM,pH 4.5)]中。這是酶溶液B。分成適當體積的等分試樣,儲存在聚丙烯管中。在-10°C以下穩定4個月。在需要之前,不要溶解剩余的瓶子2(果聚糖酶)。
注意:重新懸浮瓶子2(果糖酶)所需的體積與AOAC方法(999.032016.142018.07)中所述的體積不同,但所得酶溶液B的濃度保持不變。因此,它可以在這些方法的其余步驟中正常使用。
3、4、5使用提供的瓶子3、4,5和6中的內容物。
&6在室溫下穩定>5年。
緩沖液(未提供):
緩沖液1:馬來酸鈉緩沖液(100 mM,pH 6.5)
將馬來酸(11.6 g,Sigma目錄號M0375)溶解在900 mL蒸餾水中,用氫氧化鈉溶液(2 M)將pH值調節至6.5。將音量調節到1升。
向100 mL該緩沖液中加入50 mg牛血清白蛋白,使濃度達到0.5 mg/mL。該緩沖液用于溶解瓶子1(蔗糖酶制劑)。緩沖液應存放在-10°C以下。
緩沖液2:醋酸鈉緩沖液(100 mM,pH 4.5)
將冰醋酸(5.8 mL)加入900 mL蒸餾水中。使用1M氫氧化鈉將pH值調節至4.5。將音量調節到1升。這是緩沖液2。
試劑(未提供):
1.PAHBAH還原糖測定試劑
溶液A.在磁力攪拌器上的250毫升燒杯中,將10克對羥基苯甲酸酰肼(Sigma目錄號H9882-100G)(PAHBAH)加入60毫升蒸餾水中。攪拌漿液,加入10mL濃鹽酸。用蒸餾水將溶液的體積調節至200毫升。
溶液B.將24.9 g檸檬酸三鈉二水合物(MW=294.1)加入500 mL蒸餾水中并攪拌溶解。加入2.2克二水合氯化鈣(分子量=147.01)并溶解。加入40.0克氫氧化鈉,攪拌溶解(溶液可能呈乳白色,但稀釋至2升后會澄清)。將音量調節到2升。
PAHBAH工作試劑。使用前,將20 mL溶液A加入180 mL溶液B中,并充分混合。混合溶液在冰上穩定約4小時。
2.氫氧化鈉(50 mM)
將2.0克氫氧化鈉溶解在900毫升蒸餾水中。將音量調節到1升。
3.堿性硼氫化物(在50mM氫氧化鈉中的10mg/mL硼氫化鈉)
精確稱取約50mg硼氫化鈉(Sigma目錄號213462-100G),放入聚丙烯容器(容量10mL,帶螺帽)中。記錄試管上的確切重量(為方便起見,約為10),密封試管并將其儲存在干燥器中以備將來使用。在室溫下穩定2年以上。
使用前,將硼氫化鈉(10mg/mL)溶解在50mM氫氧化鈉中。該溶液在室溫下穩定4-5小時。這是試劑3(堿性硼氫化物溶液)。
4.乙酸(200 mM)
將11.6 mL冰醋酸加入600 mL蒸餾水中,并將體積調節至1 L。這是試劑4(200 mM醋酸)。
設備(推薦):
1.玻璃試管(圓底;16 x 100 mm)。
2.帶PTFE內襯酚醛蓋的Pyrex螺旋蓋培養管(25 x 150 mm)(Fisher目錄號14-933D)。
3.微量移液器,例如Gilson Pipetman®(100μL和200μL)。
4.正排量移液器,例如Eppendorf Multipete®
-使用5.0 mL Combitip®(分配0.2 mL等分蔗糖酶混合物和0.1 mL等分果糖,以及其他溶液和緩沖液)。
-使用50 mL Combitip®(分配5.0 mL PAHBAH工作試劑等分試樣)。
5.Brand®Dispensette®S數字瓶蓋分配器(2.5-25mL)(Sigma目錄號BR4600351)。
-分配10mL 200mM乙酸鈉緩沖液(pH 5.0)。
6.分析天平。
7.分光光度計設置為410 nm。
8.渦流混合器(例如Vortex Genie®2混合器)。
9.恒溫水浴(設置為30°C和40°C)。
10.沸水浴。
11.微型離心機(所需轉速13000 rpm)。
12.一次性1.5毫升聚丙烯微量離心管,如Sarstedt Cat No.72.690(www.sarstedt.com)。
13.計數器。
控制和預防措施:
1.使用PAHBAH試劑在100°C下孵育的時間至關重要,應使用秒表計時。
2.在每組測定中,應同時包括試劑空白和D-果糖對照并進行分析。
a) 試劑空白由0.3 mL 100 mM醋酸鈉緩沖液(緩沖液2)和5.0 mL PAHBAH工作試劑組成。
b) 通過將0.2 mL D-果糖標準溶液(1.5 mg/mL)加入0.9 mL 100 mM乙酸鈉(pH 4.5)(緩沖液2)中并充分混合來制備D-果糖對照品。將0.2 mL等分的該溶液(含54.5μg D-果糖)分為四份,放入玻璃試管(16 x 100 mm)中。向每個試管中加入0.1 mL緩沖液2和5.0 mL PAHBAH工作試劑(在沸水浴中孵育之前)。
3.每組測定都包括菊粉/纖維素對照粉末和/或果聚糖/纖維素對照粉。藥瓶標簽上標明了這些粉末的果聚糖含量。
4.每批新試劑都應分析蔗糖/纖維素對照粉末。如果蔗糖酶處理步驟完全有效,則測定的果聚糖值應為約0.2%(w/w)。如果蔗糖酶無效,測定值將反映對照蔗糖/纖維素粉末的蔗糖含量[約10%(w/w);見小瓶標簽]。
5.D-果糖對照品(一式四份)和試劑空白溶液(一式兩份)與每批樣品一起運行,并與樣品同時在沸水浴中孵育。
6.可以使用D-果糖標準溶液(0.2 mL,1.5 mg/mL)并從測定程序的步驟B.1(第8頁)開始檢查硼氫化物還原的有效性。用果聚糖酶處理(步驟C.2)改為加入醋酸鹽緩沖液(0.1 mL,0.1 M,pH 4.5)。用PAHBAH工作試劑孵育后,溶液應無色。
7.如果被分析的樣品含有半乳糖基蔗糖低聚糖,可以通過與黑曲霉α-半乳糖苷酶(Megazyme cat.no.E AGLANP)孵育將其去除。請參閱Megazyme網站上K-FRUC下的常見問題(FAQ)。
測定程序:
將干燥樣品研磨以通過0.5毫米的篩網。用鋒利的刀將固體脂肪樣品(如巧克力)切成細小的刨花;軟食品(如涂抹食品)無需進一步準備即可進行分析。所有樣品在稱重前應在室溫下進行。
A.果聚糖提取
含有0-10%(w/w)果聚糖的樣品
準確稱取約400mg樣品放入干燥的pyrex螺旋蓋培養管(25 x 150 mm)中,并加入25 mL蒸餾水。松松地蓋住管子。將試管放入沸水浴中加熱10分鐘。5分鐘后,擰緊管帽,通過倒置和搖晃試管劇烈混合內容物。將試管放回沸水浴中。再過5分鐘后,將試管從沸水浴中取出,通過倒置和搖動再次混合內容物。
含有10-40%(w/w)果聚糖的樣品
準確稱取約100mg樣品,放入干燥的pyrex螺旋蓋培養基中 試管(25 x 150 mm)并加入25 mL蒸餾水。松松地蓋住管子。放置 將試管放入沸水浴中加熱10分鐘。5分鐘后,擰緊 蓋上管帽,通過倒置和搖晃劇烈混合內容物。放回試管 放入沸水浴中。再過5分鐘后,將試管從沸騰中取出 水浴,通過倒置和搖動再次混合內容物。在每種情況下,讓試管內容物冷卻至室溫,然后轉移~ 2.0 mL放入2.0 mL微量離心管中,以13000 rpm離心5分鐘。
注意:對于含有40-100%(w/w)果聚糖的樣品,加入1 mL離心提取物 加入2mL水中并進行測定。
B. 去除蔗糖、淀粉和還原糖:
注意:如果樣品中蔗糖和麥芽糊精含量很高(例如嬰兒 牛奶配方),將孵化時間延長至60分鐘,以確保完全 這些低聚糖的水解。 在每種情況下,讓試管內容物冷卻至室溫,然后轉移~ 2.0 mL放入2.0 mL微量離心管中,以13000 rpm離心5分鐘。
3.向試管中加入0.2 mL試劑3(堿性硼氫化物溶液),劇烈攪拌 并用Parafilm®覆蓋管子。將試管在40°C下孵育30分鐘以達到效果 將還原糖完全還原為糖醇。
4.在試管中加入0.5mL試劑4(200mM乙酸),并在攪拌下劇烈攪拌 渦流混合器。應觀察到強烈的泡騰(這種治療可以消除 過量硼氫化物并將pH值調節至約4.5)。這被稱為解決方案S。
C.果聚糖的水解和測定:
1.準確小心地將0.2 mL等分溶液S轉移到3個玻璃杯的底部 試管(16 x 100毫米)。
2.向其中2個試管中加入0.1mL果糖溶液(酶溶液B) (樣品)和0.1mL緩沖液2(100mM乙酸鈉)至第三個(樣品) 空白)。
3.將試管在40°C下孵育30分鐘,使果聚糖完全水解為D-果糖和D-葡萄糖。在培養過程中用Parafilm®密封試管。
4.向所有試管中加入5.0 mL PAHBAH工作試劑[樣品、樣品空白、D-果糖標準品(見對照和注意事項2.b)、試劑空白(對照和 注意事項2.a)和菊粉/纖維素對照提取物和/或果聚糖/ 纖維素控制]并在沸水浴中孵育6分鐘。
5.從沸水浴中取出管子,立即將其放入冷水中 將水(18-20°C)加熱約5分鐘。
6.測量所有溶液在410nm處相對于試劑空白的吸光度。 冷卻試管后盡快測量吸光度值。PAHBAH 顏色復合體會隨著時間的推移而褪色。
計算:
果聚糖(%w/w):
 其中:
其中:
ΔA=樣品吸光度-樣品空白吸光度(兩者均與試劑空白相對)
F=將吸光度值轉換為μg D-果糖的系數
=(54.5μg D-果糖)/(54.5微克D-果糖的吸光度)
5=從測定的0.2 mL轉換為1.0 mL的系數
25=所用萃取劑的體積(mL)
1.1/0.2=從1.1mL酶消化液中取出0.2mL用于分析
W=提取樣品的重量(mg)(即100或200mg)
100/W=表示果聚糖占樣品重量百分比的系數
1/1000=從μg轉換為mg的系數
162/180=從游離D-果糖轉化為果糖酐(和葡萄糖酐)的因子,如
D=樣品提取物的進一步稀釋
注意:使用Megazyme Mega-Calc™可以簡化這些計算, 可從Megazyme網站上的產品顯示處下載 (www.megazyme.com)。
表1.用外加內切菊粉酶測定各種樣品的果聚糖含量 并且不添加內切左旋酯酶。
附錄:
A. 確定由于以下原因而低估果聚糖含量的程度 水解菊粉的硼氫化物還原:
玻璃試管(16 x 120 mm),加入0.9 mL pH 4.5的100 mm醋酸鈉緩沖液(緩沖液2)在劇烈攪拌下加入試管中。
6.準確小心地將0.2 mL等分溶液轉移到
三個玻璃試管(16 x 100 mm),按照以下步驟進行果聚糖水解標準果聚糖程序;步驟C.2至C.6。這給了非硼氫化物還原的果聚糖樣品(NBRF)的吸光度。按照以下計算硼氫化物還原后標準程序中果聚糖的回收率百分比如下:
回收率=吸光度BRF/吸光度NBRF x 100
參考文獻:
1. Lewis, D. H. (1993).低聚果聚糖的命名和圖示-供討論的論文。新植物學家, 124, 583-595.
2. Pontis, H. G. (1966). Observations on the de novo synthesis of fructosans
in vivo. Arch Biochem Biochem., 116, 416-423.
3. McCleary, B. V. & Blakeney, A. B. (1999).體內果糖從頭合成的觀察。 Cereal Foods World, 44, 398-406.
4. Longland, A. C., Dhanoa, M. S. & Harris, P. A. (2011). 比色法和高效液相色譜法測定馬牧草中果聚糖的比較。 J. Sci. Food Agric, 92, 1878-1885.
5. McCleary, B. V., Charmier, L., McKie,V. A. & Rogowski, A. (2019). 動物食品(動物飼料、寵物食品和配料)中果聚糖(菊粉、FOS、Levan和支鏈果聚糖)的測定:單一實驗室驗證, First Action 2018.07. J. AOAC International, 102(3), 883-892.
6. Lever, M. (1973). 對羥基苯甲酸酰肼比色熒光法測定碳水化合物。 Biochem. Med. 7(2), 274-281.
7. McCleary, B. V, Murphy, A. & Mugford, D. C. (1997). 酶/分光光度法測定食品中的低聚果糖和果聚糖多糖:合作研究。 J. AOAC International, 83, 356-364.
每個試劑盒100次檢測
AOAC方法
999.03AACC方法
32-32.01法典II類方法
簡介:
果聚糖被定義為一個或多個果糖基-果糖鍵構成大部分鍵的任何化合物1。這是指聚臺物材料以及與二糖,菊粉糖一樣小的低聚物。該定義中包含的材料可能包含也可能不包含D-葡萄糖基取代基。果聚糖研究人員使用術語低聚物和聚合物來區分可以特定表征的材料和不能表征的材料1。果聚糖在植物界廣泛分布。它們存在于單子葉物,雙子葉植物和綠藻中果聚糖的分子結構和分子量不同。它們可分為三種主要類型:菊粉基團,果聚糖基團和分支基團。菊粉組由主要或完全具有(2→1)果糖基果糖鍵。Levan是一種主要或完全含有(2→6)果糖基果糖鍵。支鏈基團具有大量的(2→1)和(2→6)果糖基-果糖鍵(例如來自禾本科的禾本素)。
已經描述了幾種用于測量植物材料和食品中果聚糖的方法,但通常認為它們最好在水解成D-果糖和D-葡萄糖后測量。這引入了獨立去除或測量蔗糖,D-果糖和D-葡萄糖的挑戰。Pontis(1966)2用結晶酵母轉化酶水解蔗糖,并通過用氫氧化鈉煮沸破壞所得的D-葡萄糖和D-果糖以及現有的單糖。然而,酵母轉化酶也水解較低聚合度(DP)的低聚果糖(FOS )。濃度為10 mg/mL時 ,1-酮糖的水解率約為蔗糖的20% ,1,1-酮四糖的水解率約為蔗糖的10%。3
在McCleary和Blakeney(1999)引入的果聚糖測定程序中,樣品中的蔗糖用特定的蔗糖酶水解,釋放的D-葡萄糖和D-果糖以及樣品中的所有其他還原糖通過硼氫化物還原成相應的糖醇(不用PAHBAH試劑測量)。然后用高度純化的內菊粉酶和外菊粉酶菊型和支鏈型果聚糖水解成D-葡萄糖和D-果糖。隨后,重組產生超純的外切和內切菊粉酸并將其引入該方法。這些酶的使用消除了痕量B-葡萄糖苷酶和非重組酶中存在的B-葡糖寡糖部分水解的問題。在最近的發展中,重組內切果聚糖酶已被摻入果聚糖酶混合物中,將該方法的使用擴展到測量草中存在的果聚糖型果聚糖,如蒂莫西,雞冠,黑麥草和紅羊茅。在沒有內切果聚糖酶的情況下,果聚糖型果聚糖被低估了(表1)4,5
本手冊中描述的方法采用超純重組酶,專門測量菊苣、大麗花、菊芋中的菊粉型果聚糖等果聚糖;洋蔥和小麥莖葉中高度分枝的果聚糖;以及來自帝汶草等牧草的levan型果聚糖。這種方法低估了商業上部分水解的果聚糖產品,如Raftilose P-95®(約20%),其程度與果聚糖的水解程度有關。如果果聚糖/FOS成分的樣本可用,則很容易通過分析確定實際低估的程度(見附錄A)。龍舌蘭果聚糖是定量測量的。商業龍舌蘭果聚糖制劑含有高達20%的果糖、葡萄糖和蔗糖(蔗糖不是果聚糖,因此未被測量)。
原理:
蔗糖被一種特定的蔗糖酶水解,這種酶對低聚合度(DP)的FOS(如1-果糖和1,1-酮四糖)沒有作用3。淀粉和麥芽糊精被普魯蘭酶和β-淀粉酶水解為麥芽糖和麥芽三糖,然后這些低聚糖被麥芽糖酶水解為D-葡萄糖(1&2)。由于蔗糖酶在30°C下更穩定,因此現在這是該培養步驟的推薦溫度。

D-葡萄糖和D-果糖被硼氫化鈉還原為相應的糖醇、D-山梨醇和D-甘露醇。在這個反應中,水解菊粉制劑中低聚果糖還原端的D-果糖基殘留物也被還原為糖醇。天然果聚糖和非還原性FOS,如Neosugs®,不受此反應的影響(3)。

FOS、果聚糖和硼氫化物還原的FOS被內切和內切菊粉酶和內切左旋酶特異性水解為D-葡萄糖和D-果糖(4)。
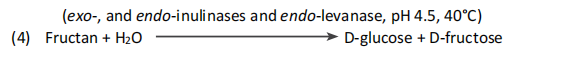
使用PAHBAH還原糖法測量來自果聚糖的D-果糖和D-葡萄糖。6這種方法使用簡單,D-果糖和D-葡萄糖的顏色響應相同(5)。

特異性、敏感性、線性和精密度:
該測定是在AOAC International和AACC International的主持下成功進行的實驗室間評估的主題。7該測定對所有類型的果聚糖都有特異性,包括:;主要或僅含有(2→1)果糖基-果糖鍵(菊粉)的那些;具有大量(2→1)和(2→6)果糖基-果糖鍵的那些(例如來自洋蔥、禾本科和龍舌蘭的那些);以及主要或僅含有(2-6)果糖基-果糖鍵(levan)的那些。硼氫化物還原的FOS被水解,從“還原端”末端釋放出D-甘露醇。谷物中果聚糖的微量水平可以通過混合連接β-葡聚糖的部分水解來測量,而不會降低糖水平。如果樣品可能含有半乳糖基蔗糖低聚糖(如棉子糖),應通過α-半乳糖苷酶水解將其去除。
該測定的最小區分吸光度為0.010吸光度單位。這相當于被分析樣品提取物中12.8μg/mL的D-葡萄糖和D-果糖。
檢測限為每毫升樣品提取物25.6μg D-果糖和/或D-葡萄糖,這是由0.02的測定吸光度差得出的。
該測定在每次測定2.3至55μg D-果糖或D-葡萄糖的范圍內呈線性。在使用一種樣品溶液進行兩次測定時,可能會出現0.005至0.010的吸光度差,這對應于每次測定的D-果糖或D-葡萄糖水平為0.023-0.046μg。
干擾:
被分析樣品中的干擾物質可以通過加入菊粉或左旋內標來識別。預計該標準的定量回收。樣品處理和提取過程中的損失是通過進行回收實驗來識別的,即在初始提取步驟中向樣品中添加菊粉或果聚糖。
安全:用于測定果聚糖的試劑不是《危險物質條例》意義上的危險物質。應遵守適用于化學物質的一般安全措施。
套件內容:
Megazyme提供適用于進行100次檢測的試劑盒。試劑盒包含完整的檢測方法以及:
瓶子1. 蔗糖酶加β-淀粉酶、普魯蘭酶和麥芽糖酶凍干粉。儲存溫度低于-10°C。有效期見單獨標簽。
瓶子2. 果糖酶。凍干粉狀重組外旋和內切菊粉酶以及重組內切(x2)左旋酯酶。儲存溫度低于-10°C。有效期見單獨標簽。
瓶子3. 菊粉控制面粉。菊粉在α-纖維素存在下冷凍干燥。在室溫下儲存。有效期見單獨標簽。
瓶子4. Levan控制面粉。提摩太草在α-纖維素存在下凍干。在室溫下儲存。有效期見單獨標簽。
瓶子5. 蔗糖控制面粉。蔗糖在α-纖維素存在下冷凍干燥。在室溫下儲存。有效期見單獨標簽。
瓶子6. D-果糖標準溶液(1.5 mg/mL)在0.2%(w/v)苯甲酸中的溶液。在室溫下儲存。有效期見單獨標簽。
酶的制備:
1.將瓶子1的內容物(蔗糖酶和β-淀粉酶等)溶解在22 mL緩沖液1中[馬來酸鈉(100 mM,pH 6.5加牛血清白蛋白(0.5 mg/mL)](酶溶液A)。分成適當體積的等分試樣,儲存在聚丙烯管中。
在-10°C以下穩定≤2年。
2. 將瓶子2(果糖酶)中的一個內容物溶解在11 mL緩沖液2[乙酸鈉(100 mM,pH 4.5)]中。這是酶溶液B。分成適當體積的等分試樣,儲存在聚丙烯管中。在-10°C以下穩定4個月。在需要之前,不要溶解剩余的瓶子2(果聚糖酶)。
注意:重新懸浮瓶子2(果糖酶)所需的體積與AOAC方法(999.032016.142018.07)中所述的體積不同,但所得酶溶液B的濃度保持不變。因此,它可以在這些方法的其余步驟中正常使用。
3、4、5使用提供的瓶子3、4,5和6中的內容物。
&6在室溫下穩定>5年。
緩沖液(未提供):
緩沖液1:馬來酸鈉緩沖液(100 mM,pH 6.5)
將馬來酸(11.6 g,Sigma目錄號M0375)溶解在900 mL蒸餾水中,用氫氧化鈉溶液(2 M)將pH值調節至6.5。將音量調節到1升。
向100 mL該緩沖液中加入50 mg牛血清白蛋白,使濃度達到0.5 mg/mL。該緩沖液用于溶解瓶子1(蔗糖酶制劑)。緩沖液應存放在-10°C以下。
緩沖液2:醋酸鈉緩沖液(100 mM,pH 4.5)
將冰醋酸(5.8 mL)加入900 mL蒸餾水中。使用1M氫氧化鈉將pH值調節至4.5。將音量調節到1升。這是緩沖液2。
試劑(未提供):
1.PAHBAH還原糖測定試劑
溶液A.在磁力攪拌器上的250毫升燒杯中,將10克對羥基苯甲酸酰肼(Sigma目錄號H9882-100G)(PAHBAH)加入60毫升蒸餾水中。攪拌漿液,加入10mL濃鹽酸。用蒸餾水將溶液的體積調節至200毫升。
溶液B.將24.9 g檸檬酸三鈉二水合物(MW=294.1)加入500 mL蒸餾水中并攪拌溶解。加入2.2克二水合氯化鈣(分子量=147.01)并溶解。加入40.0克氫氧化鈉,攪拌溶解(溶液可能呈乳白色,但稀釋至2升后會澄清)。將音量調節到2升。
PAHBAH工作試劑。使用前,將20 mL溶液A加入180 mL溶液B中,并充分混合。混合溶液在冰上穩定約4小時。
2.氫氧化鈉(50 mM)
將2.0克氫氧化鈉溶解在900毫升蒸餾水中。將音量調節到1升。
3.堿性硼氫化物(在50mM氫氧化鈉中的10mg/mL硼氫化鈉)
精確稱取約50mg硼氫化鈉(Sigma目錄號213462-100G),放入聚丙烯容器(容量10mL,帶螺帽)中。記錄試管上的確切重量(為方便起見,約為10),密封試管并將其儲存在干燥器中以備將來使用。在室溫下穩定2年以上。
使用前,將硼氫化鈉(10mg/mL)溶解在50mM氫氧化鈉中。該溶液在室溫下穩定4-5小時。這是試劑3(堿性硼氫化物溶液)。
4.乙酸(200 mM)
將11.6 mL冰醋酸加入600 mL蒸餾水中,并將體積調節至1 L。這是試劑4(200 mM醋酸)。
設備(推薦):
1.玻璃試管(圓底;16 x 100 mm)。
2.帶PTFE內襯酚醛蓋的Pyrex螺旋蓋培養管(25 x 150 mm)(Fisher目錄號14-933D)。
3.微量移液器,例如Gilson Pipetman®(100μL和200μL)。
4.正排量移液器,例如Eppendorf Multipete®
-使用5.0 mL Combitip®(分配0.2 mL等分蔗糖酶混合物和0.1 mL等分果糖,以及其他溶液和緩沖液)。
-使用50 mL Combitip®(分配5.0 mL PAHBAH工作試劑等分試樣)。
5.Brand®Dispensette®S數字瓶蓋分配器(2.5-25mL)(Sigma目錄號BR4600351)。
-分配10mL 200mM乙酸鈉緩沖液(pH 5.0)。
6.分析天平。
7.分光光度計設置為410 nm。
8.渦流混合器(例如Vortex Genie®2混合器)。
9.恒溫水浴(設置為30°C和40°C)。
10.沸水浴。
11.微型離心機(所需轉速13000 rpm)。
12.一次性1.5毫升聚丙烯微量離心管,如Sarstedt Cat No.72.690(www.sarstedt.com)。
13.計數器。
控制和預防措施:
1.使用PAHBAH試劑在100°C下孵育的時間至關重要,應使用秒表計時。
2.在每組測定中,應同時包括試劑空白和D-果糖對照并進行分析。
a) 試劑空白由0.3 mL 100 mM醋酸鈉緩沖液(緩沖液2)和5.0 mL PAHBAH工作試劑組成。
b) 通過將0.2 mL D-果糖標準溶液(1.5 mg/mL)加入0.9 mL 100 mM乙酸鈉(pH 4.5)(緩沖液2)中并充分混合來制備D-果糖對照品。將0.2 mL等分的該溶液(含54.5μg D-果糖)分為四份,放入玻璃試管(16 x 100 mm)中。向每個試管中加入0.1 mL緩沖液2和5.0 mL PAHBAH工作試劑(在沸水浴中孵育之前)。
3.每組測定都包括菊粉/纖維素對照粉末和/或果聚糖/纖維素對照粉。藥瓶標簽上標明了這些粉末的果聚糖含量。
4.每批新試劑都應分析蔗糖/纖維素對照粉末。如果蔗糖酶處理步驟完全有效,則測定的果聚糖值應為約0.2%(w/w)。如果蔗糖酶無效,測定值將反映對照蔗糖/纖維素粉末的蔗糖含量[約10%(w/w);見小瓶標簽]。
5.D-果糖對照品(一式四份)和試劑空白溶液(一式兩份)與每批樣品一起運行,并與樣品同時在沸水浴中孵育。
6.可以使用D-果糖標準溶液(0.2 mL,1.5 mg/mL)并從測定程序的步驟B.1(第8頁)開始檢查硼氫化物還原的有效性。用果聚糖酶處理(步驟C.2)改為加入醋酸鹽緩沖液(0.1 mL,0.1 M,pH 4.5)。用PAHBAH工作試劑孵育后,溶液應無色。
7.如果被分析的樣品含有半乳糖基蔗糖低聚糖,可以通過與黑曲霉α-半乳糖苷酶(Megazyme cat.no.E AGLANP)孵育將其去除。請參閱Megazyme網站上K-FRUC下的常見問題(FAQ)。
測定程序:
將干燥樣品研磨以通過0.5毫米的篩網。用鋒利的刀將固體脂肪樣品(如巧克力)切成細小的刨花;軟食品(如涂抹食品)無需進一步準備即可進行分析。所有樣品在稱重前應在室溫下進行。
A.果聚糖提取
含有0-10%(w/w)果聚糖的樣品
準確稱取約400mg樣品放入干燥的pyrex螺旋蓋培養管(25 x 150 mm)中,并加入25 mL蒸餾水。松松地蓋住管子。將試管放入沸水浴中加熱10分鐘。5分鐘后,擰緊管帽,通過倒置和搖晃試管劇烈混合內容物。將試管放回沸水浴中。再過5分鐘后,將試管從沸水浴中取出,通過倒置和搖動再次混合內容物。
含有10-40%(w/w)果聚糖的樣品
準確稱取約100mg樣品,放入干燥的pyrex螺旋蓋培養基中 試管(25 x 150 mm)并加入25 mL蒸餾水。松松地蓋住管子。放置 將試管放入沸水浴中加熱10分鐘。5分鐘后,擰緊 蓋上管帽,通過倒置和搖晃劇烈混合內容物。放回試管 放入沸水浴中。再過5分鐘后,將試管從沸騰中取出 水浴,通過倒置和搖動再次混合內容物。在每種情況下,讓試管內容物冷卻至室溫,然后轉移~ 2.0 mL放入2.0 mL微量離心管中,以13000 rpm離心5分鐘。
注意:對于含有40-100%(w/w)果聚糖的樣品,加入1 mL離心提取物 加入2mL水中并進行測定。
B. 去除蔗糖、淀粉和還原糖:
- 精確分配0.2 mL待分析溶液(含 約0.1-1.0 mg/mL果聚糖)放入玻璃試管(16 x 100 mm)底部。
注意:如果樣品中蔗糖和麥芽糊精含量很高(例如嬰兒 牛奶配方),將孵化時間延長至60分鐘,以確保完全 這些低聚糖的水解。 在每種情況下,讓試管內容物冷卻至室溫,然后轉移~ 2.0 mL放入2.0 mL微量離心管中,以13000 rpm離心5分鐘。
3.向試管中加入0.2 mL試劑3(堿性硼氫化物溶液),劇烈攪拌 并用Parafilm®覆蓋管子。將試管在40°C下孵育30分鐘以達到效果 將還原糖完全還原為糖醇。
4.在試管中加入0.5mL試劑4(200mM乙酸),并在攪拌下劇烈攪拌 渦流混合器。應觀察到強烈的泡騰(這種治療可以消除 過量硼氫化物并將pH值調節至約4.5)。這被稱為解決方案S。
C.果聚糖的水解和測定:
1.準確小心地將0.2 mL等分溶液S轉移到3個玻璃杯的底部 試管(16 x 100毫米)。
2.向其中2個試管中加入0.1mL果糖溶液(酶溶液B) (樣品)和0.1mL緩沖液2(100mM乙酸鈉)至第三個(樣品) 空白)。
3.將試管在40°C下孵育30分鐘,使果聚糖完全水解為D-果糖和D-葡萄糖。在培養過程中用Parafilm®密封試管。
4.向所有試管中加入5.0 mL PAHBAH工作試劑[樣品、樣品空白、D-果糖標準品(見對照和注意事項2.b)、試劑空白(對照和 注意事項2.a)和菊粉/纖維素對照提取物和/或果聚糖/ 纖維素控制]并在沸水浴中孵育6分鐘。
5.從沸水浴中取出管子,立即將其放入冷水中 將水(18-20°C)加熱約5分鐘。
6.測量所有溶液在410nm處相對于試劑空白的吸光度。 冷卻試管后盡快測量吸光度值。PAHBAH 顏色復合體會隨著時間的推移而褪色。
計算:
果聚糖(%w/w):
 其中:
其中:ΔA=樣品吸光度-樣品空白吸光度(兩者均與試劑空白相對)
F=將吸光度值轉換為μg D-果糖的系數
=(54.5μg D-果糖)/(54.5微克D-果糖的吸光度)
5=從測定的0.2 mL轉換為1.0 mL的系數
25=所用萃取劑的體積(mL)
1.1/0.2=從1.1mL酶消化液中取出0.2mL用于分析
W=提取樣品的重量(mg)(即100或200mg)
100/W=表示果聚糖占樣品重量百分比的系數
1/1000=從μg轉換為mg的系數
162/180=從游離D-果糖轉化為果糖酐(和葡萄糖酐)的因子,如
D=樣品提取物的進一步稀釋
注意:使用Megazyme Mega-Calc™可以簡化這些計算, 可從Megazyme網站上的產品顯示處下載 (www.megazyme.com)。
表1.用外加內切菊粉酶測定各種樣品的果聚糖含量 并且不添加內切左旋酯酶。
| 果聚糖含量,% W/W(以干物質為基準) | ||
| 樣本 | 外消旋酶和內消旋酶 | 外消旋和內消旋異麥芽糖酶加內消旋麥芽糖酶 |
| 貓尾草(樣本A) | 4.9 | 13.8 |
| 貓尾草(樣本B) | 3.2 | 6.2 |
| 黑麥草 | 8.9 | 9.9 |
| 燕麥干草 | 10.7 | 10.9 |
| 大麥MAX(谷物) | 12.8 | 12.8 |
| 來自貓尾草的純果聚糖 | 59.2 | 91.2 |
| 菊苣中的純菊粉 | 95.0 | 92.3 |
附錄:
A. 確定由于以下原因而低估果聚糖含量的程度 水解菊粉的硼氫化物還原:
- 準確稱取約40mg FOS或純果聚糖,放入干燥的派熱克斯螺帽中 培養管(25 x 150 mm)并加入40 mL蒸餾水。松松地蓋住管子。 在沸水浴中加熱試管10分鐘,以溶解果聚糖并攪拌 5和10分鐘后,將管內容物放入渦流混合器中。
- 讓溶液冷卻至室溫,然后混合試管內容物 徹底。
- 準確地將0.2 mL等分溶液分配到玻璃試管底部 (16 x 100 mm)并加入0.2 mL pH 4.5的100 mm醋酸鈉緩沖液(緩沖液2)和 充分混合。
- 按照標準果聚糖程序從步驟B.3進行到步驟C.6(包括C.6和C.6), 第8頁),并測量不含果糖的試管的吸光度 潛伏期這給出了硼氫化物還原的果聚糖樣品的吸光度 (BRF)。
玻璃試管(16 x 120 mm),加入0.9 mL pH 4.5的100 mm醋酸鈉緩沖液(緩沖液2)在劇烈攪拌下加入試管中。
6.準確小心地將0.2 mL等分溶液轉移到
三個玻璃試管(16 x 100 mm),按照以下步驟進行果聚糖水解標準果聚糖程序;步驟C.2至C.6。這給了非硼氫化物還原的果聚糖樣品(NBRF)的吸光度。按照以下計算硼氫化物還原后標準程序中果聚糖的回收率百分比如下:
回收率=吸光度BRF/吸光度NBRF x 100
參考文獻:
1. Lewis, D. H. (1993).低聚果聚糖的命名和圖示-供討論的論文。新植物學家, 124, 583-595.
2. Pontis, H. G. (1966). Observations on the de novo synthesis of fructosans
in vivo. Arch Biochem Biochem., 116, 416-423.
3. McCleary, B. V. & Blakeney, A. B. (1999).體內果糖從頭合成的觀察。 Cereal Foods World, 44, 398-406.
4. Longland, A. C., Dhanoa, M. S. & Harris, P. A. (2011). 比色法和高效液相色譜法測定馬牧草中果聚糖的比較。 J. Sci. Food Agric, 92, 1878-1885.
5. McCleary, B. V., Charmier, L., McKie,V. A. & Rogowski, A. (2019). 動物食品(動物飼料、寵物食品和配料)中果聚糖(菊粉、FOS、Levan和支鏈果聚糖)的測定:單一實驗室驗證, First Action 2018.07. J. AOAC International, 102(3), 883-892.
6. Lever, M. (1973). 對羥基苯甲酸酰肼比色熒光法測定碳水化合物。 Biochem. Med. 7(2), 274-281.
7. McCleary, B. V, Murphy, A. & Mugford, D. C. (1997). 酶/分光光度法測定食品中的低聚果糖和果聚糖多糖:合作研究。 J. AOAC International, 83, 356-364.
標簽:
果聚糖檢測K-FRUC
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





