深度解讀ICH Q13指南:過程分析技術(PAT)與工藝模型
原創 BioAces 浚真生命科學

2004年,美國FDA發布了過程分析技術(Process Analytical Technology, PAT)指導原則,鼓勵制藥企業在生產過程中實施實時監控。然而傳統自動化技術長期受限于數據處理能力弱、復雜模式識別困難、動態響應滯后及高成本低擴展性等問題。當前,在生物制造4.0的時代背景下,人工智能技術取得的突破性進展,結合先進的高精度傳感器技術與邊緣計算等基礎設施的完善,為推進PAT的實踐應用開辟了新路徑。這種數智化系統通過深度學習實現海量數據特征提取、強化學習驅動動態環境自主決策、數字孿生構建虛實交互的預測優化體系,結合多模態學習與遷移學習打破領域壁壘,系統性降低人為操作偏差風險及生產成本。
 圖片來源: 【1】
圖片來源: 【1】
解讀ICH Q8至Q13指南
過程分析技術( PAT)作為質量監管的關鍵工具,其發展進程始終與國際監管框架革新保持同步。國際人用藥品注冊技術協調會(ICH)發布的ICH Q8至ICH Q13系列指南,共同構建起"質量源于設計(QbD)"理念下的PAT技術實施路徑。
關于ICH Q8- ICH Q12指南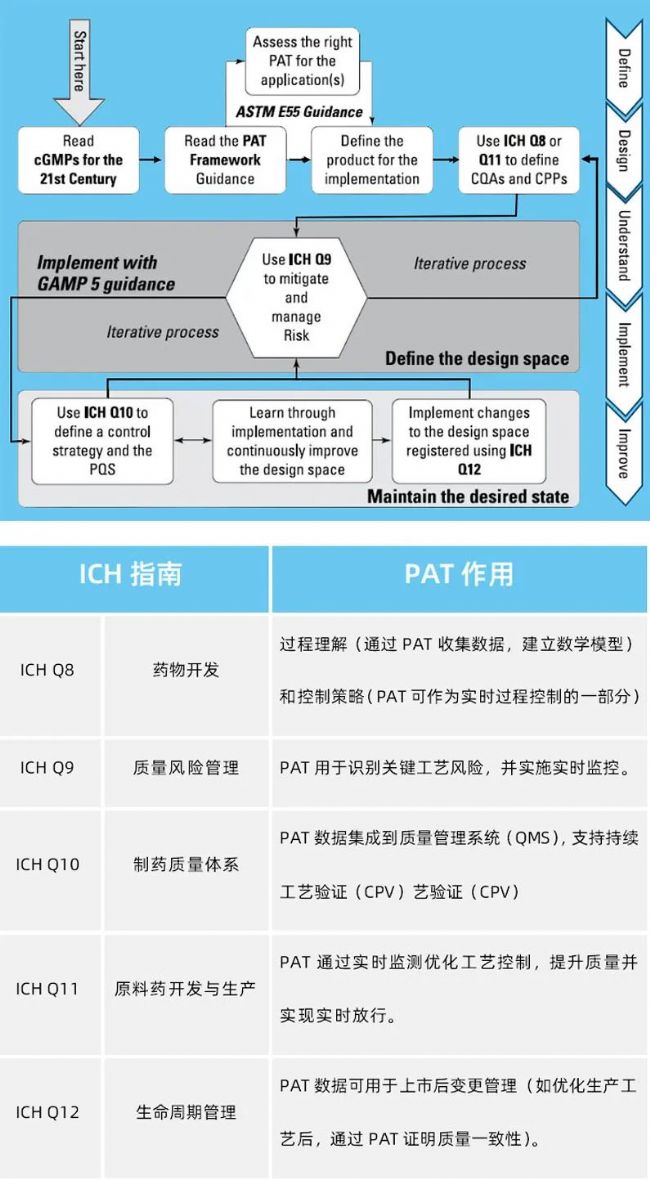
ICH Q13指南
ICH Q13(《原料藥與制劑的連續制造》,2023年2月正式生效)是國際藥品監管機構(FDA、EMA、PMDA等)共同制定的指南,旨在規范連續制造(Continuous Manufacturing, CM)在制藥行業的應用,以應對制藥行業技術革新與監管標準全球化的雙重需求。
ICH Q13指南:五大關鍵點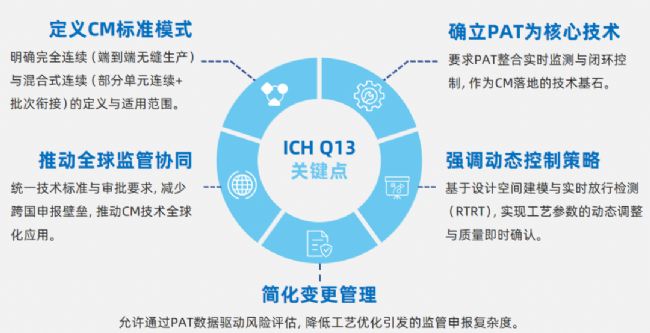
ICH Q13 指南:首度提出“工藝模型”
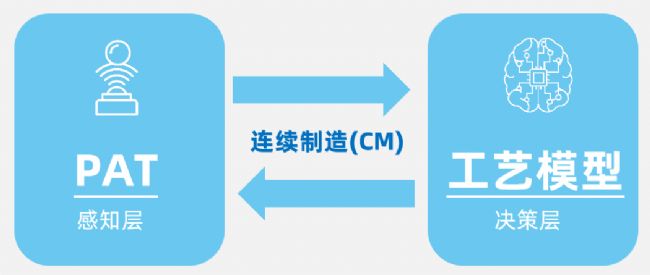
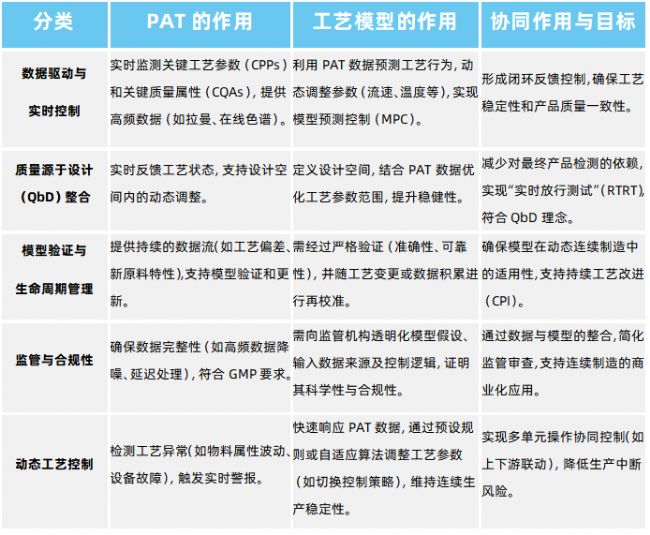
在ICH Q13框架中,創新型提出“工藝模型”(Process Model)這一關鍵概念,用于描述、預測和控制連續制造過程的數學或統計模型,通常基于質量平衡、動力學、傳質/傳熱原理等建立,以支持連續制造的設計、控制和優化。工藝模型其核心作用是:預測產品質量(如關鍵質量屬性,CQAs)、優化工藝參數(如流速、溫度、反應時間)、支持實時放行測試(RTRT),減少傳統離線檢測的延遲。
(1)科學方法-工藝模型
工藝模型可用于開發連續制造(CM)流程或作為商業化生產控制策略(包括分流策略)的組成部分。工藝模型還可用于實時預測質量屬性,從而實現及時工藝調整以維持受控狀態。在開發階段,工藝模型可通過闡明輸入(如工藝參數、物料屬性)與輸出(如產品質量屬性)之間的關聯關系,支持設計空間的建立。工藝模型能加深工藝理解并減少實驗研究次數。關于模型的一般考量(包括模型影響對驗證要求的啟示)。【2】針對連續制造(CM)應用,需額外考量以下方面:
工藝模型需針對系統設計與配置及相關物料屬性進行定制化開發。
模型開發需理解基礎模型假設(如活塞流系統與混合流系統)及其適用條件。風險評估、科學依據和相關數據將指導模型輸入的選擇與模型構建。基于敏感性分析等適當方法確定影響模型性能的關鍵輸入參數至關重要。
模型性能取決于數學結構及輸入數據質量(如噪聲、數據變異性)等因素。在設定模型性能驗收標準時,需綜合考慮模型的預期用途,以及用于量化實驗測量與模型預測不確定性的統計方法。
模型驗證應基于預定驗收標準,采用統計學合理的方法評估模型對預期用途的適用性。驗證活動重點在于證明基礎模型假設的合理性,以及對模型敏感性、不確定性和參考方法理解程度的充分性。【3】
商業化生產中,需建立模型性能的日常維護與監控機制,尤其需關注可能影響模型的變異因素和工藝變更(如輸入物料變更、工藝參數變更)。通過評估模型變更影響(如模型性能優化、用途變更、基礎假設變更),結合模型開發范圍和驗證標準進行風險評估,可實現模型全生命周期的高效管理。根據變更幅度及其對模型性能的影響,可能需重新開發并驗證模型。
(2)監管要求-工藝模型
申報資料中提供的模型開發、驗證及生命周期維護的詳細程度應與模型類型和影響等級相匹配。工藝模型需針對所定義系統(如設備、布局、連接方式)進行專門化開發。支持商業化生產所用模型的相關信息應在現場檢查時可供查閱,并保存于生產場地或可即時調取。關于工藝模型的監管要求。【4】
PAT與工藝模型協同作用
在ICH Q13框架下,連續制造(CM)的核心是工藝模型與過程分析技術(PAT),兩者在生產過程中協同作用,共同支持實時質量控制與工藝優化。
 ICH Q13的發布標志著連續制造(CM)從技術探索正式升級為全球標準化的生產模式。隨著人工智能與數字孿生技術的導入及監管指南對過程分析技術(PAT)要求的全面實施,連續制造(CM)將加速成為行業主流,推動生物制藥生產向智能化、連續化與合規化的新紀元邁進,助力企業提升藥品質量與生產效率,為患者提供更安全創新療法。
ICH Q13的發布標志著連續制造(CM)從技術探索正式升級為全球標準化的生產模式。隨著人工智能與數字孿生技術的導入及監管指南對過程分析技術(PAT)要求的全面實施,連續制造(CM)將加速成為行業主流,推動生物制藥生產向智能化、連續化與合規化的新紀元邁進,助力企業提升藥品質量與生產效率,為患者提供更安全創新療法。
參考文獻:
[1]Gadsby, M. (2021) PHARMA PRODUCTION COULD DOUBLE RIGHT NOW – USING ITS EXISTING MANUFACTURING FOOTPRINT… BioPharma Asia, 10(2).
[2]ICH-Endorsed Guide for ICH Q8/Q9/Q10 Implementation.
[3]Q13 on continuous manufacturing of drug substances and drug products EMA/6401/2023 Page 10/43.
[4]ICH Endorsed Guide for ICH Q8/Q9/Q10 Implementation for regulatory expectations on process models.

2004年,美國FDA發布了過程分析技術(Process Analytical Technology, PAT)指導原則,鼓勵制藥企業在生產過程中實施實時監控。然而傳統自動化技術長期受限于數據處理能力弱、復雜模式識別困難、動態響應滯后及高成本低擴展性等問題。當前,在生物制造4.0的時代背景下,人工智能技術取得的突破性進展,結合先進的高精度傳感器技術與邊緣計算等基礎設施的完善,為推進PAT的實踐應用開辟了新路徑。這種數智化系統通過深度學習實現海量數據特征提取、強化學習驅動動態環境自主決策、數字孿生構建虛實交互的預測優化體系,結合多模態學習與遷移學習打破領域壁壘,系統性降低人為操作偏差風險及生產成本。
 圖片來源: 【1】
圖片來源: 【1】解讀ICH Q8至Q13指南
過程分析技術( PAT)作為質量監管的關鍵工具,其發展進程始終與國際監管框架革新保持同步。國際人用藥品注冊技術協調會(ICH)發布的ICH Q8至ICH Q13系列指南,共同構建起"質量源于設計(QbD)"理念下的PAT技術實施路徑。
關于ICH Q8- ICH Q12指南

ICH Q13指南
ICH Q13(《原料藥與制劑的連續制造》,2023年2月正式生效)是國際藥品監管機構(FDA、EMA、PMDA等)共同制定的指南,旨在規范連續制造(Continuous Manufacturing, CM)在制藥行業的應用,以應對制藥行業技術革新與監管標準全球化的雙重需求。
ICH Q13指南:五大關鍵點

ICH Q13 指南:首度提出“工藝模型”
在ICH Q13框架中,創新型提出“工藝模型”(Process Model)這一關鍵概念,用于描述、預測和控制連續制造過程的數學或統計模型,通常基于質量平衡、動力學、傳質/傳熱原理等建立,以支持連續制造的設計、控制和優化。工藝模型其核心作用是:預測產品質量(如關鍵質量屬性,CQAs)、優化工藝參數(如流速、溫度、反應時間)、支持實時放行測試(RTRT),減少傳統離線檢測的延遲。
(1)科學方法-工藝模型
工藝模型可用于開發連續制造(CM)流程或作為商業化生產控制策略(包括分流策略)的組成部分。工藝模型還可用于實時預測質量屬性,從而實現及時工藝調整以維持受控狀態。在開發階段,工藝模型可通過闡明輸入(如工藝參數、物料屬性)與輸出(如產品質量屬性)之間的關聯關系,支持設計空間的建立。工藝模型能加深工藝理解并減少實驗研究次數。關于模型的一般考量(包括模型影響對驗證要求的啟示)。【2】針對連續制造(CM)應用,需額外考量以下方面:
工藝模型需針對系統設計與配置及相關物料屬性進行定制化開發。
模型開發需理解基礎模型假設(如活塞流系統與混合流系統)及其適用條件。風險評估、科學依據和相關數據將指導模型輸入的選擇與模型構建。基于敏感性分析等適當方法確定影響模型性能的關鍵輸入參數至關重要。
模型性能取決于數學結構及輸入數據質量(如噪聲、數據變異性)等因素。在設定模型性能驗收標準時,需綜合考慮模型的預期用途,以及用于量化實驗測量與模型預測不確定性的統計方法。
模型驗證應基于預定驗收標準,采用統計學合理的方法評估模型對預期用途的適用性。驗證活動重點在于證明基礎模型假設的合理性,以及對模型敏感性、不確定性和參考方法理解程度的充分性。【3】
商業化生產中,需建立模型性能的日常維護與監控機制,尤其需關注可能影響模型的變異因素和工藝變更(如輸入物料變更、工藝參數變更)。通過評估模型變更影響(如模型性能優化、用途變更、基礎假設變更),結合模型開發范圍和驗證標準進行風險評估,可實現模型全生命周期的高效管理。根據變更幅度及其對模型性能的影響,可能需重新開發并驗證模型。
(2)監管要求-工藝模型
申報資料中提供的模型開發、驗證及生命周期維護的詳細程度應與模型類型和影響等級相匹配。工藝模型需針對所定義系統(如設備、布局、連接方式)進行專門化開發。支持商業化生產所用模型的相關信息應在現場檢查時可供查閱,并保存于生產場地或可即時調取。關于工藝模型的監管要求。【4】
PAT與工藝模型協同作用
在ICH Q13框架下,連續制造(CM)的核心是工藝模型與過程分析技術(PAT),兩者在生產過程中協同作用,共同支持實時質量控制與工藝優化。


參考文獻:
[1]Gadsby, M. (2021) PHARMA PRODUCTION COULD DOUBLE RIGHT NOW – USING ITS EXISTING MANUFACTURING FOOTPRINT… BioPharma Asia, 10(2).
[2]ICH-Endorsed Guide for ICH Q8/Q9/Q10 Implementation.
[3]Q13 on continuous manufacturing of drug substances and drug products EMA/6401/2023 Page 10/43.
[4]ICH Endorsed Guide for ICH Q8/Q9/Q10 Implementation for regulatory expectations on process models.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





