Cell Metabolism 綜述解析 | 肝星狀細胞的可塑性代謝調節能力
肝星狀細胞(HSCs)是一種非實質肝周細胞,因其是肝損傷的原發性纖維化細胞類型備受關注。HSCs被認為是一種可塑的細胞類型,可以調節肝臟生長、免疫和炎癥,以及能量和營養穩態,這些功能依賴于代謝的多樣性和能量消耗的嚴格調控。然而HSCs通過其可塑性調節多種生理和病理反應的機制仍不清楚。HSCs是一個被忽視的決定免疫代謝的因素,在支持肝功能和免疫應答損失中,細胞從靜止狀態激活或轉分化為增殖的、運動的肌成纖維細胞,分泌細胞外基質,需要快速適應以滿足更高的能量需求,這些適應包括中心碳代謝的編程、線粒體數量和活性的增強、內質網應激,以及通過儲存在細胞質液滴中的視黃酯自噬依賴性水解而釋放游離脂肪酸。本文揭示了HSCs的代謝調節如何在健康和疾病中發揮其功能。

背景
星狀細胞(以前稱為脂肪細胞、脂肪儲存細胞、竇周細胞或Ito細胞)來源于隔膜橫隔間充質,間充質來源的間皮和間皮細胞從胚胎肝臟表面向內遷移,產生HSCs和其他血管周圍間充質細胞。正常的肝臟中,HSCs在核周液滴中儲存維生素A作為視黃酯,這些細胞是人體維甲酸儲存的主要倉庫。
單細胞轉錄方法在表征HSCs方面有非常廣泛的應用。在肝損傷期間,HSCs轉分化,或“激活”成增殖的、纖維化的肌成纖維細胞(MFBs),這些細胞獲得一系列共同維持損傷和纖維化的特征(Figure 1),由于肝損傷通過凋亡或逆轉為“失活”表型來減少HSC衍生的MFBs數量。這些失活細胞具有獨特的表觀遺傳特征,并且在未來HSCs再損傷時更容易重新激活。
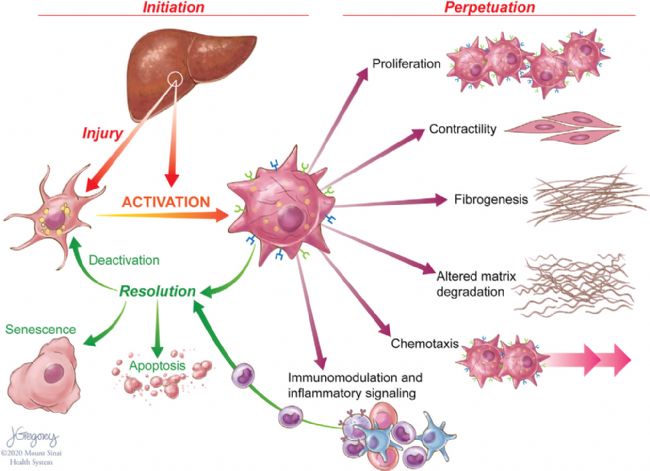
Figure 1. Features of HSC Activation and Resolution
慢性肝損傷可促進HSCs的持續激活,導致細胞外基質(ECM)蛋白的積累,從而破壞肝臟的結構及其功能。HSC的激活是由許多信號觸發的,這些信號是細胞損傷的標志,包括浸潤免疫細胞產生的促炎細胞因子、肝細胞凋亡小體、內皮細胞介導的生長因子激活和活性氧負擔增加。細胞對損傷的反應通過一系列旁分泌和自分泌環增強,包括轉化生長因子β1(TGF-β1)和結締組織生長因子(CTGF)等纖維化信號。激活HSCs需要能量來支持細胞增殖,分泌ECM、蛋白酶和細胞因子,并向細胞損傷區域遷移的能力。這些細胞利用了許多具有很高能量需求、類似于癌細胞的代謝途徑。
HSC生物能學BIOENERGETICS
碳水代謝-糖酵解和糖異生
HSC中心碳代謝重編程在細胞活化中起著重要作用,因為它們上調糖酵解以滿足轉分化為肌成纖維細胞表型的能量需求(Figure 2)。HSCs葡萄糖穩態調節的研究幾乎完全集中在培養的細胞,因此未來的研究將需要在體內疾病模型中驗證這些發現。與靜息的HSCs相比,活化的人HSCs(aHSCs)和培養活化的大鼠HSCs提高了葡萄糖利用率,原代培養激活細胞增強了葡萄糖轉運能力和糖酵解活性、葡萄糖轉運體GLUT1、GLUT2和GLUT4在原代培養激活永生性的大鼠HSCs中表達,并可在這些條件下通過高細胞外葡萄糖或嘌呤能信號進行調節,此外GLUT1在癌細胞中也有很高的表達。
在永生化的人和原代小鼠HSCs中,與葡萄糖細胞內過程相關基因的mRNA表達也增加,如己糖激酶2(HK2)、果糖-2,6-雙磷酸酶-3(PFKFB3)和丙酮酸激酶(PK)。這些酶誘導的糖酵解增強伴隨著糖異生相關基因的下調,包括磷酸烯醇丙酮酸羧激酶1(PCK1)和果糖雙磷酸酶1(FBP1)。培養中HSCs的糖酵解增加伴隨著中心碳代謝產物遠離檸檬酸循環。活化的HSCs增加了丙酮酸脫氫酶激酶3(PDK3)的表達,PDK3抑制丙酮酸向乙酰輔酶A的轉化,進而乳酸積累,類似于癌細胞中的Warburg效應。丙酮酸激酶M2(PKM2)可能是aHSCs和癌細胞之間獨特的聯系,它在兩種細胞類型中被誘導以促進需氧糖酵解。
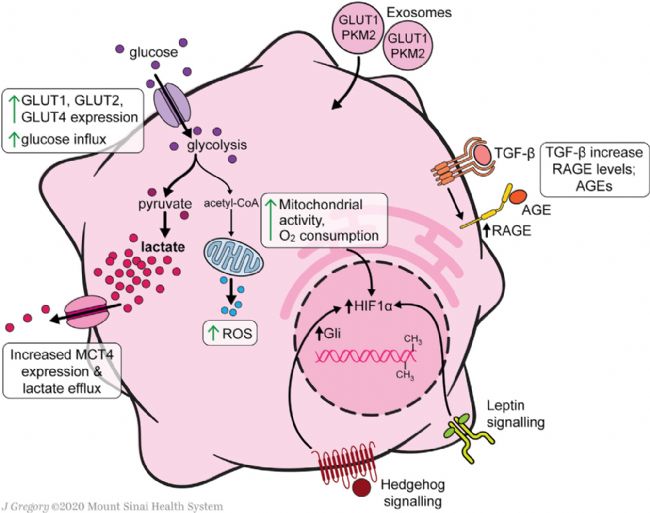
Figure 2. Glucose and Mitochondrial Metabolism in Activated HSCs
乳酸在HSC代謝中直接參與激活和MFB表型的永久化。盡管乳酸輸出泵單羧酸轉運體4(MCT4)的表達上調,但aHSCs細胞內乳酸水平仍升高。阻斷乳酸在細胞內積累可以抑制增殖,抑制與MFB特征相關的基因,并誘導脂質積累和脂生成基因。外泌體為快速誘導糖酵解提供了一種機制,以支持從靜息的HSCs(qHSCs)到aHSCs的代謝重編程,從而實現基質細胞損傷反應的同步。缺氧誘導因子1-α(HIF-1α)信號增強了外泌體的產生,進而刺激了缺氧和炎癥條件下HSC的激活。此外,表觀遺傳調控也有助于HSCs葡萄糖代謝的轉化。
糖基化
除了碳水化合物分解代謝的變化外,aHSCs還會改變蛋白質糖基化譜。aHSCs細胞表面糖基含有有利于加連蛋白-1(Gal-1)結合的葡聚糖。與qHSCs相比,aHSCs中上調的Gal-1與神經素-1(NRP-1)結合,NRP-1是一種誘導血管再生、血管通透和傷口愈合的受體。Gal-1和NRP-1的相互作用誘導了TGF-β1和PDGF樣信號級聯。
高胰島素血癥和高血糖
高胰島素血癥和高血糖是代謝綜合征的關鍵特征,可激活培養的HSCs,但其在NAFLD和NASH狀態下對HSC激活的具體貢獻尚不清楚。在高糖培養基中培養的原代小鼠HSCs增加了I型膠原的產生,這是由SMAD3轉錄因子介導的。高糖暴露導致Stat4(PIAS4)蛋白抑制劑的HSC上調,抑制SIRT1的轉錄。減少SIRT1導致SMAD3的賴氨酸高乙酰化,從而增加SMAD3對其促纖維化DNA結合靶點的親和力。然而高血糖和高胰島素血癥與HSC激活之間的聯系也是基于培養研究,缺乏體內研究。
增強的糖基化終產物(AGEs)是由蛋白質和糖之間的非酶反應產生的,也能激活HSCs。研究表明單獨AGEs和高血糖可能不足以誘導纖維化,但在組織損傷的情況下,它們可能會放大由其他因素驅動的纖維化發生。
線粒體代謝
盡管糖酵解優先增加,維持肌成纖維細胞樣表型仍然需要氧化磷酸化的主要能量貢獻,比如細胞激活過程中線粒體數量和活性的增加。而線粒體代謝的變化可能不局限于ATP的產生,還有ROS的作用。培養激活的HSCs具有豐富的線粒體,這一數量的增加伴隨著線粒體活性的提高,如耗氧率、線粒體膜電位和F1-Fo ATP酶的表達,線粒體解偶聯可抑制體外HSCs的激活,也使ATP的產量減少了30%。盡管糖酵解上調,ATP產生的一個重要和必要的部分仍然是通過氧化磷酸化。高胰島素血癥小鼠中HSCs的線粒體體積增強,類似于在培養基中激活的HSCs的變化。
來自其他組織的成纖維細胞群體提供了更多的參考。例如,腎成纖維細胞中,TGF-β1活性通過抑制電子傳遞鏈成員線粒體蛋白復合物III而增加ROS的產生。心臟成纖維細胞中,TGF-β1刺激通過NLRP3增加線粒體ROS。
維生素A和脂質代謝--視黃醇儲存和脂滴
維生素A穩態的調節是HSCs在健康和損傷肝臟中的一個本質特征。HSCs儲存50%-95%的人體維生素A,由視黃醇及其代謝物組成。超過95%的類視黃醇以視黃酯(REs)形式儲存,占HSC細胞質脂滴含量的30%-50%。在HSCs中,類視黃醇與幾種脂滴蛋白有關,包括脂肪分化相關蛋白(ADRP)、脂肪素、perilipin 5、ATGL和CGI-58,以及肝脂肪酸結合蛋白(L-FABP)。一般來說,更高的perilipin表達降低了HSC的激活,可能是通過穩定類視黃酯液滴來減弱它們對提供能量的脂肪酸的分解代謝。
血液維生素A水平受到嚴格的調控,但健康肝臟中維生素A攝取和釋放的具體機制尚未完全闡明。HSCs對視黃醇的攝取既以游離視黃醇的形式,也以holo-RBP、視黃醇結合蛋白(RBP)和視黃醇的結合形式,后者優先酯化。HSCs的類視黃醇含量也是異質的。原發性HSCs的差異FACS分類(視黃醇自身熒光的分類與膠原促進因子驅動的GFP的表達)揭示了健康肝臟中至少兩個主要亞群,前者是具有較高視黃醇儲存能力的亞群體,而后者是具有更加MFB樣表型的亞群體,表明這些HSCs可能是“啟動”了的,以響應肝臟損傷。在“啟動”HSCs中,與視黃醇分解代謝有關的基因的上調和較小的脂滴揭示了HSC脂質代謝的一些早期變化,這些變化可能發生在體內肝臟損傷情況下。維生素A處理HSCs可以抑制培養活化,并能部分維持qHSC標記的表達,而抑制MFB標記的表達。此外,視黃醇暴露也會導致aHSC部分恢復到靜息狀態。
HSC激活過程中視黃酯水解酶(REHs)從脂滴中釋放REs,有許多潛在的酶密切相關,包括脂肪甘油三酯脂肪酶(ATGL/PNPLA2)、PNPLA3、激素敏感脂肪酶和羧基酯脂肪酶。體外培養研究表明,HSCs釋放視黃醇與RBP或結合蛋白無關,因為抑制蛋白質分泌不能調控視黃醇的分泌。然而,視黃醇分泌的主要方式是HSCs直接將游離視黃醇釋放到血液中還是肝細胞分泌holo-RBP仍有爭議。HSC的激活似乎需要通過自噬丟失脂滴,這可能是促進這種代謝要求的細胞反應的關鍵(Figure 3)。HSC的激活增加了細胞內的REH活性,并隨后引起視黃醇的釋放,而不增加REs的釋放。aHSCs細胞外REH活性的缺乏進一步意味著細胞內水解介導視黃醇丟失。在增加水解酶活性的同時,aHSCs也降低了視黃醇酯化的能力,因為HSC的激活導致LRAT的表達迅速消失。
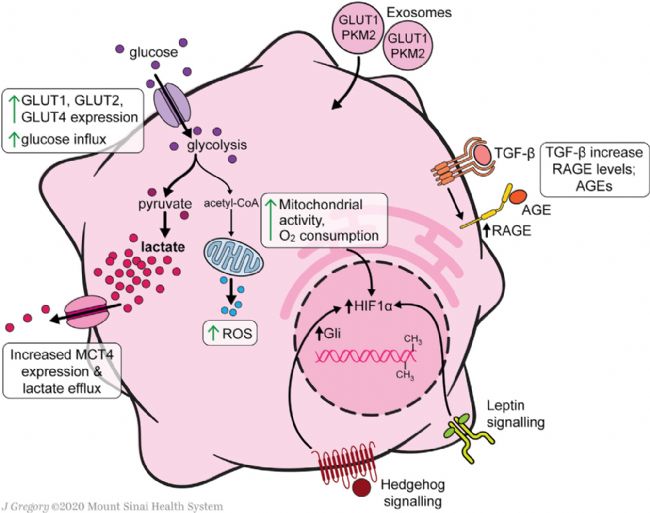
Figure 3. Lipid Metabolism during HSC Activation
成脂表型和脂肪酸
脂肪酸含量和代謝的調節因子控制HSC的激活。過氧化物酶體增殖物激活受體γ(PPAR-γ)和甾醇調節-元素結合蛋白-1(SREBP-1c)是HSC靜息的標志, PPAR-γ和SREBP-1c的異位誘導可以逆轉HSC的激活。脂肪酸為視黃醇在qHSCs中的酯化提供了重要的底物。
HSC激活過程中脂滴被代謝,為氧化提供脂肪酸類物質,在已知的脂肪酸氧化激活劑PPAR-β的控制下產生活化/轉分化的能量。PPAR-γ和SREBP-1c下調是通過激活MAPK/ERK信號級聯來實現的,幾種促纖維化細胞因子之間存在關聯。
在活化的早期階段,最豐富的脂肪酸-棕櫚酸、油酸、棕櫚酸和硬脂酸-達到峰值濃度。活化后期游離脂肪酸總量下降,而花生四烯酸(C20:4)和二十二碳六烯酸(C22:6)相對富集,以及脂肪酸伸長酶(Elovl5, Elovl6)和脫飽和酶(Scd1)上調。HSC脂肪酸含量的總體下降與成脂表型的喪失是一致的。脂肪酸β-氧化是HSCs激活的重要能量來源,因為線粒體脂肪酸分解代謝的抑制阻礙了HSC的激活。
乙酰輔酶A羧化酶(ACC)在HSC激活過程中參與了代謝重編程。通過降低αSMA的表達和膠原的產生,ACC抑制降低了HSC的激活。ACC抑制劑的抗纖維化活性是通過抑制DNL,這是在HSC激活期間誘導糖酵解和氧化磷酸化所必需的。雖然DNL調節HSC代謝的分子機制尚未闡明,但ACC抑制被認為是NASH的一種治療方法,因為它既降低了肝細胞的脂毒性,又抑制了HSC的纖維發生,但ACC在體內的抑制作用尚未直接歸因于其對HSCs的影響。
膽固醇
膽固醇有助于NASH纖維發生的發病機制,因為HSC的激活可以通過游離膽固醇(FC)的積累來誘導。在培養的HSCs中,FC的積累增加了Toll樣受體4(TLR4)的水平,致使HSCs對TGF-β1誘導的激活敏感。HSCs中FC的積累由低密度脂蛋白受體(LDLR)和miR-33a(膽固醇代謝的microRNA調節劑)控制,兩者都在HSC激活過程中將其上調。
谷氨酰胺分解
ECM生成的巨大代謝需求不僅通過碳水化合物和脂質代謝重編程,還通過蛋白質代謝來滿足。比較qHSCs和aHSCs之間差異表達的代謝基因,只有6%的這類基因涉及碳水化合物代謝,38%參與蛋白質代謝,這表現為向谷氨酰胺分解的轉變。谷氨酰胺分解是將谷氨酰胺轉化為α-酮戊二酸,通常發生在癌細胞,活化的HSCs上調了谷氨酰胺酶GLS1的表達水平。
HSCs的谷氨酰胺剝奪可引起脂質積累,增加PPAR-γ的表達,降低膠原蛋白I的表達,這表明谷氨酰胺分解是aHSC的重要能量來源。在體內,HSCs對谷氨酰胺分解標志著活躍的纖維化發生,其細胞特異性拮抗作用通過剝奪細胞中的谷氨酰胺而成為潛在的治療靶點。與谷氨酰胺相比,葡萄糖剝奪沒有抗纖維化作用,盡管aHSCs增加了糖酵解基因的表達和葡萄糖的消耗。
HSC代謝與應激反應的聯系
氧化應激ROS
產生ROS是aHSC的重要特征,因為敲除或抑制產生ROS的酶會抑制HSC的激活。ROS產生的增強與線粒體活性的增加相一致。
幾種典型的HSC激活因子集中于ROS介導的激活,特別是通過NADPH氧化酶的上調(Figure 4)。ROS的產生被認為是纖維化細胞活化的“前饋”機制,特別是通過TGF-β1。氧化還原失衡激活TGF-β1的潛在形式,而TGF-β1信號則產生氧化還原失衡。TGF-β1信號通路上調了幾個NADPH氧化酶-- NOX1、NOX2、NOX4和NOX5,H2O2生成增加,從而提高了膠原的產量。
在胚胎、腎臟和心臟成纖維細胞中進行的研究表明,線粒體ROS的產生增加。此外,線粒體ROS由錳超氧化物歧化酶(Sod2)代謝到H2O2可上調胚胎成纖維細胞基質金屬蛋白酶的轉錄,增加Sod2的活性和MMP-1、MMP-2、MMP-3和MMP-7的表達。相反,內源性大麻素介導的線粒體ROS的增加導致HSC細胞死亡,這與線粒體ROS作為細胞凋亡調節因子的經典作用是一致的。這兩個主要的ROS產生軸的差異調節可能解釋了線粒體ROS更可變的貢獻,而不是NOX酶的最終促進纖維化。
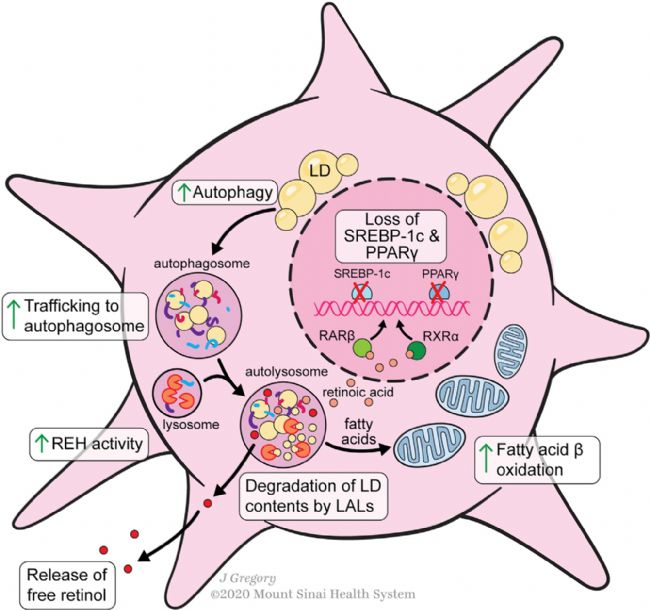
Figure 4. Redox Metabolism in HSC Activation
抗氧化反應
HSCs的內源性抗氧化活性沒有得到很好的表征。在體外,TGF-β1激活的HSCs增加了谷胱甘肽含量,這與培養激活的HSCs的研究是一致的。此外,不同程度的HSC激活對應于不同的氧化還原狀態。在一項利用M1-4HSC細胞系的晚期細胞激活的研究中,TGF-β1促進進一步激活,導致肌成纖維M-HT細胞完全轉分化。在培養中,M1-4HSCs含有較高的細胞內ROS含量,而NOX活性較低。完全轉分化的M-HTs提高了Sod2的活性和谷胱甘肽水平,這可能是抑制ROS誘導的細胞損傷所必需的。此外,增加抗氧化可用性可減輕促纖維化信號如TGF-β1和PDGF的影響,并減少疾病動物模型中的纖維化。
自噬
大自噬(“自噬”)是一種細胞應激反應,參與大分子和細胞器的自溶酶體消化,產生細胞內營養和能量。上述幾種與激活相關的代謝變化集中于自噬細胞,包括脂解的增加、ROS的產生和ER應激。脂滴運動是HSC激活的一個關鍵特征,是由自噬驅動的。早期研究脂滴運動的影響集中在細胞內視黃酯水解后向細胞外釋放游離視黃醇,目前已知水解的一個關鍵結果是釋放游離脂肪酸為細胞激活“供能”。因此,添加內源性油酸可以挽救自噬缺陷的HSCs的激活,而抑制脂肪酸氧化則具有相反的作用。另一方面,由于缺乏卵磷脂-視黃醇酰基轉移酶(LRAT),缺乏脂滴的小鼠HSC仍然可以完全激活,但不會自發激活。
非細胞自主作用的HSC代謝
肝星狀細胞-肝細胞代謝串擾
肝細胞占肝臟內細胞的80%以上,通過交換類視黃醇代謝物和信號方式與HSC代謝相互作用。在HSC激活過程中,HSCs釋放的游離視黃醇被肝細胞以接觸依賴的方式迅速吸收,以holo-RBP的形式進入循環。除了在HSC激活過程中失去類視黃醇,目前尚不清楚維生素A的肝臟代謝是否直接導致肝損傷和纖維化。視黃醇在肝臟中總含量隨人類肝病的進展而下降,在兩種NASH小鼠模型中視黃醇-RBP4耗竭,視黃醇重新分布到肝細胞而不是HSCs。
Hh(Hedgehog)下游的信號通路和瘦素受體結合調節HSCs中的葡萄糖代謝。Hh信號廣泛參與傷口愈合,Hh配體是肝細胞在肝臟損傷過程中產生的。這些配體作用于鄰近的HSCs,通過HIF-1α轉錄因子誘導激活,HIF-1α轉錄因子是能量代謝的主調節因子,可激活大量的靶基因,包括葡萄糖轉運蛋白和糖酵解酶等。
HSCs作為免疫代謝的影響因素
雖然免疫代謝的新概念主要集中在免疫細胞,但HSCs也顯著促進了metainflammation和組織損傷的收斂途徑,特別是在酒精性和非酒精性脂肪性肝炎(NASH)中。通過控制類視黃醇代謝,它們調節肝臟和全身免疫中的免疫細胞功能。星狀細胞產生炎癥介質的反應,包括細胞因子和趨化因子,可以放大肝臟對損傷的反應。
HSCs也被認為是抗原提呈細胞,通過Toll樣受體信號和炎癥小體激活對天然免疫配體作出反應。HSCs與炎癥細胞的相互作用可通過旁分泌信號驅動炎癥和損傷。例如,HSC通過MER-TK受體與巨噬細胞的相互作用有助于實驗性NASH的纖維化,以及與NK、NKT和γδT細胞的串擾。
有幾個例子值得注意:(1)HSCs釋放全反式RA通過誘導精氨酸酶-1和誘導型一氧化氮合酶促進樹突狀細胞的耐受性表型;(2)通過誘導免疫調節分子吲哚胺2,3-雙加氧酶1(IDO1),誘導脂多糖(LPS)對FoxP3+調節性T細胞的增殖,該酶分解色氨酸生成犬尿氨酸。而抑制IDO可以減少培養的HSCs的增殖。(3)不對稱二甲基精氨酸(ADMA)被二甲基氨基水解酶(DDAH)分解代謝,降低了TGFB1介導的原代大鼠HSCs的活化;(4)細菌產物微囊藻毒素-亮氨酸精氨酸酶(MC-LR)可通過Hh信號激活HSCs,給藥可誘導體內肝纖維化。
小結
雖然基于HSCs代謝調節的治療迄今為止是有限的,但闡明其代謝途徑為治療肝病和與肝臟有關的系統性疾病提供了一個的新的潛在靶點。目前一些針對減輕纖維化的代謝途徑的藥物正在進行研究中,包括:(1)膽汁酸,具有抗凋亡和減輕ER應激的特性;(2)FXR激動劑,調節葡萄糖、脂質和膽汁酸的代謝;(3)甲狀腺激素受體-β激動劑可調節脂質和葡萄糖穩態;(4)PPAR激動劑,成脂的主要調節劑;(5)維生素A偶聯用于HSC靶向。
HSCs參與調節碳水化合物、線粒體、脂質和類視黃醇穩態的途徑,在健康和疾病中發揮重要作用。在慢性肝損傷中,HSCs驅動肝纖維化,并與炎癥和癌癥有關。細胞從靜息狀態激活或轉分化,進入增殖的、運動的肌成纖維細胞,分泌細胞外基質,這需要快速適應,包括中心碳代謝重編程、線粒體數量和活性的增強、內質網應激,以及通過自噬依賴的水解細胞質液滴中的視黃酯釋放游離脂肪酸,以滿足更高的能量需求。作為其他組織周皮細胞的原型,對HSC代謝驅動因素和弱點的識別具有針對這些途徑進行治療以增強實質生長和調節修復的潛力。
參考文獻
Parth Trivedi, et al. The Power of Plasticity—Metabolic Regulation of Hepatic Stellate Cells. Cell Metabolism . 2021.
原文閱讀,請長按識別下方二維碼

精彩推薦
3. Cell Metabolism | 腸道菌群相關代謝物--膽汁酸生物學功能
4. Protein&Cell | 膽汁酸替代合成途徑與代謝性疾病
5. 腸·道 | 賈偉:肝病腸治?且看腸道細菌如何對肝病推波助瀾!
6. Cell子刊 | 癌細胞并不孤單--腫瘤微環境中的代謝通信
7. CRIT REV FOOD SCI︱腸道微生物群與脂溶性維生素






