利用單細胞轉(zhuǎn)錄組揭示胰腺癌免疫微環(huán)境機制

胰腺癌(PDA)是一種致命的惡性腫瘤,5年生存率為11%。由于胰腺癌中存在廣泛的腫瘤微環(huán)境(TME),即便使用最新的免疫療法,患者的最終治愈率依然低下。先前的報道顯示,胰導管腺癌的發(fā)生與WNT信號的激活有關(guān),但是信號通路的激活與腫瘤微環(huán)境之間的調(diào)控關(guān)系尚不清楚。來自美國密歇根大學的研究團隊在Journal of Experimental Medicine(IF 17.579)上發(fā)表題為“WNT signaling in the tumor microenvironment promotes immunosuppression in murine pancreatic cancer”的文章。該文章應(yīng)用單細胞轉(zhuǎn)錄組測序技術(shù)對胰腺癌樣本進行檢測,系統(tǒng)的解析了表達Tcf7的CD4+T細胞通過調(diào)控腫瘤微環(huán)境的改變,引起PD-L1+細胞的代償性增加。然后,作者在動物模型中,使用WNT信號抑制劑聯(lián)合靶向PD-L1治療方案,成功降低了胰腺癌的生長。這一研究成果也為臨床治療胰腺癌提供了新的指導方案。

研究材料
16個樣本的PDA患者單細胞轉(zhuǎn)錄組數(shù)據(jù)集(PDA組織和配對的血液樣本)
3個樣本的小鼠的單細胞轉(zhuǎn)錄組(組織樣本)
技術(shù)路線
步驟1:單細胞轉(zhuǎn)錄組驗證了Tcf7在人和小鼠PDA的CD4+ T細胞中的保守性;
步驟2:敲除Tcf7可以通過抑制CD4+T細胞的免疫功能改變腫瘤微環(huán)境;
步驟3:敲除Tcf7可以調(diào)控PD-L1+髓細胞細胞代償性的增加;
步驟4:實驗驗證了抑制WNT信號通路對PDA的治療效果。
研究結(jié)果
1. 單細胞轉(zhuǎn)錄組驗證了Tcf7在人和小鼠PDA的CD4+ T細胞中的保守性
為了了解WNT通路在胰腺中的表達情況,作者選擇了課題組先前發(fā)表的臨床PDA組織的單細胞數(shù)據(jù)集進行分析。然后在單細胞的結(jié)果上展示了WNT通路中基因的表達水平,結(jié)果顯示Tcf7基因(編碼TCF1蛋白)在CD4+T細胞中表達量最高。并且在這16個PDA患者配對的PBMC樣本中展示出了同樣的現(xiàn)象。為了確定Tcf7的表達模式具有物種保守性,作者又選擇了3只小鼠(healthy=2,mPDA=1)進行單細胞測序,通過數(shù)據(jù)分析共鑒定出了15種細胞類型。進一步分析顯示,相比較健康的小鼠,Tcf7基因在mPDA模型CD4+T細胞中表達的水平更高。這一結(jié)果與患者樣本的單細胞數(shù)據(jù)結(jié)果相吻合。
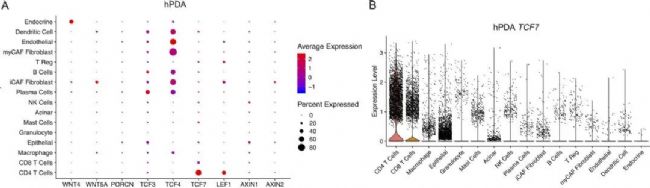
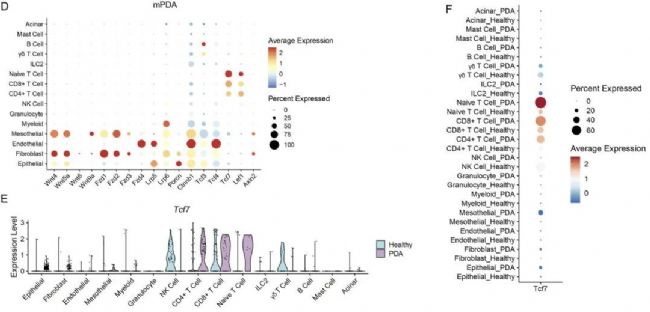
圖1 Tcf7在人和小鼠PDA的CD4+ T細胞中普遍存在
2. 敲除Tcf7可以通過抑制CD4+T細胞的免疫功能改變腫瘤微環(huán)境
TCF1最初被認為是T淋巴細胞特異性轉(zhuǎn)錄因子,在T細胞的發(fā)育和分化中起著關(guān)鍵作用。因此,基于單細胞的數(shù)據(jù)分析結(jié)果,作者設(shè)想TCF1在PDA中具有調(diào)節(jié)CD4+ T細胞的免疫抑制功能。接下來,作者設(shè)計了Tcf7敲除模型。經(jīng)過一段時間培養(yǎng)后,發(fā)現(xiàn)敲除小鼠的腫瘤生長顯著降低。通過IHC和流式分選等實驗進一步驗證了CD4+ T細胞的免疫抑制功能可能由TCF1介導。上述的實驗結(jié)果顯示出了Tcf7在調(diào)控CD4+T細胞改變腫瘤微環(huán)境的重要作用。
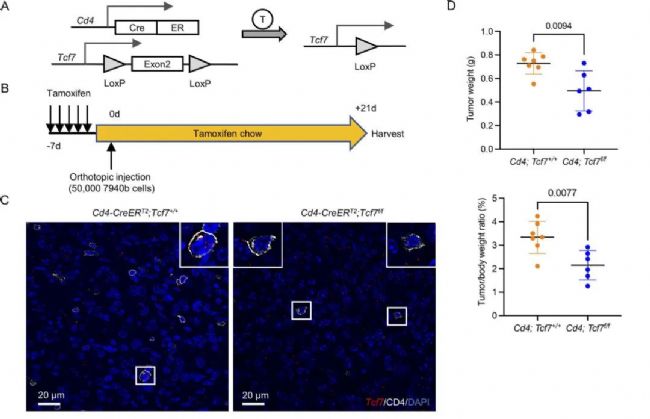
圖2 CD4+ T細胞中的TCF1信號通路介導其免疫抑制潛能
接下來,作者設(shè)計了對應(yīng)的Tcf7敲除模型小鼠進行單細胞測序。分析結(jié)果顯示Tcf7在CD4+T細胞中的表達水平最高。為了探索Tcf7失活后T細胞的變化,作者對Cd3e表達細胞進行了亞群再聚類分析,并確定了11個不同的cluster。進一步的比較分析顯示了在Tcf7缺失模型組中,Treg細胞顯著減少,而Th17細胞顯著增加。隨后,作者通過實驗驗證了這一結(jié)論,從而,揭示了Tcf7的失活抑制Treg細胞分化,促進Th17細胞分化的作用。
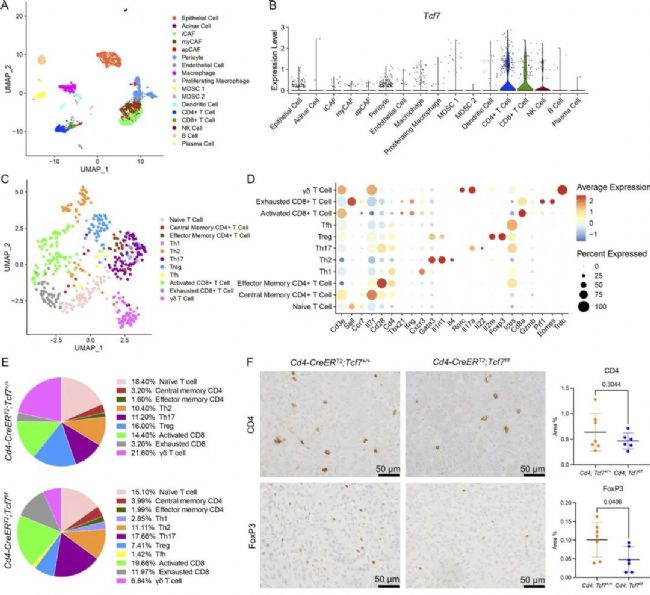
圖3 CD4+ T細胞中的TCF1信號通路促進PDA中的Treg分化
3. 敲除Tcf7可以調(diào)控PD-L1+髓細胞細胞代償性的增加
接下來,為了確定CD4+ T細胞中Tcf7的失活是否改變了PDA TME中髓系細胞的組成,作者對髓系細胞進行了亞群再聚類,共鑒定出6種細胞類型,發(fā)現(xiàn)不同的細胞在兩組模型中的變化顯著。然后作者研究了髓系細胞免疫抑制的潛力,然而不同的髓系細胞亞群在兩組間的Cd274(PD-L1)表達水平相似,但是Arg1和Nos2的表達水平在敲除組中更高。這些結(jié)果提示了敲除Tcf7導致了免疫抑制表型增強。這一結(jié)果與作者之前觀測到的結(jié)果相吻合。隨后,作者通過質(zhì)譜流(CyTOF)技術(shù)再次驗證了這一結(jié)果,同時發(fā)現(xiàn)在CyTOF的結(jié)果中,Tcf7敲除組的PD-L1的髓系細胞數(shù)量增加。因此,作者推測PD-L1+細胞的增加是否可以作為治療胰腺癌的靶點。
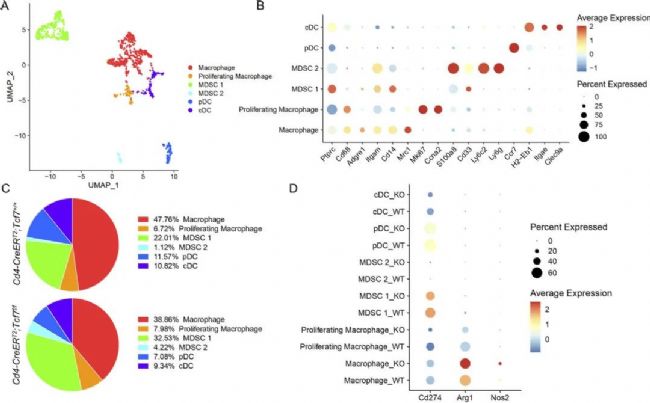
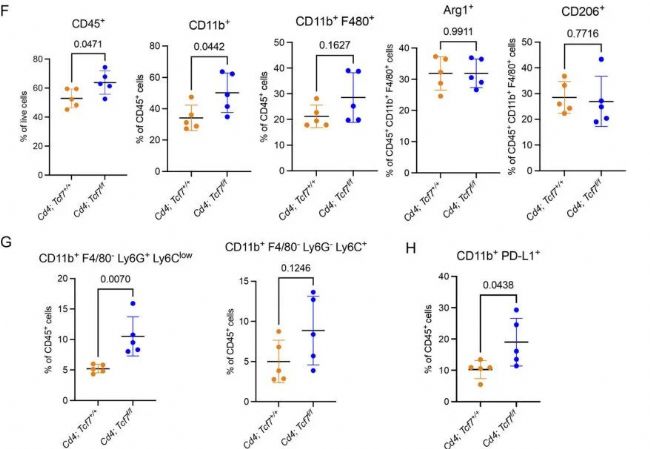
圖4 CD4+ T細胞中TCF1的缺失導致MDSCs的代償性增加
先前的報道顯示,在一些腫瘤中存在IL-17與PD-L1的表達相關(guān)。因此,作者在骨髓來源的髓系前體細胞(BMDMs)上測試了IL-17是否調(diào)節(jié)PD-L1的表達。結(jié)果發(fā)現(xiàn),IL-17A會導致Cd274、Arg1和Nos2的高表達。然而這一結(jié)果卻沒能在PDA模型的細胞系中重現(xiàn)。隨后,作者設(shè)計了細胞共培養(yǎng)實驗,證實了TCF1缺失的CD4+ T細胞能夠誘導腫瘤細胞中PD-L1的表達。
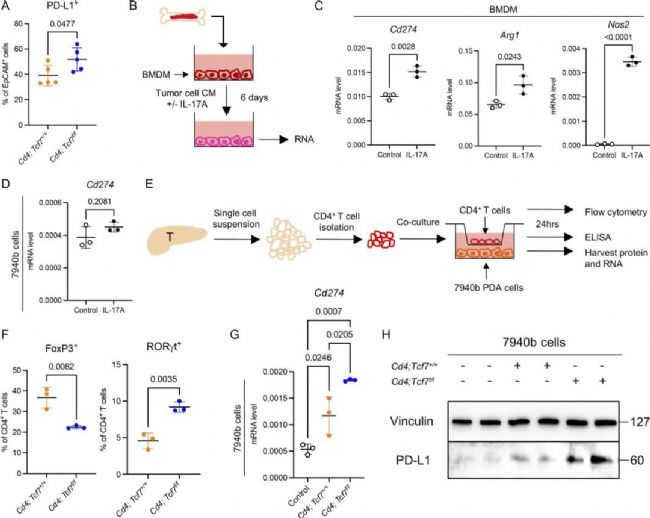
圖5 CD4+ T細胞中TCF1的缺失驅(qū)動髓細胞和腫瘤細胞中PD-L1的表達
4. 實驗驗證了抑制WNT信號對PDA的治療效果
作者先前的數(shù)據(jù)表明了WNT通路在上皮細胞中參與對腫瘤的支持作用。作者設(shè)計使用能夠抑制WNT信號通路的PORCN抑制劑(PORCNi),將小鼠隨機分為對照組或PORCNi組。結(jié)果發(fā)現(xiàn)PORCNi治療后的小鼠腫瘤更小。然后,作者通過流式細胞術(shù)評估了WNT信號的抑制作用是否改變了腫瘤的微環(huán)境。結(jié)果觀察到在PORCNi治療后的小鼠中Total T細胞和CD8+ T細胞浸潤的增加。隨后,作者又通過抗CD8和抗PD-L1進行功能驗證,發(fā)現(xiàn)抑制WNT信號可以使PDA對PD-L1阻斷敏感,表明聯(lián)合靶向可以降低胰腺癌的生長,并可能有益于胰腺癌的治療。
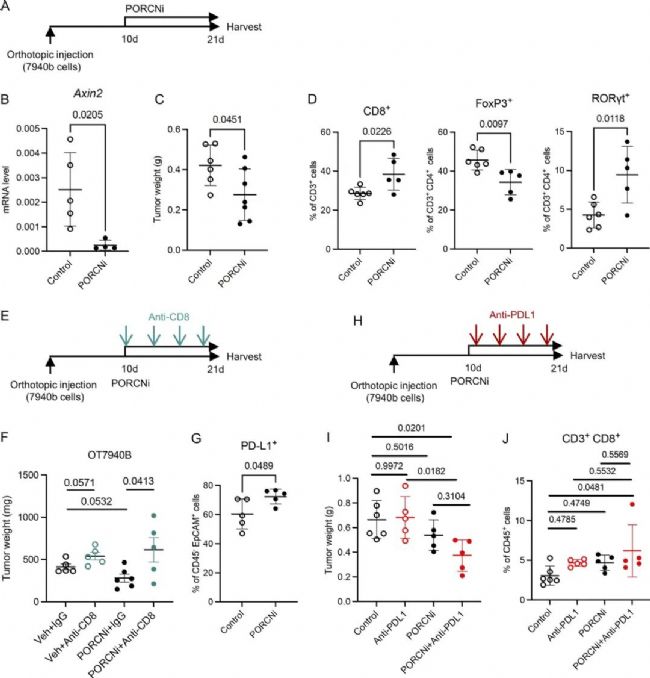
圖6 抑制WNT信號可以提高了PD-L1阻斷的療效
小編小結(jié)
作者在先前大量的研究中報道了WNT信號在上皮細胞和CD4+ T細胞中具有活性,并有助于阻斷CD8+ T細胞的抗腫瘤活性。因此,在本次研究內(nèi)容中,作者采用單細胞轉(zhuǎn)錄組測序技術(shù)對PDA患者和模型小鼠的胰腺癌腫瘤組織進行檢測,詳細的描述了CD4+ T細胞中Tcf7的失活以特異性的方式抑制WNT信號,從而激活 CD8+ T細胞效應(yīng)功能來抑制腫瘤進展。但是表達PD-L1的腫瘤細胞和髓系細胞的數(shù)量也得到代償性增加。通過藥物抑制在腫瘤細胞和CD4+ T細胞中抑制WNT信號,聯(lián)合PD-L1治療可以有效抑制腫瘤生長。這一研究成果或許可以為胰腺癌的臨床治療提供新的解決方案。
中科優(yōu)品推薦
【中科新生命】重點布局單細胞多組學平臺,先后建立了基于10x Genomics 最新Chromium X的單細胞轉(zhuǎn)錄組測序平臺以及“一站式”單細胞蛋白質(zhì)組服務(wù)平臺。其中,Chromium X作為當前業(yè)內(nèi)通量最高的單細胞測序平臺之一,可以實現(xiàn)百萬級細胞通量檢測,為大規(guī)模單細胞圖譜、高通量藥物篩選、稀有細胞鑒定分析等需求提供助力。





