NEPA21助力:anti-EpCAM CAR-T 細胞有效地抑制腹膜腫瘤的病情發展

腹膜轉移癌(PC)是癌細胞經血路腹膜轉移或腹膜直接種植生長所致。多繼發于腹腔內肝、胃、結腸、胰腺和卵巢、子宮的癌腫和腹膜后的惡性腫瘤,也可繼發于肺、腦、骨骼、鼻咽部的腫瘤以及皮膚黑色素瘤等。患者病情發展快、預后性差。近年來發展的利用基因改造技術表達腫瘤特異性嵌合抗原受體(chimeric antigen receptor,CAR)的T細胞顯示出的靶向性、殺傷活性和持久性,或許將為腹膜轉移癌的治療注入了新方案。
CAR-T治療中的細胞基因改造環節,主要有依靠病毒的轉導和非病毒載體的轉染兩種技術路線。值得關注的是,由于病毒載體生產的工藝復雜性和低效率,以及由于病毒載體具有潛在的致病性,所以要求更嚴格的質量控制和安全性檢測,這些因素都導致病毒轉導的環節的成本較高,在CAR-T生產的總成本中占重要比重。提高病毒載體的生產效率和規模會有助于解決這一成本瓶頸,而現今也有用戶在嘗試另一種解決方案——即,采用非病毒載體的基因轉染技術。研究者認為,非病毒的轉染技術可以大大簡化了病毒載體相關的供應鏈限制和成本負擔,相關的技術有轉座子/轉座子酶系統(Transposon/transposase system)、基因編輯技術如 ZFN, TALENs, and CRISPR/Cas9 等。使用電轉染(electroporation)系統可以有助于提高此類非病毒載體的轉染效率,從而降低基因改造環節的復雜性和成本,是非常值得嘗試的事情。
2017年1月10日在OncoTarget發表一篇文章,“Intraperitoneal immunotherapy with T cells stably and transiently expressing anti-EpCAM CAR in xenograft models of peritoneal carcinomatosis”,描述了一種治療終末期PC的嵌合抗原受體T(CAR-T)細胞療法,為腫瘤的臨床實驗提供新視角。
研究者利用4D5MOC-B單鏈可變片段構建了EpCAM特異性的第三代CAR。文章中,作者嘗試了基于mRNA電穿孔的技術,獲得 抗EpCAM CAR-T細胞。研究發現,“將mRNA導入具有抗EpCAM CAR瞬時表達的T細胞中可延遲荷瘤小鼠的疾病進展。通過腹膜移植于小鼠(16天前接種的腫瘤細胞)中也觀察到了良好的治療效果。這一發現提示了通過定期重復注射轉染了EpCAM靶向CAR的mRNA的T細胞來減少癌癥患者疾病是一種有趣的治療方法,該方法很有吸引力。” 作者認為,這項療法可能被用于治療晚期PC,但目前實驗只是在小鼠身上取得了初步成功,該項技術是否安全、有效,值得臨床前和臨床進一步評價。
本實驗中研究者們使用了NEPA21 電轉系統:

文中表明,“經GFP mRNA優化后,用mRNA電穿孔的人T細胞轉染效率為97%(圖A)。用MgFP RNA載體對T細胞進行電穿孔,轉染效率為79%(圖A)。然后用流式細胞儀分析,用Fc特異性抗體檢測編碼抗EpCAM CAR的mRNA在人T細胞中的表達,表達量高達68.5%(圖 B)。
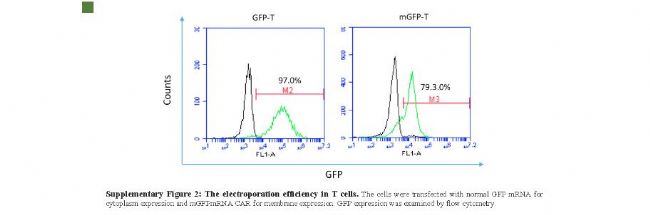
(A) The electroporation efficiency in T cells. The cells were transfected with normal GFP mRNA for cytoplasm expression and mGFPmRNA CFP expression was examined by flow cytometry.
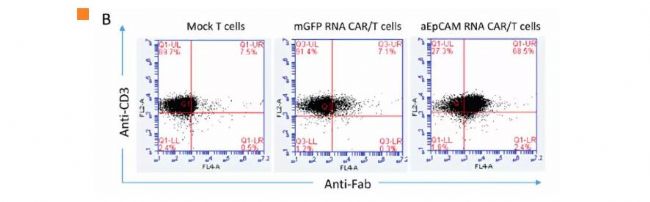
(B) Flow cytometric analysis to examine anti- EpCAM CAR expression on T cells after electroporation. The cells were collected 24 hours after electroporation for analysis.

NEPA21讓轉染更簡單、更Free
NEPA21高效基因轉染系統可實現懸浮細胞、貼壁細胞、受精卵、活體動物及離體組織器官的高效轉染,包括鼠、兔、魚、爪蟾\蝌蚪、蜜蜂、蟋蟀、蠶、水蚤、渦蟲等各種活體及受精卵胚胎的轉染,還可以用于植物種子、微藻等的電轉化。配合獨有的電壓衰減(Voltage Decay)設計,在獲得高轉染效率的同時,提高細胞存活率。
摘錄文獻

END





