小鼠模型在揭示免疫檢查點LAG3新機制中的應用,為精準治療提供新策略
3月17日,上海科技大學生命科學與技術學院王皞鵬課題組聯合中國科學院分子細胞科學卓越創新中心許琛琦課題組、美國匹茲堡大學醫學院Dario Vignali課題組、北京大學腫瘤醫院孔燕課題組及百濟神州沈志榮團隊,在國際頂尖學術期刊Cell雜志在線發表了題為“Ligand-Induced Ubiquitination Unleashes LAG3 Immune Checkpoint Function by Hindering Membrane Sequestration of Signaling Motifs”的最新研究論文。該研究首次解析了免疫檢查點LAG3受體激活的分子開關機制,并開發了基于功能性生物標志物的療效預測體系,為靶向免疫檢查點的精準治療提供了新策略。
南模生物為該研究提供了LAG3-KO(目錄號:NM-KO-18048)和LAG3K490R小鼠。
LAG3作為一種免疫檢查點受體,在調節T細胞活化和抗腫瘤免疫方面發揮著關鍵作用。據報道,多個配體與LAG3相互作用,包括MHC II類和FGL1,前者在抗原呈遞細胞上表達,后者分別由肝細胞和某些類型的腫瘤細胞分泌。當與配體結合時,LAG3會抑制T細胞活化、細胞因子生成和增殖,從而促進腫瘤免疫逃逸。
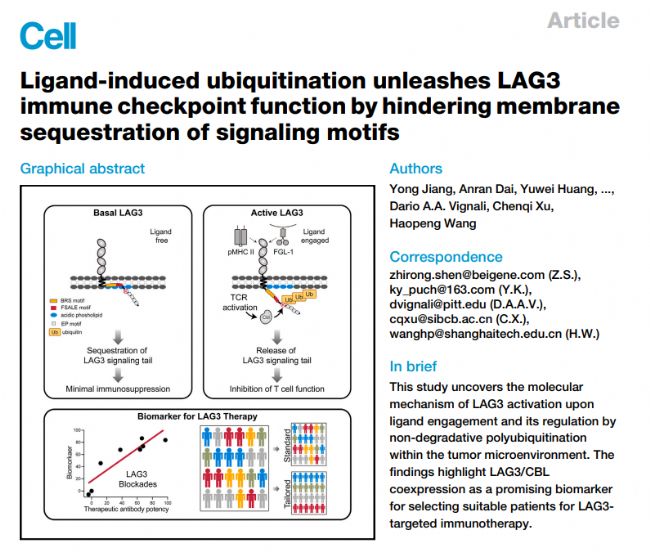
1 在T細胞激活過程中,MHC II類介導的配體結合會引發LAG3快速泛素化
作者利用T細胞-APC共培養系統,將人LAG3異位表達于Jurkat T細胞,與表達MHC II的Raji B細胞共培養并激活TCR。質譜分析結果顯示,激活的T細胞中 LAG3的498位點賴氨酸發生泛素化,而靜止T細胞中未檢測到。進一步研究表明,與MHC II結合缺陷的突變體LAG3P115A不能發生泛素化,阻斷LAG3與MHC II結合的relatlimab也能完全抑制LAG3泛素化,以上結果證明LAG3泛素化依賴于配體結合。此外,作者利用LAG3K490R小鼠(由南模生物提供)(LAG3的490位賴氨酸突變為精氨酸,相當于人類的K498位點)證實了在小鼠CD4和CD8初級T細胞中,抗原刺激同樣會使LAG3 大量泛素化,且 K490是關鍵的泛素化位點。
以上結果表明,在T細胞活化過程中,MHC II類結合會觸發位于LAG3胞質尾中部的保守賴氨酸殘基快速泛素化。
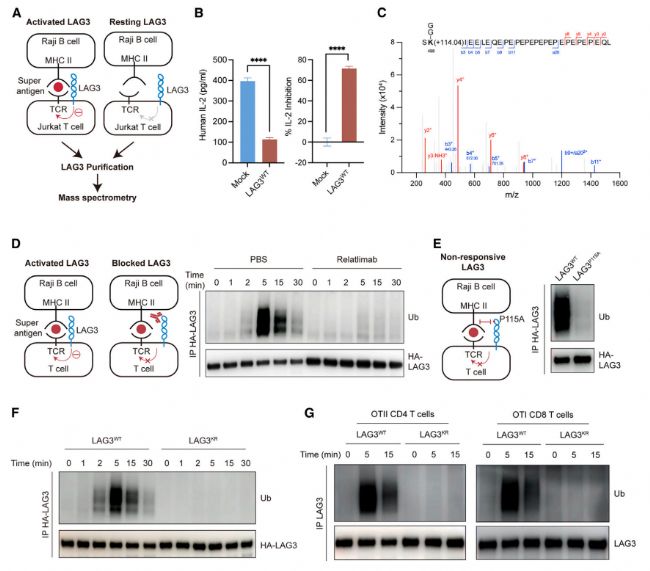
Fig1. 配體結合誘導LAG3的快速泛素化。
2 抗原呈遞細胞上的膜結合型FGL1(而非可溶性FGL1)誘導LAG3泛素化
FGL1作為LAG3配體仍存在爭議,為明確FGL1是否可作為誘導LAG3泛素化的配體,作者首先通過刺激OTI T細胞上調內源性LAG3表達。為獲得在無LAG3配體的條件下激活OTI CD8+ T細胞,作者選用高表達MHC I類分子但不表達MHC II類分子的DC2.4細胞系作為抗原呈遞細胞(APCs),并構建了表達MHC II類分子(I-Ab DC2.4)的DC2.4細胞系。結果顯示,與MHC II類分子相比,FGL1-Fc蛋白誘導的LAG3泛素化較弱,提示FGL1-Fc在此條件下可作為LAG3的弱激動劑,且這種泛素化依賴于膜結合。此外,FGL-Fc能夠以LAG3依賴的方式抑制IL-2的分泌。這些結果共同表明,FGL1需要以膜結合形式存在于APC表面才能作為功能性LAG3配體發揮作用。
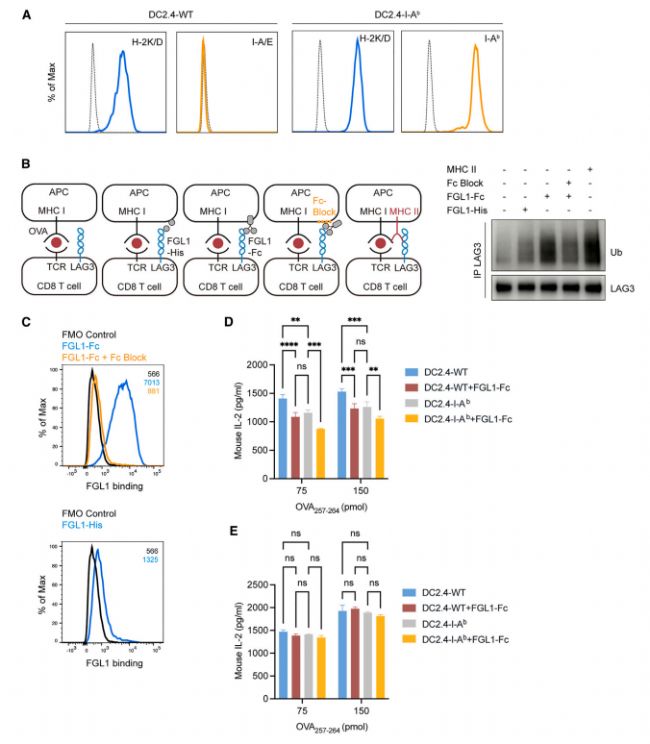
Fig2. 膜結合型而非可溶性FGL1觸發LAG3的泛素化。
3 LAG3泛素化不會導致蛋白質降解,反而會增強LAG3的功能
為探究泛素化修飾對LAG3蛋白穩定性的影響,作者比較了野生型(LAG3WT)與泛素化位點突變型(LAG3KR)小鼠T細胞在活化過程中LAG3的表達動態。結果表明,LAG3WT與LAG3KR的LAG3蛋白表達水平無顯著差異。進一步采用蛋白質合成抑制劑放線菌酮(CHX)阻斷新蛋白合成后,無論處于靜息狀態或活化狀態,LAG3WT與LAG3KR蛋白的半衰期均相似。以上結果表明,LAG3的泛素化修飾并不參與其蛋白降解調控。
鑒于不同類型多聚泛素化介導的生物學功能具有差異,作者首先確定了LAG3特異性泛素化鏈類型。質譜分析發現主要存在K48、K63及非經典K11連接型泛素鏈。進一步分析發現LAG3活化后主要發生非K48連接型、非降解性多聚泛素化(與蛋白酶體降解相關的泛素化為K48)。
同時,作者發現Relatlimab(阻斷LAG3介導的T細胞活化負調控)可完全抑制LAG3泛素化,提示泛素化可能調控其抑制功能,且在Jurkat T細胞-Raji細胞共培養體系中,Relatlimab可逆轉LAG3對IL-2分泌的抑制作用。此外,LAG3KR突變體(無法發生泛素化)幾乎失去抑制活性。綜上,泛素化通過非降解途徑正向調控LAG3的免疫抑制功能。
Fig3. 泛素化以不依賴于蛋白質降解的方式調控LAG3功能。
4 Cbl家族E3泛素連接酶介導LAG3的泛素化
為了探究參與LAG3泛素化的E3連接酶,研究人員采用TurboID標記技術,發現c-Cbl和Cbl-b可能是介導LAG3泛素化的關鍵E3連接酶。作者進一步構建了c-CbI和CbI-b單敲除及雙敲除的Jurkat T細胞模型,結果發現,單獨敲除c-Cbl或Cbl-b均無法阻斷LAG3泛素化,LAG3功能仍保留;而雙敲除細胞中LAG3泛素化完全消失,喪失抑制活性;進一步在雙敲除Jurkat細胞中回補c-Cbl或Cbl-b,可顯著恢復LAG3泛素化及其功能。這些結果表明,Cbl家族連接酶通過介導LAG3泛素化正向調控其免疫抑制功能。
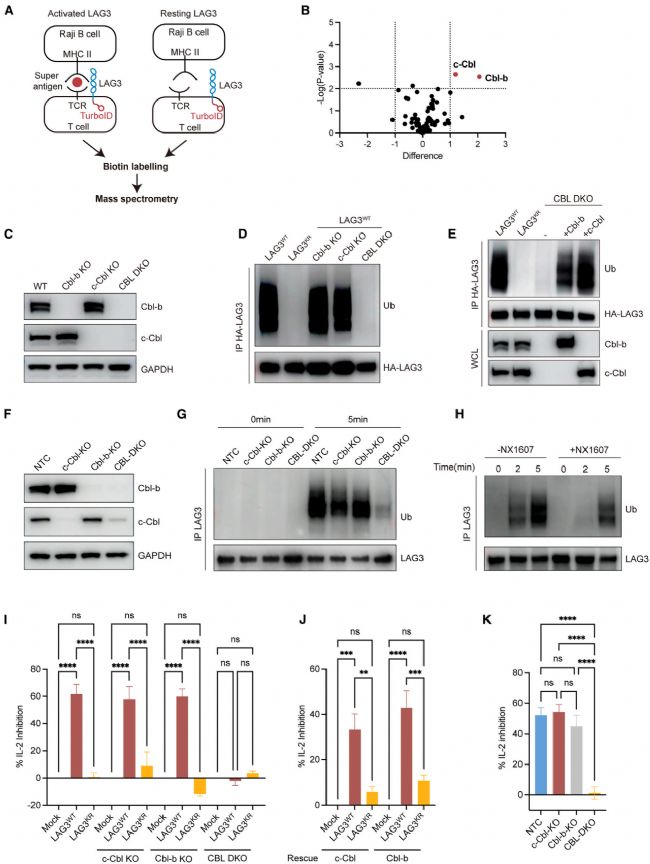
Fig4. Cbl-b和c-Cbl介導LAG3的泛素化及其抑制功能。
5 LAG3 泛素化通過阻礙膜結合釋放抑制信號
為進一步明確泛素化調控LAG3功能的分子機制。作者首先對LAG3進行了序列分析,結果顯示,LAG3的近膜段存在一個進化保守的堿性殘基富集序列(BRS)基序。作者推測LAG3的BRS基序可能通過膜結合限制FSALE基序的可及性。為驗證這一推測,作者使用多種生物物理測定方法,證實了LAG3-NCR和LAG3-FL能與模擬細胞膜的PMLC結合,且 FSALE 基序插入到膜雙層的疏水內部。而LAG3泛素化可有效破壞這種相互作用,使FSALE基序暴露,從而激活LAG3信號傳導。
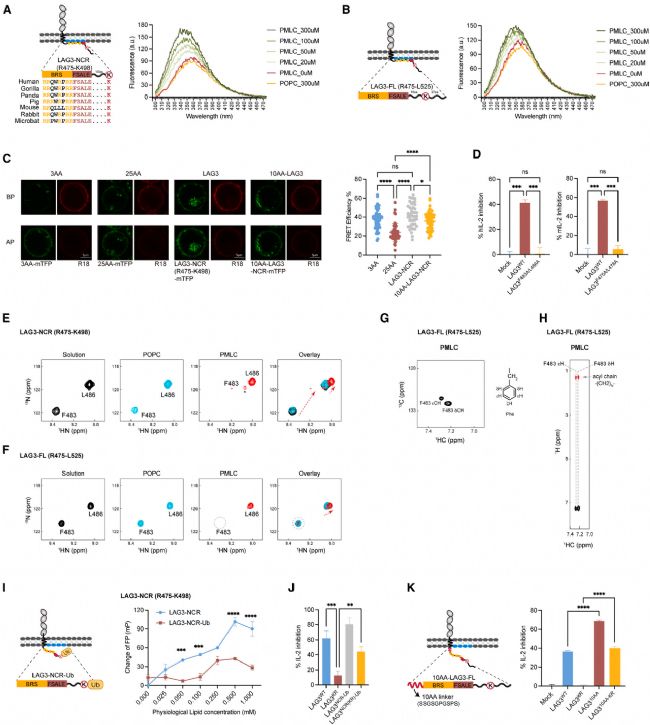
Fig5. LAG3信號尾部嵌入細胞膜,經Ub修飾后釋放。
6 LAG3 泛素化通過阻礙膜結合釋放抑制信號
為探究LAG3泛素化在體內抗腫瘤免疫中的作用,作者通過檢測 LAG3KR小鼠(LAG3泛素化缺陷)的T細胞功能,發現其在體外對T細胞激活和功能的抑制作用受損,產生的細胞因子增多,T細胞增殖抑制能力下降。體內實驗中,作者在LAG3WT、LAG3KR及LAG3KO小鼠皮下接種MC38結腸癌,聯合PD-1阻斷治療。結果顯示,相較于LAG3WT小鼠,LAG3KR小鼠腫瘤進展顯著減緩,生存率顯著提高,產生干擾素γ(IFN-γ)的T細胞比例顯著增多,這一結果與LAG3KO相似。以上結果表明,LAG3泛素化在體內對LAG3介導的抗腫瘤免疫抑制起著關鍵作用。
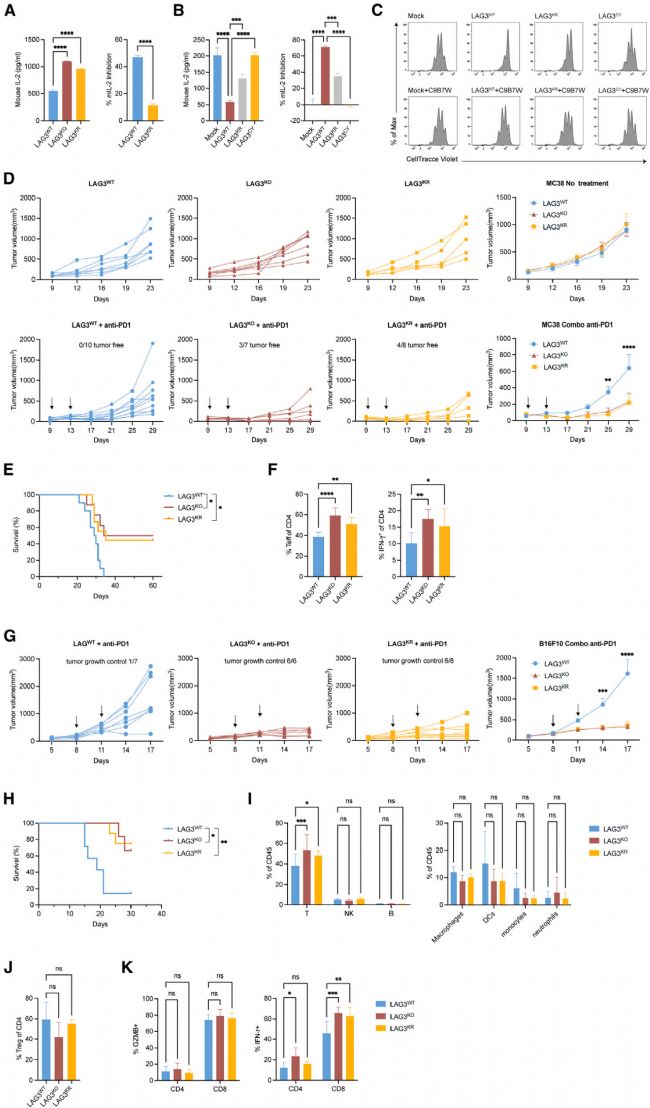
Fig6. LAG3泛素化在LAG3介導的抗腫瘤免疫抑制中的關鍵作用。
目前,已有超過20種靶向LAG3的治療藥物進入研發階段,包括用于癌癥免疫治療的阻斷抗體及針對自身免疫性疾病和炎癥性疾病的激動劑。作者推測LAG3泛素化可作為其信號活性的分子標志物,為評估靶向LAG3的藥物提供便利。為驗證這一假說,作者檢測了7種已進入臨床試驗的LAG3阻斷抗體。結果表明,所有抗體均顯著抑制LAG3泛素化,而同型對照抗體或僅結合LAG3但不阻斷其功能的對照抗體對泛素化水平影響甚微。此外,我們測定了這些抗體阻斷LAG3功能的半數有效濃度(EC50),并發現其增強IL-2分泌的能力與抑制LAG3泛素化的效力呈顯著正相關。這些結果表明,LAG3泛素化可作為功能性生物標志物,指導靶向LAG3藥物的開發與優化。
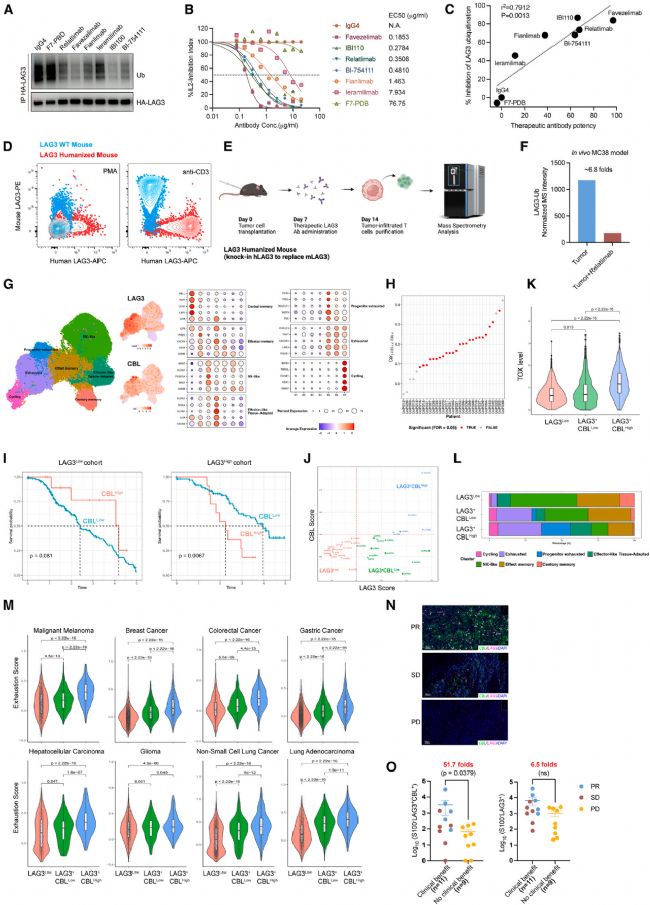
Fig7. LAG3泛素化作為癌癥免疫治療中的潛在生物標志物。
總的來說,這項研究揭示了LAG3與配體結合后的蛋白質翻譯后修飾(PTM),發現配體誘導的泛素化不僅可作為 LAG3信號傳導的指標,還充當LAG3功能的分子開關。在沒有配體的情況下,LAG3主要通過暴露的EP基序發揮其抑制作用,而FSALE基序則與細胞膜結合而被隔離。在與配體結合后,LAG3在E3泛素化連接酶Cbl介導的 KIEELE 基序內迅速發生泛素化,使FSALE從細胞膜上釋放,從而實現LAG3的功能。
這項研究揭示了一種具有轉化潛力的癌癥免疫治療中的免疫檢查點觸發機制,并開發了可預測LAG3治療效果的新型生物標志物,為腫瘤免疫的精準治療提供了新策略。
南模生物擁有經驗豐富的模型定制團隊,可為客戶定制敲除、條件性敲除、點突變、人源化、敲入等多種類型的基因編輯小鼠。此外,南模生物擁有含上萬種成品小鼠的模型資源庫,基本覆蓋熱門基因的敲除/條件性敲除小鼠、免疫缺陷小鼠、靶點人源化小鼠、自發疾病小鼠、Cre/Dre 工具鼠、熒光示蹤小鼠等。
若您有相關需求,歡迎撥打400-728-0660熱線,或通過南模生物微信公眾號在線咨詢。我們的專業團隊將竭誠為您服務!
關于我們
上海南方模式生物科技股份有限公司(Shanghai Model Organisms Center, Inc.,簡稱"南模生物"),成立于2000年9月,是一家上交所科創板上市高科技生物公司(股票代碼:688265),始終以編輯基因、解碼生命為己任,專注于模式生物領域,打造了以基因修飾動物模型研發為核心,涵蓋多物種模型構建、飼養繁育、表型分析、藥物臨床前評價等多個技術平臺,致力于為全球高校、科研院所、制藥企業等客戶提供全方位、一體化的基因修飾動物模型產品解決方案。





