RNA-BS揭示NONO蛋白通過調控mRNA的m5C修飾和可變剪切促進醫學進展
RNA修飾如N6-甲基腺苷(m6A)和5-甲基胞嘧啶(m5C)在基因調控中發揮重要作用。m5C修飾不僅存在于核糖體RNA和轉運RNA中,也在信使RNA(mRNA)中被檢測到,主要通過NSUN2催化,影響mRNA的穩定性和翻譯效率。而PTEN是一個關鍵的腫瘤抑制基因(tumor suppressor genes,TSG),其表達受到轉錄、翻譯和后翻譯水平的調控。PTEN的可變剪切(alternative splicing,AS)在癌癥中被廣泛研究,但其調控機制尚不清楚。盡管已有研究關注m5C修飾對癌基因mRNA的影響,但對于其對腫瘤抑制基因(TSG)mRNA的影響及其調控機制知之甚少。
近日,西南大學資源昆蟲高效養殖與利用全國重點實驗室趙蓋超博士等為第一作者,西南大學資源昆蟲高效養殖與利用全國重點實驗室崔紅娟教授和廣西醫科大學Liping Zhong為共同通訊,揭示了在胃癌(GC)中,RNA結合蛋白NONO通過m5C修飾和可變剪切(AS)調控PTEN mRNA表達,進而影響胃癌進展。研究通過分析m5C RNA甲基化測序(RNA-BS)、轉錄組測序(RNA-seq)等分析,揭示了NONO在胃癌中的作用機制,并提出了一個新的腫瘤抑制基因失活機制,即通過m5C修飾和相關的可變剪切介導調控。相關研究成果以《NONO regulates m5C modification and alternative splicing of PTEN mRNAs to drive gastric cancer progression》為題發表于《Journal of Experimental & Clinical Cancer Research》期刊。

標題:NONO regulates m5C modification and alternative splicing of PTEN mRNAs to drive gastric cancer progression(NONO調控PTEN mRNA的m5C修飾和可變剪切以驅動胃癌進展)
期刊:Journal of Experimental & Clinical Cancer Research
影響因子:IF11.4/Q1
技術平臺:RNA-BisSeq(RNA-BS)、RNA-seq等
本研究分析了胃癌的組織微陣列(tissue microarrays)和轉錄組數據,重點關注RNA剪切和m5C調控因子。為了揭示NONO在胃癌(GC)中的作用,研究采用了RNA測序(RNA-seq)、m5C測序(RNA-Bis-Seq)、RNA免疫沉淀、RNA原位雜交以及NONO敲低細胞的Minigene報告基因分析。研究還利用CDX模型和人類組織微陣列驗證了其臨床相關性。
對公開數據集的分析以及包含40例胃癌組織的組織微陣列的免疫組化檢測顯示,NONO在胃癌中表達上調,并且與不良預后相關。體外和體內實驗表明,NONO在胃癌細胞增殖、遷移和侵襲方面具有正向調控作用。在機制上,NONO直接與PTEN pre-mRNA互作,并通過RNA識別基序(RNA-recognition motif,RRM)結構域招募RNA m5C甲基轉移酶NSUN2,從而改變PTEN pre-mRNA的mRNA甲基化模式。通過臨床前實驗和臨床數據進一步證實了NONO/NSUN2/PTEN軸在胃癌進展中的致癌作用。
本研究揭示了NONO以m5C依賴性方式調控PTEN mRNA的可變剪切,導致胃癌中PTEN表達下調。闡明了NONO通過m5C修飾和相關可變剪切介導腫瘤抑制基因失活的新機制。
研究方法
細胞培養與轉染:使用多種胃癌細胞系(MKN-45、HGC-27、SGC-7901、BGC-823、MGC-803)、正常胃上皮細胞(GES-1)和人源胃癌細胞(GC-1)進行實驗,通過慢病毒轉染系統構建NONO敲低細胞系。
動物實驗:通過皮下注射和尾靜脈注射的方式,將GC細胞移植到裸鼠體內,觀察腫瘤生長和肺轉移情況。
RNA測序與分析:通過RNA測序(RNA-Seq)分析NONO敲低對胃癌細胞轉錄組的影響,鑒定差異表達基因和可變剪切事件。
RNA-BisSeq(RNA-BS):用于分析m5C修飾模式的變化,通過RNA-BS測序技術,研究NONO對PTEN mRNA m5C修飾的影響。
免疫共沉淀與RNA免疫沉淀:驗證NONO與NSUN2的相互作用,以及它們對PTEN mRNA的結合情況。
Minigene報告基因分析:通過構建包含PTEN外顯子5、內含子5和外顯子6的Minigene報告基因,研究NONO對PTEN可變剪切的影響。
結果圖形
(1)NONO在癌癥中作為癌基因和PI3K-AKT信號調控因子
通過對TCGA數據庫和組織微陣列的數據分析,結果表明NONO在胃癌組織中高表達,并與不良預后相關。
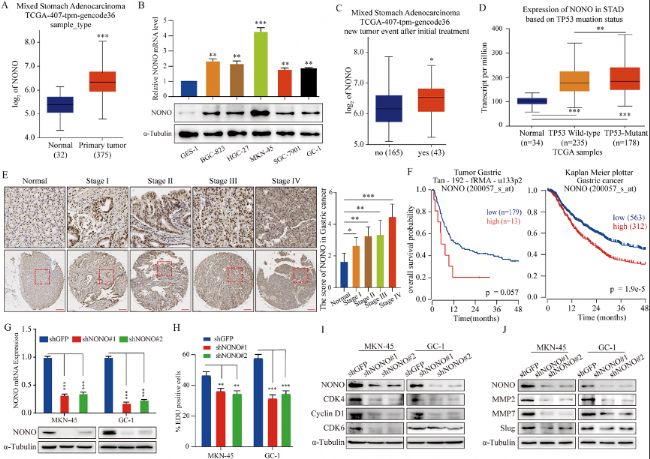
(B) 通過qRT-PCR和Western blot分析了非癌細胞系(GES-1)、4種胃癌細胞系(BGC-823、HGC-27、MKN-45和SGC-7901)以及一種患者來源的原代胃癌細胞(GC-1)中NONO mRNA的表達情況(n=3)。
(C) 在208例胃組織中,分析了接受初始治療后有無新腫瘤事件的患者中NONO mRNA的表達情況。
(D) 在447例胃組織中,根據TP53突變狀態分析了NONO mRNA的表達情況。
(E) 組織微陣列中NONO蛋白的免疫組化染色代表性圖像。
(F) 從Tumor Gastric Tan-192-fRMA-u133p2和Kaplan-Meier Plotter中獲得了NONO蛋白表達水平與生存率之間的相關性,并通過Kaplan-Meier(K-M)分析進行了評估。
(G) NONO蛋白敲低后進行Western blot和qRT-PCR實驗。
(H) EdU實驗確定NONO蛋白敲低下細胞的增殖情況。
(I) Western blot實驗檢測NONO蛋白敲低下細胞周期相關蛋白水平的表達情況。
(J) Western blot分析以檢測NONO蛋白敲低細胞中與轉移相關的蛋白水平的表達情況。

(B) KEGG通路富集分析展示差異表達基因(DEGs)在KEGG通路中的富集情況。
(C) GSEA富集圖展示在shGFP與shNONO MKN-45細胞中,PI3K信號通路基因集富集分析(GSEA)結果。
(D-E) Western blot分析檢測了在MKN-45和GC-1細胞中NONO蛋白敲低和過表達后,PI3K/AKT信號通路相關蛋白的表達情況。
(2)NONO直接調控PTEN mRNA的可變剪切
RNA-Seq分析顯示,NONO敲低導致PTEN mRNA的剪切模式改變,增加了PTEN全長mRNA的表達,減少了其他剪切變體的表達。
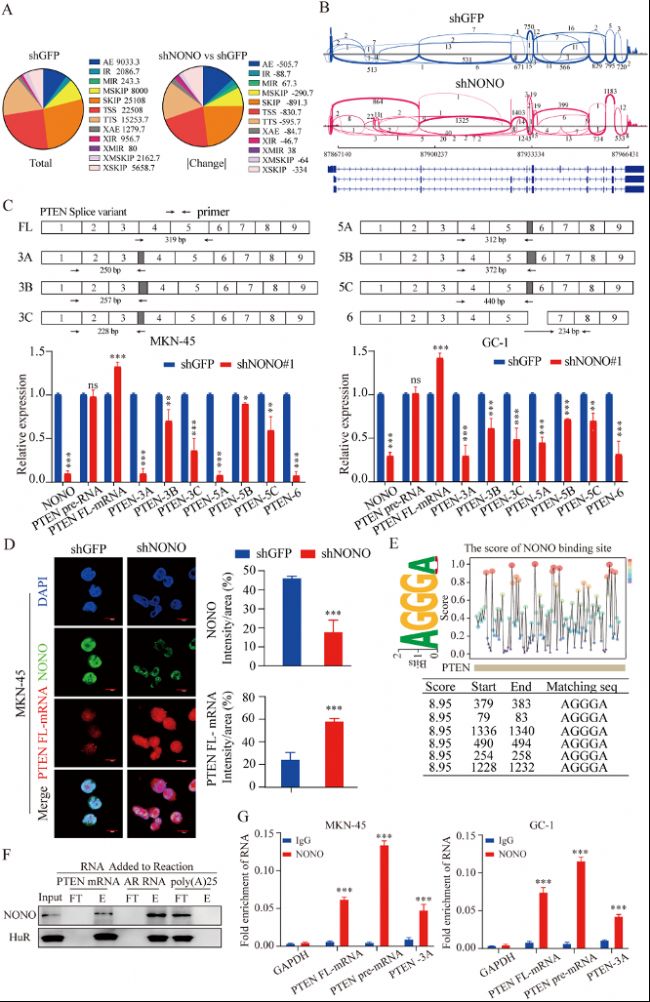
圖3:NONO蛋白直接調控PTEN mRNA的可變剪切。
(A) NONO蛋白敲低后MKN-45細胞中可變剪切事件定量分析。左側:對照組(shGFP)細胞中檢測到的可變剪切事件分布情況;右側:shNONO與shGFP細胞系之間可變剪切事件變化分布。
(B) NONO蛋白敲低后,MKN-45細胞中PTEN基因的RNA-seq reads比對情況的Sashimi圖可視化。
(C) qPCR分析NONO蛋白敲低后MKN-45和GC-1細胞中不同PTEN RNA的表達情況(n=3)。
(D) MKN-45細胞PTEN mRNA(紅色)的RNA原位雜交(FISH)和NONO蛋白(綠色)免疫熒光代表性圖像。
(E) RBPsuite預測NONO蛋白在PTEN mRNA上的結合位點的結果。
(F) RNA-蛋白Pull-Down實驗顯示NONO蛋白與PTEN mRNA之間的相互作用。
(G) 通過RIP-qPCR檢測GC細胞裂解液中不同PTEN mRNA種類與NONO蛋白之間的相互作用(n=3)。
(3)PTEN pre-mRNA的m5C模式受NONO介導的NSUN2招募影響
RNA-BS分析發現,NONO敲低導致PTEN mRNA的m5C修飾水平顯著降低,表明NONO通過NSUN2影響PTEN mRNA的m5C修飾。
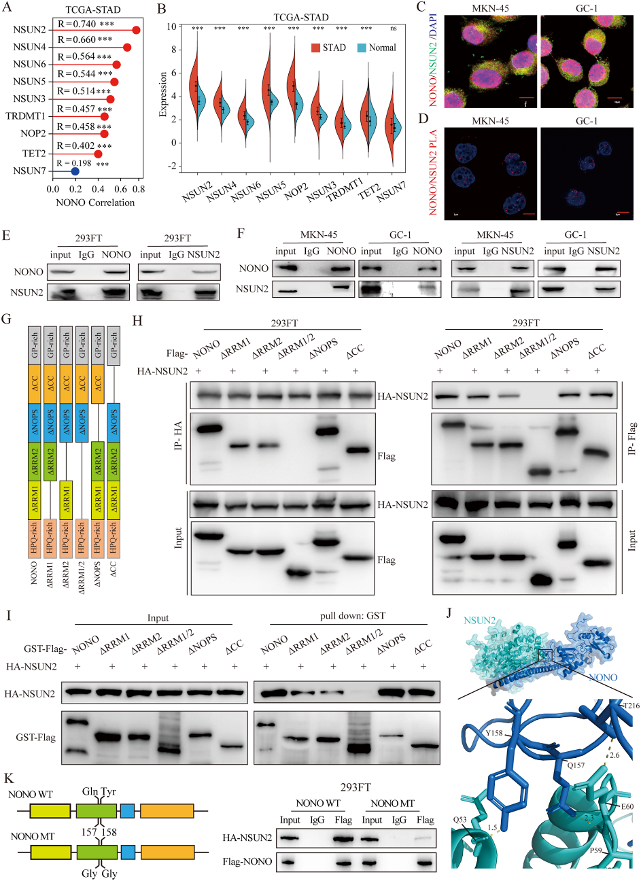
圖4:NONO蛋白與NSUN2在胃癌中的相互作用。
(A) NONO蛋白表達與TCGA-ATAD中RNA m5C相關基因表達的相關性。
(B) TCGA-STAD中RNA m5C相關基因的表達水平。
(C) NONO蛋白和NSUN2在細胞核中共定位。
(D) NONO蛋白與NSUN2的相互作用。
(E) NONO蛋白和NSUN2在293FT細胞、MKN-45和GC-1細胞中的相互作用。
(F) NONO蛋白和NSUN2在293FT細胞、MKN-45和GC-1細胞中的相互作用。
(G-H) 檢測NONO蛋白與NSUN2相互作用所需的NONO蛋白功能域。
(I) GST Pull-Down實驗用于檢測NONO蛋白與NSUN2相互作用所需的NONO蛋白功能域。
(J) 人類NONO蛋白-NSUN2復合物的整體結構。
(K) NONO蛋白的Q157和Y158突變消除了NONO蛋白與NSUN2之間的相互作用。

(B) 與匹配的低表達樣本相比,高表達m5C甲基化腫瘤中NONO或NSUN2蛋白表達的分布。
(C) 胃癌(GC)中不同m5C位點的分布。m5C位點的差異定義如下:平均m5C水平差異≥0.05(shNONO和shGFP)和p<0.05(Wilcoxon檢驗)。
(D) GC轉錄本中的m5C序列頻率標志。
(E) 在MKN-45細胞系中,MeRIP-qPCR表明m5C抗體(up)沉淀了PTEN mRNA的富集,RIP qPCR表明NSUN2抗體(down)沉淀了PTENmRNA的富集。
(F) 整合基因組瀏覽器軌跡顯示shGFP和shNONO MKN-45細胞中PTEN的reads覆蓋率和m5C水平(左)。RBPsuite用于預測NONO和NSUN2沿PTEN內含子5的結合位點(右)。
(G) Minigene實驗驗證NONO和NSUN2之間協調性。對照剪切報告基因(WT)和突變剪切報告基因的圖形表示(MUT:特異性地將突變引入NONO/NSUN2結合位點;綠色)(左)。對NONO敲除后的PTEN Minigenes進行qRT-PCR分析(右)。
(H) Kaplan-Meier分析揭示NONO、NSUN2的高表達和PTEN低表達與較差總生存率(OS)之間的相關性。
(4)NONO/NSUN2/PTEN軸的調控機制——促進GC進展
通過免疫共沉淀、RNA免疫沉淀和Minigene報告基因分析,揭示了NONO通過其RNA識別基序(RRM)結構域與NSUN2相互作用,進而影響PTEN mRNA的m5C修飾和可變剪切。

B. 在NSUN2敲低后NONO蛋白過表達的情況下,通過MTT實驗檢測細胞的增殖情況。
C. 在NSUN2敲低后NONO蛋白過表達的情況下,通過EdU實驗檢測細胞的增殖情況。
D. 在NSUN2敲低后NONO蛋白過表達的情況下,通過Transwell實驗檢測細胞的侵襲能力。
E. 在胃癌異種移植瘤中,通過免疫組化(IHC)檢測NONO蛋白、PTEN、Ki67和m5C水平的表達。
F. 肺部的代表性圖像。
G. 肺部的代表性圖像。
H. 通過H&E染色觀察裸鼠肺部切片,這些裸鼠通過尾靜脈注射了NONO蛋白敲低的MKN-45細胞。右側顯示了每只動物肺部結節的數量(n=4)。
I. 在NONO蛋白敲低后恢復NSUN2表達的情況下,通過Western blot分析PTEN的表達。
J. 在NONO蛋白敲低后NSUN2過表達的情況下,通過MTT實驗檢測細胞的增殖情況。
K. 在NONO蛋白敲低后NSUN2過表達的情況下,通過EdU實驗檢測細胞的增殖情況。
L. 在NONO蛋白敲低后NSUN2過表達的情況下,通過Transwell實驗檢測細胞的侵襲能力(n=3)。
M. 在NONO蛋白敲低后NSUN2過表達的情況下,進行MKN-45細胞的異種移植實驗(n=6)。分析了腫瘤的重量,并給出了P值。
N. 在NONO蛋白敲低后NSUN2過表達的情況下,進行MKN-45細胞的異種移植實驗(n=6)。分析腫瘤重量。
O. 每只動物肺部結節的數量(n=4)。
易小結
本研究揭示了NONO通過m5C修飾和可變剪切調控PTEN mRNA表達的新機制,這一機制在胃癌進展中發揮重要作用。研究結果不僅為理解腫瘤抑制基因失活提供了新的視角,還為胃癌診斷和治療提供了潛在靶點。
RNA-BisSeq(RNA-BS)在本研究中的作用
易基因提供的RNA-BisSeq(RNA-BS)技術在本研究中用于高分辨率地分析m5C修飾模式的變化。通過RNA-BS,研究人員能夠精確地檢測到PTEN mRNA上m5C修飾的變化,并確定這些變化與NONO表達水平的相關性。這一技術的應用為揭示m5C修飾在腫瘤抑制基因調控中的作用提供了直接證據,是本研究的關鍵技術手段之一。
參考文獻:
Zhao G, Liu R, Ge L, Qi D, Wu Q, Lin Z, Song H, Zhong L, Cui H. NONO regulates m5C modification and alternative splicing of PTEN mRNAs to drive gastric cancer progression. J Exp Clin Cancer Res. 2025 Mar 4;44(1):81. pii: 10.1186/s13046-024-03260-z. doi: 10.1186/s13046-024-03260-z.
近日,西南大學資源昆蟲高效養殖與利用全國重點實驗室趙蓋超博士等為第一作者,西南大學資源昆蟲高效養殖與利用全國重點實驗室崔紅娟教授和廣西醫科大學Liping Zhong為共同通訊,揭示了在胃癌(GC)中,RNA結合蛋白NONO通過m5C修飾和可變剪切(AS)調控PTEN mRNA表達,進而影響胃癌進展。研究通過分析m5C RNA甲基化測序(RNA-BS)、轉錄組測序(RNA-seq)等分析,揭示了NONO在胃癌中的作用機制,并提出了一個新的腫瘤抑制基因失活機制,即通過m5C修飾和相關的可變剪切介導調控。相關研究成果以《NONO regulates m5C modification and alternative splicing of PTEN mRNAs to drive gastric cancer progression》為題發表于《Journal of Experimental & Clinical Cancer Research》期刊。

標題:NONO regulates m5C modification and alternative splicing of PTEN mRNAs to drive gastric cancer progression(NONO調控PTEN mRNA的m5C修飾和可變剪切以驅動胃癌進展)
期刊:Journal of Experimental & Clinical Cancer Research
影響因子:IF11.4/Q1
技術平臺:RNA-BisSeq(RNA-BS)、RNA-seq等
本研究分析了胃癌的組織微陣列(tissue microarrays)和轉錄組數據,重點關注RNA剪切和m5C調控因子。為了揭示NONO在胃癌(GC)中的作用,研究采用了RNA測序(RNA-seq)、m5C測序(RNA-Bis-Seq)、RNA免疫沉淀、RNA原位雜交以及NONO敲低細胞的Minigene報告基因分析。研究還利用CDX模型和人類組織微陣列驗證了其臨床相關性。
對公開數據集的分析以及包含40例胃癌組織的組織微陣列的免疫組化檢測顯示,NONO在胃癌中表達上調,并且與不良預后相關。體外和體內實驗表明,NONO在胃癌細胞增殖、遷移和侵襲方面具有正向調控作用。在機制上,NONO直接與PTEN pre-mRNA互作,并通過RNA識別基序(RNA-recognition motif,RRM)結構域招募RNA m5C甲基轉移酶NSUN2,從而改變PTEN pre-mRNA的mRNA甲基化模式。通過臨床前實驗和臨床數據進一步證實了NONO/NSUN2/PTEN軸在胃癌進展中的致癌作用。
本研究揭示了NONO以m5C依賴性方式調控PTEN mRNA的可變剪切,導致胃癌中PTEN表達下調。闡明了NONO通過m5C修飾和相關可變剪切介導腫瘤抑制基因失活的新機制。
研究方法
細胞培養與轉染:使用多種胃癌細胞系(MKN-45、HGC-27、SGC-7901、BGC-823、MGC-803)、正常胃上皮細胞(GES-1)和人源胃癌細胞(GC-1)進行實驗,通過慢病毒轉染系統構建NONO敲低細胞系。
動物實驗:通過皮下注射和尾靜脈注射的方式,將GC細胞移植到裸鼠體內,觀察腫瘤生長和肺轉移情況。
RNA測序與分析:通過RNA測序(RNA-Seq)分析NONO敲低對胃癌細胞轉錄組的影響,鑒定差異表達基因和可變剪切事件。
RNA-BisSeq(RNA-BS):用于分析m5C修飾模式的變化,通過RNA-BS測序技術,研究NONO對PTEN mRNA m5C修飾的影響。
免疫共沉淀與RNA免疫沉淀:驗證NONO與NSUN2的相互作用,以及它們對PTEN mRNA的結合情況。
Minigene報告基因分析:通過構建包含PTEN外顯子5、內含子5和外顯子6的Minigene報告基因,研究NONO對PTEN可變剪切的影響。
結果圖形
(1)NONO在癌癥中作為癌基因和PI3K-AKT信號調控因子
通過對TCGA數據庫和組織微陣列的數據分析,結果表明NONO在胃癌組織中高表達,并與不良預后相關。

圖1:NONO蛋白在胃癌中作為癌基因和PI3K-AKT信號通路調控因子。
(A) 在TCGA數據庫中,與正常胃組織(32例)相比,胃癌組織(375例)中NONO mRNA水平顯著增加。(B) 通過qRT-PCR和Western blot分析了非癌細胞系(GES-1)、4種胃癌細胞系(BGC-823、HGC-27、MKN-45和SGC-7901)以及一種患者來源的原代胃癌細胞(GC-1)中NONO mRNA的表達情況(n=3)。
(C) 在208例胃組織中,分析了接受初始治療后有無新腫瘤事件的患者中NONO mRNA的表達情況。
(D) 在447例胃組織中,根據TP53突變狀態分析了NONO mRNA的表達情況。
(E) 組織微陣列中NONO蛋白的免疫組化染色代表性圖像。
(F) 從Tumor Gastric Tan-192-fRMA-u133p2和Kaplan-Meier Plotter中獲得了NONO蛋白表達水平與生存率之間的相關性,并通過Kaplan-Meier(K-M)分析進行了評估。
(G) NONO蛋白敲低后進行Western blot和qRT-PCR實驗。
(H) EdU實驗確定NONO蛋白敲低下細胞的增殖情況。
(I) Western blot實驗檢測NONO蛋白敲低下細胞周期相關蛋白水平的表達情況。
(J) Western blot分析以檢測NONO蛋白敲低細胞中與轉移相關的蛋白水平的表達情況。

圖2:NONO蛋白通過PTEN在胃癌細胞中調控PI3K/AKT信號通路。
(A) 火山圖展示基于shNONO與shGFP在MKN-45細胞中的對比,mRNA表達水平的變化倍數(以log2表示)。(B) KEGG通路富集分析展示差異表達基因(DEGs)在KEGG通路中的富集情況。
(C) GSEA富集圖展示在shGFP與shNONO MKN-45細胞中,PI3K信號通路基因集富集分析(GSEA)結果。
(D-E) Western blot分析檢測了在MKN-45和GC-1細胞中NONO蛋白敲低和過表達后,PI3K/AKT信號通路相關蛋白的表達情況。
(2)NONO直接調控PTEN mRNA的可變剪切
RNA-Seq分析顯示,NONO敲低導致PTEN mRNA的剪切模式改變,增加了PTEN全長mRNA的表達,減少了其他剪切變體的表達。

圖3:NONO蛋白直接調控PTEN mRNA的可變剪切。
(B) NONO蛋白敲低后,MKN-45細胞中PTEN基因的RNA-seq reads比對情況的Sashimi圖可視化。
(C) qPCR分析NONO蛋白敲低后MKN-45和GC-1細胞中不同PTEN RNA的表達情況(n=3)。
(D) MKN-45細胞PTEN mRNA(紅色)的RNA原位雜交(FISH)和NONO蛋白(綠色)免疫熒光代表性圖像。
(E) RBPsuite預測NONO蛋白在PTEN mRNA上的結合位點的結果。
(F) RNA-蛋白Pull-Down實驗顯示NONO蛋白與PTEN mRNA之間的相互作用。
(G) 通過RIP-qPCR檢測GC細胞裂解液中不同PTEN mRNA種類與NONO蛋白之間的相互作用(n=3)。
(3)PTEN pre-mRNA的m5C模式受NONO介導的NSUN2招募影響
RNA-BS分析發現,NONO敲低導致PTEN mRNA的m5C修飾水平顯著降低,表明NONO通過NSUN2影響PTEN mRNA的m5C修飾。

圖4:NONO蛋白與NSUN2在胃癌中的相互作用。
(B) TCGA-STAD中RNA m5C相關基因的表達水平。
(C) NONO蛋白和NSUN2在細胞核中共定位。
(D) NONO蛋白與NSUN2的相互作用。
(E) NONO蛋白和NSUN2在293FT細胞、MKN-45和GC-1細胞中的相互作用。
(F) NONO蛋白和NSUN2在293FT細胞、MKN-45和GC-1細胞中的相互作用。
(G-H) 檢測NONO蛋白與NSUN2相互作用所需的NONO蛋白功能域。
(I) GST Pull-Down實驗用于檢測NONO蛋白與NSUN2相互作用所需的NONO蛋白功能域。
(J) 人類NONO蛋白-NSUN2復合物的整體結構。
(K) NONO蛋白的Q157和Y158突變消除了NONO蛋白與NSUN2之間的相互作用。

圖5:PTEN mRNA上的m5C模式受NONO和NSUN2的影響。
(A) 組織微陣列中m5C甲基化免疫組織化學染色的代表性圖像(左)以及不同階段腫瘤和正常組織之間m5C甲基化的差異水平。(B) 與匹配的低表達樣本相比,高表達m5C甲基化腫瘤中NONO或NSUN2蛋白表達的分布。
(C) 胃癌(GC)中不同m5C位點的分布。m5C位點的差異定義如下:平均m5C水平差異≥0.05(shNONO和shGFP)和p<0.05(Wilcoxon檢驗)。
(D) GC轉錄本中的m5C序列頻率標志。
(E) 在MKN-45細胞系中,MeRIP-qPCR表明m5C抗體(up)沉淀了PTEN mRNA的富集,RIP qPCR表明NSUN2抗體(down)沉淀了PTENmRNA的富集。
(F) 整合基因組瀏覽器軌跡顯示shGFP和shNONO MKN-45細胞中PTEN的reads覆蓋率和m5C水平(左)。RBPsuite用于預測NONO和NSUN2沿PTEN內含子5的結合位點(右)。
(G) Minigene實驗驗證NONO和NSUN2之間協調性。對照剪切報告基因(WT)和突變剪切報告基因的圖形表示(MUT:特異性地將突變引入NONO/NSUN2結合位點;綠色)(左)。對NONO敲除后的PTEN Minigenes進行qRT-PCR分析(右)。
(H) Kaplan-Meier分析揭示NONO、NSUN2的高表達和PTEN低表達與較差總生存率(OS)之間的相關性。
(4)NONO/NSUN2/PTEN軸的調控機制——促進GC進展
通過免疫共沉淀、RNA免疫沉淀和Minigene報告基因分析,揭示了NONO通過其RNA識別基序(RRM)結構域與NSUN2相互作用,進而影響PTEN mRNA的m5C修飾和可變剪切。

圖6:NONO蛋白通過m5C依賴性機制促進胃癌發病。
A. 在NSUN2敲低后恢復NONO蛋白表達的情況下,通過Western blot分析PTEN的表達。B. 在NSUN2敲低后NONO蛋白過表達的情況下,通過MTT實驗檢測細胞的增殖情況。
C. 在NSUN2敲低后NONO蛋白過表達的情況下,通過EdU實驗檢測細胞的增殖情況。
D. 在NSUN2敲低后NONO蛋白過表達的情況下,通過Transwell實驗檢測細胞的侵襲能力。
E. 在胃癌異種移植瘤中,通過免疫組化(IHC)檢測NONO蛋白、PTEN、Ki67和m5C水平的表達。
F. 肺部的代表性圖像。
G. 肺部的代表性圖像。
H. 通過H&E染色觀察裸鼠肺部切片,這些裸鼠通過尾靜脈注射了NONO蛋白敲低的MKN-45細胞。右側顯示了每只動物肺部結節的數量(n=4)。
I. 在NONO蛋白敲低后恢復NSUN2表達的情況下,通過Western blot分析PTEN的表達。
J. 在NONO蛋白敲低后NSUN2過表達的情況下,通過MTT實驗檢測細胞的增殖情況。
K. 在NONO蛋白敲低后NSUN2過表達的情況下,通過EdU實驗檢測細胞的增殖情況。
L. 在NONO蛋白敲低后NSUN2過表達的情況下,通過Transwell實驗檢測細胞的侵襲能力(n=3)。
M. 在NONO蛋白敲低后NSUN2過表達的情況下,進行MKN-45細胞的異種移植實驗(n=6)。分析了腫瘤的重量,并給出了P值。
N. 在NONO蛋白敲低后NSUN2過表達的情況下,進行MKN-45細胞的異種移植實驗(n=6)。分析腫瘤重量。
O. 每只動物肺部結節的數量(n=4)。
易小結
本研究揭示了NONO通過m5C修飾和可變剪切調控PTEN mRNA表達的新機制,這一機制在胃癌進展中發揮重要作用。研究結果不僅為理解腫瘤抑制基因失活提供了新的視角,還為胃癌診斷和治療提供了潛在靶點。
RNA-BisSeq(RNA-BS)在本研究中的作用
易基因提供的RNA-BisSeq(RNA-BS)技術在本研究中用于高分辨率地分析m5C修飾模式的變化。通過RNA-BS,研究人員能夠精確地檢測到PTEN mRNA上m5C修飾的變化,并確定這些變化與NONO表達水平的相關性。這一技術的應用為揭示m5C修飾在腫瘤抑制基因調控中的作用提供了直接證據,是本研究的關鍵技術手段之一。
參考文獻:
Zhao G, Liu R, Ge L, Qi D, Wu Q, Lin Z, Song H, Zhong L, Cui H. NONO regulates m5C modification and alternative splicing of PTEN mRNAs to drive gastric cancer progression. J Exp Clin Cancer Res. 2025 Mar 4;44(1):81. pii: 10.1186/s13046-024-03260-z. doi: 10.1186/s13046-024-03260-z.
標簽:
m5C甲基化測序
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





