脂質納米顆粒LNP的組成特點、應用及其制備方法
脂質納米顆粒,做藥物遞送的小伙伴一定不陌生!遙想當年,小 M 也是看著同門拿著儀器擠膜,做表征,來來回回……本期就給大家整理下關于脂質納米顆粒那些事兒~
01
脂質納米顆粒
LIPID NANOPARTICLES
脂質納米顆粒 (Lipid Nanoparticle,LNP) 是一種脂質類物質組成的納米粒子,具有均勻脂質核心,廣泛用于小分子和核酸藥物的遞送。
LNP 通常由可電離陽離子脂質 (Ionizable lipids)、膽固醇、PEG 脂質 (PEGylated lipids)、結構脂質 (輔助脂質) 四個部分構成,一個典型的 LNP 包含多種組分以及包載內容 (Payload)。
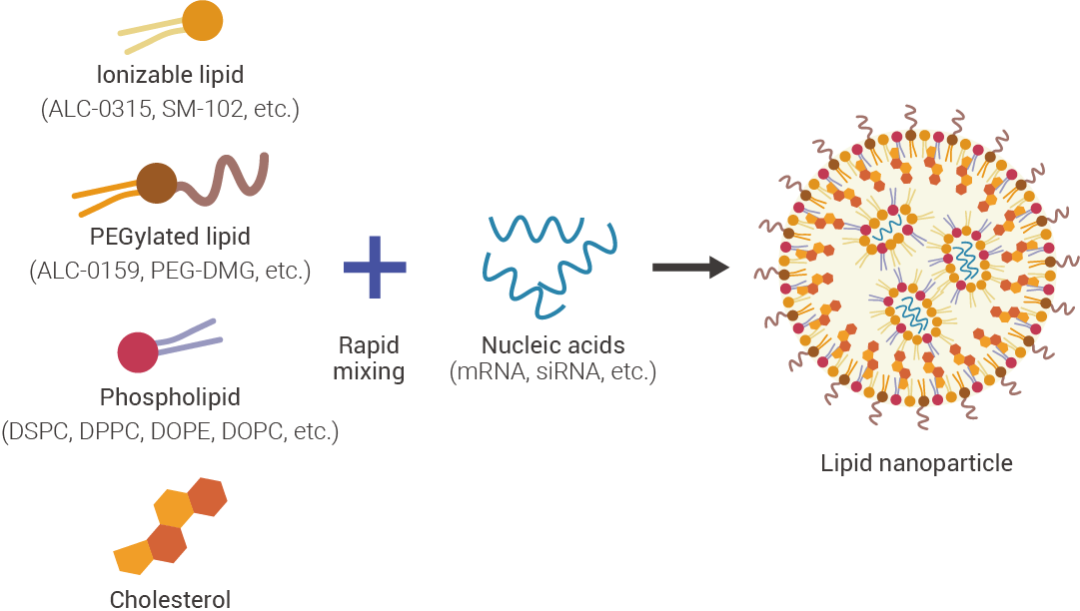 圖 1. 脂質納米顆粒基本組成[1]。
圖 1. 脂質納米顆粒基本組成[1]。
表 1. 脂質納米顆粒組成、特點及應用[1-8]。

脂質納米顆粒遞送系統(tǒng)的優(yōu)勢:
• 低免疫原性、具有良好的生物相容性和安全性
• 穩(wěn)定性強,在體內不易變形
• 核酸包封率高
• 細胞穿透性強、轉染效率高
• 內體逃逸能力強

02
如何制備?
HOW TO PREPARE?
脂質納米顆粒 (LNP) 的制備依賴于自組裝的能力,帶負電荷的核酸和帶正電荷的脂質之間產生靜電絡合,LNP 通過脂質組分之間的疏水作用和范德華作用相互生長。
LNP 的制備可以通過多種方式進行,例如脂質囊泡的擠出、脂質膜的再水化、納米沉淀、微流體混合,一般的制備方式是將水和脂質成分快速混合。小 M 為大家整理了高分文獻中常用的制備方案,大家可以根據自己的實驗目的進行脂質搭配比例上的調整~
具體操作 (供參考[9])
LNP 制劑的制備
• 天平稱取 15 mg DLin-MC3-DMA (MC3),然后加入 200 μL 純乙醇溶解 MC3,使其濃度達到 75 mg/mL;
• 天平稱取 10 mg DSPC,然后加入 1.0 mL 純乙醇溶解,終濃度為 10 mg/mL;
• 天平稱取 10 mg 膽固醇,加入 1.0 mL 純乙醇溶解,終濃度為 10 mg/mL;
• 天平稱取 10 mg DMG-PEG,然后加入 1.0 mL 純乙醇溶解,終濃度為 10 mg/mL;
• 將 13.3 μL DLin-MC3-DMA 溶液、24.6 μL DSPC 溶液、46.4 μL 膽固醇溶液和 11.7 μL DMG-PEG 溶液,充分混合得到澄清的混合溶液 I。混合溶液 I 每 μL 純乙醇中含有 19 μg 的總脂質。
mRNA 包載物
mRNA 應溶解在 10 mM 檸檬酸鹽緩沖液 (10 mM,pH 4) 中,將上述步驟中得到的脂質混合溶液與含有 mRNA 的水性緩沖液快速混合以實現 40/1 (總脂質/mRNA,wt/wt) 的最終重量比。
注:mRNA 比例可以增加以降低潛在的脂質毒性
mRNA –LNP 的制備
有三種常用的方法可以實現混合脂質溶液和 mRNA 溶液的快速混合:移液管混合法 (小規(guī)模制備)、渦旋混合法 (中等規(guī)模制備) 和微流體混合法 (大規(guī)模制備) 。
01
移液管混合法 (小規(guī)模制備)
1. 將 16.8 μL 上面得到的混合溶液 I 加入不含 RNA 酶的 1.5 mL 試管中;
2. 向試管中加入 1.2 μL 乙醇,充分混勻得到混合溶液 II;
3. 取另一個不含 RNA 酶的 1.5 mL 試管,加入 46 μL 檸檬酸緩沖液 (10 mM,pH 4),向試管中加入 8 μL mRNA (1.0 mg/mL),混合均勻;
4. 取 54 μL mRNA 緩沖液 加入步驟 2 中獲得的混合溶液 II,立刻吹打混勻 20-30s (手動混勻);
注:水:乙醇的體積比為 3:1,混合后立即吹打混勻。否則可能影響 mRNA-LNP 混合物的活性。
5. 將步驟 4 得到的溶液在室溫下孵育 15 min;
6. 使用透析管 (MWCO 3500) 在 1 x PBS 中透析上述溶液 1 h 以上,以除去乙醇和酸性緩沖液;
7. 透析后,將溶液轉至不含 RNA 酶的 1.5 mL 試管中,測量體積;
8. 加入 1 x PBS 溶液,使總體積達到 800 μL。
注:這步得到的溶液可以在 4℃ 短期保存。
02
渦旋混合法 (中等規(guī)模制備)
1. 將 21 μL 上面得到的混合溶液 I 加入不含 RNA 酶的 1.5 mL 試管中;
2. 向試管中加入 9 μL 乙醇,充分混勻得到混合溶液 II;
3. 取另一個不含 RNA 酶的 1.5 mL 試管,加入 80 μL 檸檬酸鹽緩沖液 (10 mM,pH 4),向試管中加入10 μL mRNA (1.0 mg/mL),混合均勻;
4. 將渦旋混合器設備設置為“ON”,速度水平設置為“1”;
5. 在渦旋混合器上以中速渦旋 mRNA 緩沖液,再移取 30 μL 混合溶液 II 快速加入渦旋溶液中,將所得混合溶液渦旋 20-30 S;
注:水:乙醇的體積比為 3:1,混合后立即吹打混勻。否則可能影響 mRNA-LNP 混合物的活
6. 將步驟 5 所得溶液在室溫下孵育 15 min;
7. 使用透析管(MWCO 3500) 在 1 x PBS 中透析上述溶液 1 h 以上,以除去乙醇和酸性緩沖液;
8. 透析后,將溶液轉至不含 RNA 酶的 1.5 mL 試管中,測量體積;
9. 加入 1 x PBS 溶液,使總體積達到 1000 μL。
注:這步得到的溶液可以在 4℃ 短期保存。
03
微流體混合法 (大規(guī)模制備)
具體操作方案使用儀器相關度很高,建議參考具體使用的儀器官網步驟進行。
03
LNP 的表征
Characterization of LNPs
為了確保 LNP 的質量和有效性,需要對 LNP 進行參數表征,例如尺寸、PDI、電荷、RNA EE。
• Zeta (平均直徑/粒徑): 通過動態(tài)光散射 (DLS) 檢測。
• PDI (Polydispersity index, 多分散指數) :范圍 0-1,數值越高表示多分散性越強,數值越小表示粒度越均勻,通過動態(tài)光散射 (DLS) 檢測。
• Charge (電荷):對于基于 RNA 的 LNP,通常優(yōu)選近中性電荷,通過 ζ 電位分析儀測量。
• Morphology (形態(tài)):通過電子顯微鏡 (TEM、Cyro-EM、SEM、AFM 等) 檢測。
• RNA EE (RNA Encapsulation Efficieney%, RNA 包封效率) :可通過 Ribogreen 測定來測量,先測定 LNP 外的 RNA 濃度,然后使用表面活性劑溶解 LNP 來測量 LNP 內部和外部的總 RNA 濃度,計算公式如下:

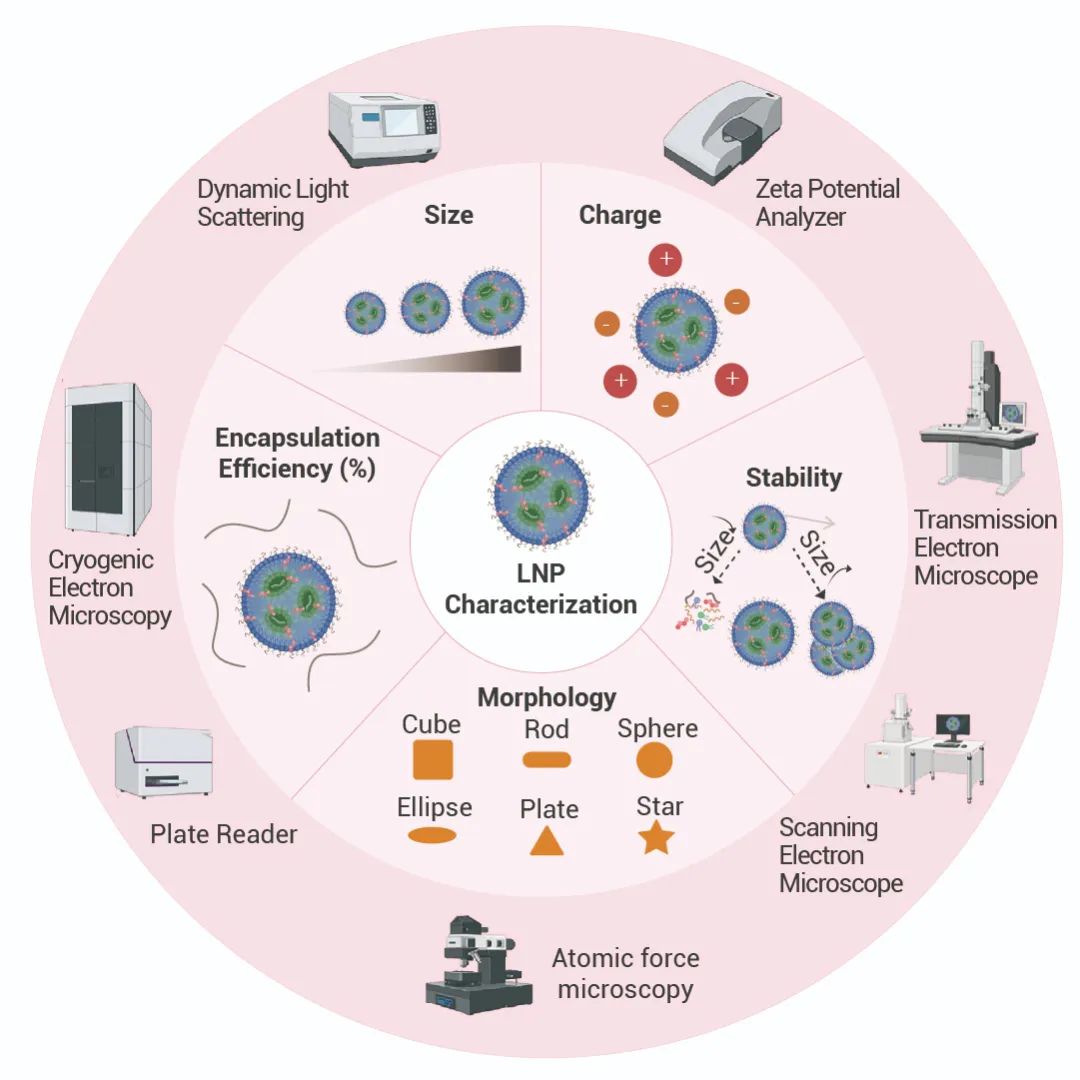 圖 2. LNP 的表征參數與相關檢測儀器[10]。
圖 2. LNP 的表征參數與相關檢測儀器[10]。
04
脂質納米顆粒的發(fā)展
DEVELOPMENT OF LIPID NANOPARTICLES
LNP 是目前臨床應用上最廣泛的核酸藥物遞送載體,目前已有近 80 種基于 LNP 為遞送載體的基因藥物進入臨床開發(fā)階段,大大加速了基因治療的發(fā)展[10]。但是,LNP 在實際應用中仍存在許多問題,其一是因為 LNP 在經過體循環(huán)后通常在肝部富集,對其他給藥器官的靶向困難[11]。其二是 LNP 只能作為載體參與藥物遞送,無法協(xié)同 mRNA 治療。
目前針對 LNP 體系的改良都和這兩個方向有關。包括通過對 LNP 基本四組分的改造與優(yōu)化增加 mRNA 遞送效率并提高安全性,或者通過引入第五組分來改善肝外靶向遞送[12]。
另外一種主流的優(yōu)化方案是通過引入帶修飾的脂質原料,對 LNP 表面改性實現精準靶向。例如上面提到過的,使用馬來酰胺化 PEG 脂質,與蛋白\抗體相連接,實現靶向組織、器官或細胞。
后續(xù)我們會出一期推文整理不同的修飾基團在其中的作用,以及如何設計 LNP 感興趣的老師可以繼續(xù)關注~
|
產品推薦 |
|
是一種哺乳動物中的主要固醇,占質膜結構成分的 20-25%。 |
|
是一種含有 DSPE 和胺端末基的 PEG 聚合物。DSPE-PEG 2000 可用于形成膠束作為藥物遞送的納米顆粒。 |
|
是一種氨基脂質,可在嚙齒動物和靈長類動物模型中提供有效的 mRNA 遞送。 |
|
是一種天然存在的陰離子磷脂,可以在水溶液中形成脂質雙層,并用于生成膠束、脂質體和其他人工膜。 |
|
OptiLNP RNA 轉染試劑 (肺部靶向) (HY-K2025) 是一種基于脂質納米粒 (LNP) 技術開發(fā)的即用型轉染試劑,適用于實驗動物的 mRNA 和短鏈 RNA 通過靜脈注射給藥的肺部靶向遞送。 |
|
OptiLNP RNA 轉染試劑 (干細胞) (HY-K2019) 是一種基于脂質納米粒 (LNP) 技術開發(fā)的即用型轉染試劑,適用于不同類型的 RNA 在免疫細胞中的轉染。 |
|
Firefly luciferase mRNA-LNP (HY-153229) 是一種已包裹 Firefly luciferase mRNA 的脂質納米粒 (LNP),適用于 RNA 傳遞、翻譯效率、細胞活力等檢測。 |
參考文獻:
[1] Jung HN,et al. Lipid nanoparticles for delivery of RNA therapeutics: Current status and the role of in vivo imaging. Theranostics. 2022 Oct 24;12(17):7509-7531.
[2] Vallazza B,et al. Recombinant messenger RNA technology and its application in cancer immunotherapy, transcript replacement therapies, pluripotent stem cell induction, and beyond. Wiley Interdiscip Rev RNA. 2015 Sep-Oct;6(5):471-99.
[3] Kowalski PS,et al. Delivering the Messenger: Advances in Technologies for Therapeutic mRNA Delivery. Mol Ther. 2019 Apr 10;27(4):710-728.
[4] Sebastiani F, et al.Apolipoprotein E Binding Drives Structural and Compositional Rearrangement of mRNA-Containing Lipid Nanoparticles. ACS Nano. 2021 Apr 27;15(4):6709-6722.
[5] Reichmuth AM,et al. mRNA vaccine delivery using lipid nanoparticles. Ther Deliv. 2016;7(5):319-34.
[6] Eygeris Y,et al. Chemistry of Lipid Nanoparticles for RNA Delivery. Acc Chem Res. 2022 Jan 4;55(1):2-12.
[7] Knop K,et al. Poly(ethylene glycol) in drug delivery: pros and cons as well as potential alternatives. Angew Chem Int Ed Engl. 2010 Aug 23;49(36):6288-308.
[8] Parhiz H,et al. PECAM-1 directed re-targeting of exogenous mRNA providing two orders of magnitude enhancement of vascular delivery and expression in lungs independent of apolipoprotein E-mediated uptake. J Control Release. 2018 Dec 10;291:106-115.
[9] Wang X,et al. Preparation of selective organ-targeting (SORT) lipid nanoparticles (LNPs) using multiple technical methods for tissue-specific mRNA delivery. Nat Protoc. 2023 Jan;18(1):265-291.
[10] Ma Y,et al. A perspective of lipid nanoparticles for RNA delivery. Exploration (Beijing). 2024 Apr 15;4(6):20230147.
[11] Witzigmann D,et al. Lipid nanoparticle technology for therapeutic gene regulation in the liver. Adv Drug Deliv Rev. 2020;159:344-363.














