Kirkstall 3D活細胞自動灌流培養(yǎng)系統(tǒng)最新應用分享
近日,倫敦帝國理工學院抗菌藥物優(yōu)化中心,倫敦衛(wèi)生和熱帶醫(yī)學學院傳染病和熱帶病學院Alaa Riezk et al.研究團隊,利用英國Kirkstall 3D 活細胞自動灌流培養(yǎng)系統(tǒng)模擬生理流體流動,對比了靜態(tài)和動態(tài)培養(yǎng)條件下巨噬細胞的反應及抗利什曼原蟲納米藥物的療效,強調(diào)了流體流動動力學在體外研究中的重要性,為皮膚利什曼病治療策略的優(yōu)化提供了參考。
一. 研究背景:
利什曼病是由利什曼原蟲引起的寄生蟲病,包括內(nèi)臟利什曼病和皮膚利什曼病等,現(xiàn)有治療手段存在局限且新藥研發(fā)不足。傳統(tǒng)靜態(tài)細胞培養(yǎng)系統(tǒng)無法模擬體內(nèi)動態(tài)環(huán)境,而動態(tài)培養(yǎng)系統(tǒng)能更好地模擬細胞在體內(nèi)的生理條件,有助于更準確地研究細胞行為和病原體相互作用。本研究旨在探究Kirkstall 3D 活細胞自動灌流培養(yǎng)系統(tǒng) 模擬的動態(tài)流體灌注,對巨噬細胞功能及基于殼聚糖的抗利什曼原蟲制劑療效的影響。
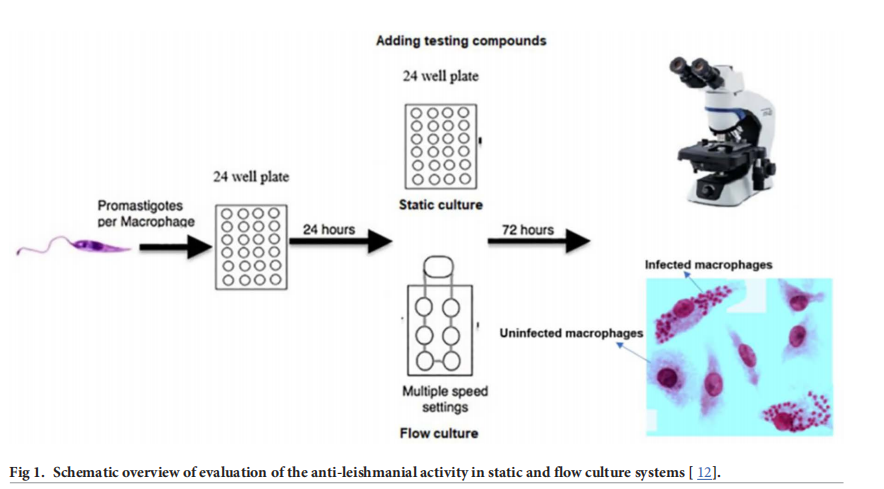
二. 主要實驗儀器/關(guān)鍵實驗步驟描述:
1. 實驗準備階段
1.1 選擇實驗系統(tǒng):選用英國Kirkstall QV介質(zhì)灌注系統(tǒng),其六腔光學托盤可實現(xiàn)細胞在不同介質(zhì)灌注速率下的培養(yǎng),且能直接觀察感染細胞并持續(xù)監(jiān)測感染情況。為模擬人體間質(zhì)液條件,通過數(shù)學和計算模型確定插入塊高度,以確保細胞表面流速符合皮膚間質(zhì)液流速范圍。實驗設置了靜態(tài)(0 m/s)、慢速(\(1.45×10^{-9}m/s\) ,細胞位于腔室底部)和快速(\(1.23×10^{-7}m/s\) ,細胞位于插入塊上)三種流動條件
1.2細胞與寄生蟲培養(yǎng):利什曼原蟲(L. major,MHOM/SA/85/JISH118)的無鞭毛體從感染小鼠皮膚損傷處分離并轉(zhuǎn)化為前鞭毛體,在添加10%熱滅活胎牛血清(HiFCS)的Schneider昆蟲培養(yǎng)基中于26°C培養(yǎng),定期通過BALB/c小鼠傳代,實驗使用低代數(shù)(<3代)前鞭毛體。從6 - 8周齡雌性BALB/c小鼠獲取骨髓來源的巨噬細胞(BMMs) ,從8 - 10周齡雌性CD1小鼠獲取腹腔巨噬細胞(PEMs) 。THP - 1細胞在添加L - 谷氨酰胺和10% HiFCS的RPMI - 1640培養(yǎng)基中,于37°C、5% \(CO_2\) 培養(yǎng)箱培養(yǎng),每周按1/10比例傳代,用20 ng/mL佛波酯12 - 肉豆蔻酸13 - 乙酸酯(PMA)處理24小時誘導分化為巨噬細胞。
2. 感染巨噬細胞:將巨噬細胞(PEMs、BMMs、THP - 1細胞)以每孔\(4×10^5\) 個細胞的密度接種在24孔板的12mm圓形玻璃蓋玻片上,在RPMI - 1640培養(yǎng)基(含10% HiFCS)中于37°C、5% \(CO_2\) 孵育24小時。之后,加入不同濃度的L. major前鞭毛體(使寄生蟲與巨噬細胞比例在0.5:1至15:1之間),在34°C、5% \(CO_2\) 環(huán)境下繼續(xù)孵育24小時。隨后,將三分之二的玻璃蓋玻片轉(zhuǎn)移至QV900系統(tǒng)進行動態(tài)培養(yǎng),其余作為靜態(tài)對照,在相同溫度和\(CO_2\) 濃度下繼續(xù)培養(yǎng)72小時。培養(yǎng)結(jié)束后,用甲醇固定細胞,并用吉姆薩染色 。
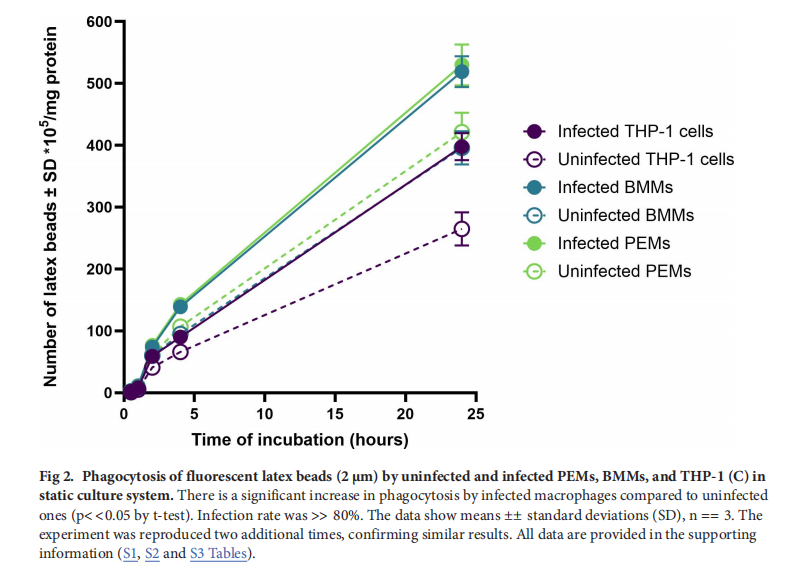
3. 測量巨噬細胞功能
3.1吞噬作用:利用2μm直徑的熒光紅色標記乳膠珠評估巨噬細胞的吞噬作用。巨噬細胞感染L. major前鞭毛體并在不同流動條件下孵育0.5 - 24小時后,用冰冷PBS洗滌去除未內(nèi)化的珠子,再用0.5% Triton X - 100和0.2 M NaOH裂解細胞。通過熒光酶標儀(激發(fā)波長575nm,發(fā)射波長610nm)分析細胞裂解物,以確定吞噬的乳膠珠數(shù)量,并根據(jù)細胞蛋白含量(使用Micro BCA蛋白試劑盒測定)進行標準化。實驗設置了細胞松弛素D(1μg/ml)抑制吞噬作用的對照組 。
3.2巨胞飲作用:采用pHrodo Red葡聚糖(在酸性環(huán)境中發(fā)熒光)測量巨噬細胞的巨胞飲作用。巨噬細胞感染寄生蟲后在不同流動條件下培養(yǎng),用Live Cell Imaging Solution洗滌三次,然后在含10% HiFCS和40μg/mL pHrodo Red葡聚糖的RPMI - 1640培養(yǎng)基中于34°C、5% \(CO_2\) 孵育0.5 - 24小時。孵育結(jié)束后再次洗滌細胞,用熒光酶標儀(激發(fā)波長560nm,發(fā)射波長585nm)檢測巨胞飲活性。實驗使用10μg/ml丙嗪(已知的巨胞飲抑制劑)孵育巨噬細胞2小時,以抑制巨胞飲作用,作為對照組 。
4. 藥物和納米顆粒的制備與表征
4.1藥物和納米顆粒制備:兩性霉素B(AmB,純度≥95%)用DMSO溶解配制成10mM儲存液,再稀釋于含10%HiFCS的RPMI - 1640培養(yǎng)基中備用。取1g高分子量殼聚糖(MW = 310 - 375kDa)溶解于100mL 1%溶液,室溫攪拌24小時至澄清,用2M氫調(diào)節(jié)pH至6.5。制備納米顆粒時,在攪拌條件下,向10mL殼聚糖溶液中逐滴加入10mL TPP水溶液(制備空白納米顆粒不加AmB,制備載藥納米顆粒則加入0.5mL AmB),攪拌5分鐘后超聲15分鐘以減小粒徑,再通過0.2µm注射器過濾器過濾去除聚集體和較大顆粒,然后用30kDa離心過濾器(Spin - X UF concentrators)離心純化和濃縮,去除未包裹的AmB,最后加入5%蔗糖作為冷凍保護劑進行凍干,48小時后收集凍干的納米顆粒并儲存于4°C 。
4.2藥物和納米顆粒表征:通過高效液相色譜(HPLC)分析AmB,計算包封率(EE)和藥物負載量。公式分別為:EE(%) = 100×(總AmB重量 - 游離AmB重量)/總AmB重量;藥物負載量(%) = 100×(總AmB重量 - 游離AmB重量)/(殼聚糖重量 + TPP重量) 。使用ZetaSizer測量納米顆粒的平均直徑、zeta電位和多分散指數(shù),用Malvern ZetaSizer軟件v7.11進行數(shù)據(jù)分析。
5. 評估介質(zhì)流動對藥物和納米顆粒療效的影響:將PEMs接種在玻璃蓋玻片上,在靜態(tài)條件下感染前鞭毛體24小時。之后,將三分之二含有感染巨噬細胞的蓋玻片轉(zhuǎn)移至QV900系統(tǒng),在34°C、5% \(CO_2\) 培養(yǎng)箱中以360μL/min的流速進行動態(tài)培養(yǎng),分別設置細胞位于腔室底部(慢速流動,\(1.45×10^{-9}m/s\) )和位于插入塊上(快速流動,\(1.23×10^{-7}m/s\) )兩種情況,其余蓋玻片作為靜態(tài)對照。在靜態(tài)感染24小時后,用于藥物活性研究的培養(yǎng)基中添加不同濃度的藥物(殼聚糖溶液、空白殼聚糖 - TPP納米顆粒、載藥AmB的殼聚糖 - TPP納米顆粒、純AmB)。72小時后,取出所有蓋玻片,用甲醇固定、吉姆薩染色,在顯微鏡下計數(shù)感染巨噬細胞數(shù)量,評估藥物對寄生蟲感染的抑制效果,使用Prism軟件(GraphPad)進行非線性S型曲線擬合(可變斜率)分析數(shù)據(jù) 。
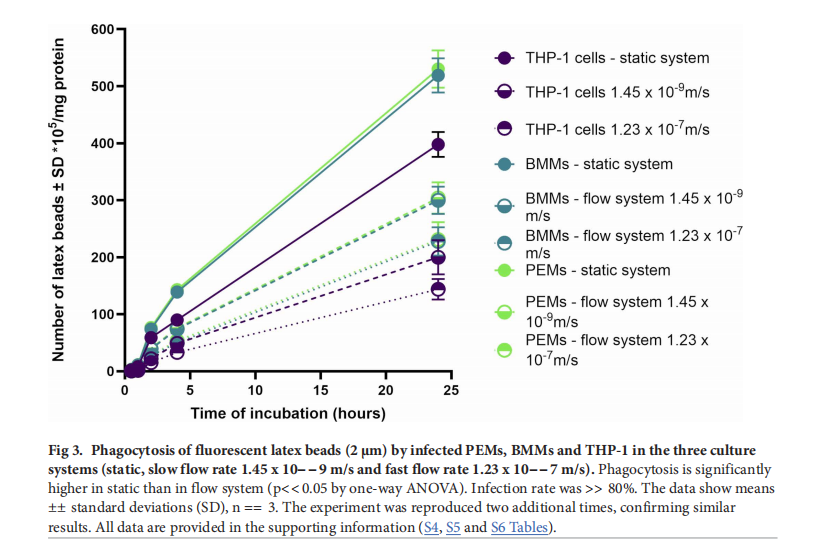
三. 研究結(jié)果
- 巨噬細胞功能:感染L. major的巨噬細胞(PEMs、BMMs和THP - 1)的吞噬和巨胞飲作用比未感染細胞顯著增強,且PEMs和BMMs的這兩種功能高于THP - 1細胞。動態(tài)流動條件下,巨噬細胞的吞噬和巨胞飲作用顯著降低,且流速越快,降低越明顯。
- 抗利什曼原蟲活性:所有制劑在靜態(tài)培養(yǎng)中的抗利什曼原蟲活性均高于動態(tài)培養(yǎng)。隨著流速增加,殼聚糖溶液、空白殼聚糖 - TPP納米顆粒、載藥AmB的殼聚糖 - TPP納米顆粒以及純AmB的抗利什曼原蟲活性均顯著下降 。流體流動動力學對評估巨噬細胞功能和抗利什曼原蟲活性至關(guān)重要。流體流動會降低巨噬細胞的吞噬和巨胞飲功能,減少藥物積累,進而降低抗利什曼原蟲藥物的療效。未來研究應進一步探索流體流動對巨噬細胞行為的影響,以完善疾病機制研究和治療策略的開發(fā)。
參考文獻:Comparative assessment of macrophage responses and antileishmanial efficacy in dynamic vs. Static culture systems utilizing chitosan-based formulations,Published: March 11, 2025
北京基爾比生物科技有限公司主營:3D-clinostat 三維旋轉(zhuǎn)儀,Kilby微/超重力三維細胞培養(yǎng)系統(tǒng),3D回轉(zhuǎn)重力環(huán)境模擬系統(tǒng),隨機定位儀,Kilby類器官芯片搖擺灌注儀,英國Kirkstall 類器官串聯(lián)芯片灌流仿生構(gòu)建系統(tǒng)
品牌制造商簡介
Kirkstall Ltd.成立于2006年,是Braveheart Investment Group plc 的子公司,總部位于英國。Kirkstall開發(fā)了一種創(chuàng)新的微生理系統(tǒng)的器官芯片模型Quasi Vivo®。作為器官芯片技術(shù),Kirkstall已經(jīng)建立了牛津大學生物醫(yī)學工程研究所等著名的大學實驗室的龐大用戶群,產(chǎn)品在全球范圍內(nèi)享有盛譽。
北京基爾比生物科技有限公司是Kirkstall ltd.授權(quán)在中國的總代理商,全面負責Kirkstall公司旗下所有產(chǎn)品在中國的銷售,市場推廣和技術(shù)支持等事宜





