納米流式檢測技術(shù) (nFCM) 評估六種膜燃料標記細胞外囊泡的性能研究
細胞外囊泡 (EVs) 憑借其攜帶生物活性分子并精準傳遞至特定靶細胞的卓越能力,在診斷與治療領域展現(xiàn)出極為廣闊的應用前景。準確表征和定量EVs對于理解其功能和臨床相關性至關重要。在EVs研究與轉(zhuǎn)化應用過程中,熒光標記技術(shù)被廣泛應用于EVs的表征。但固有的異質(zhì)性以及缺乏通用的蛋白標記物等因素,使該方法面臨諸多挑戰(zhàn)。諸如一系列亟待解決的關鍵問題:如何判斷自制EVs的質(zhì)量是否符合標準?怎樣客觀評價EVs的純度?是否存在通用型染料能夠特異性識別EVs?在種類繁多的熒光染料中,如何篩選出性能最優(yōu)的標記工具?
帶著這些問題,NanoFCM英國團隊聯(lián)合Oxford Brookes大學以及Sheffield Hallam大學在Journal of extracellular biology發(fā)表一篇題為“Shining a light on fluorescent EV dyes: Evaluating efficacy, specificity and suitability by nano-flow cytometry”的研究論文。本研究通過納米流式檢測技術(shù) (nFCM) 在單顆粒水平從EVs 的標記效率、特異性和通用性等多個維度綜合評估了六種商品化的熒光染料。研究者旨在為EVs的熒光標記提供一種系統(tǒng)性的評估方法,并為選擇合適的膜染料提供有價值的參考依據(jù),從而推動EVs的基礎研究和臨床應用。
一、膜染料最佳濃度確認
研究者選取六種商品化膜染料(表1)。為了確定每種染料與EVs的最佳結(jié)合比例,研究者開展了一系列濃度優(yōu)化實驗,旨在實現(xiàn)對EVs的高效標記,同時最大程度地降低因染料過量而引發(fā)的背景熒光干擾。研究者將SW480細胞系來源的EVs稀釋到2×1010particles/mL的濃度,分別與不同濃度梯度的膜染料進行孵育。憑借nFCM高靈敏檢測性能以及其實時監(jiān)測背景水平的能力,通過分析熒光陽性率和熒光背景水平來評估染料的性能。實驗結(jié)果顯示,每種染料均存在最佳標記濃度:在此濃度下,EVs的熒光陽性率能夠達到峰值,同時熒光背景水平被有效控制在較低水平(圖1D-G)。進一步分析原始數(shù)據(jù),研究者觀察到當膜染料的濃度過高時,熒光背景水平顯著升高,從而掩蓋了弱熒光信號,使得EVs的標記效果大打折扣(圖1A);相反,當膜染料的濃度適中時,EVs的標記效率顯著提高,且熒光背景維持在較低水平。這種平衡使得檢測到的熒光信號清晰可辨,能夠有效區(qū)分信號和背景噪聲,從而確保實驗結(jié)果的準確性和可靠性(圖1B)。然而,如果膜染料的濃度過低,許多EVs將無法被染色,導致標記效率低下,進而影響實驗的整體效果(圖1C)。
表1. 膜染料基本情況
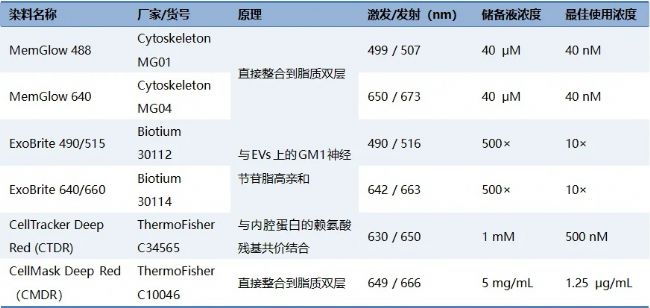
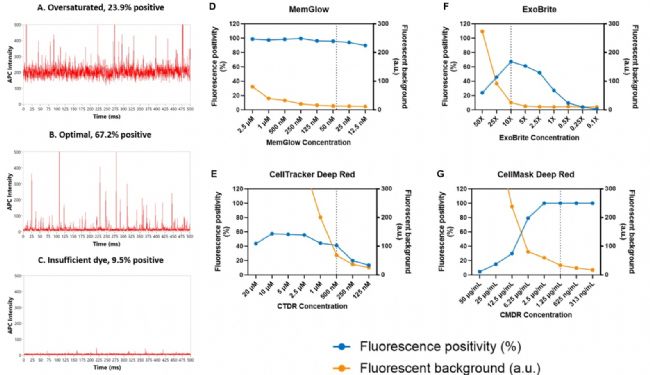
圖1. 通過nFCM優(yōu)化膜染料濃度
二、膜染料標記效率對比
為了評估不同膜染料的標記效率和特異性,研究者選取了SW620和SW480兩種細胞來源的EVs進行膜染料標記,并通過nFCM檢測熒光陽性率。結(jié)果顯示,CMDR、MemGlow 640和MemGlow 488在兩種細胞來源EVs的標記效率均較高,陽性率超過95%;相較之下,ExoBrite 490/515 和ExoBrite 640/660在SW620來源EVs的標記效率較低,低于50%(圖2a-g)。研究者進一步采用5% Triton X-100處理所有樣本以驗證標記特異性。結(jié)果顯示,處理后,SW620來源EVs顆粒濃度降低了68.6%,而SW480來源EVs的顆粒濃度降低幅度更大,達到了73.4%(圖2h)。這一結(jié)果不僅證實了染料標記的特異性,還揭示了不同細胞系來源的EVs在膜結(jié)構(gòu)穩(wěn)定性上可能存在差異。
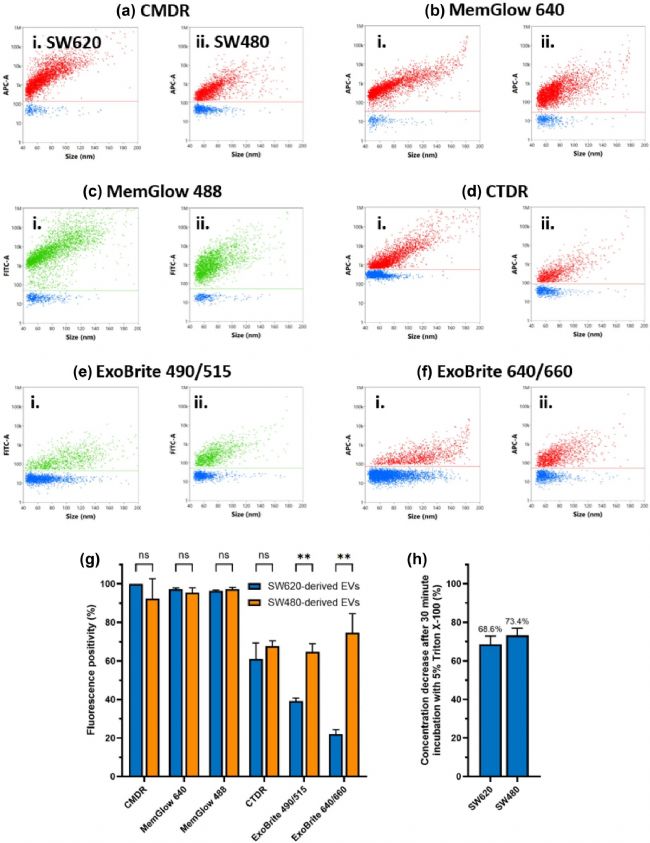
圖2. 六種膜染料標記SW620和SW480來源EVs的標記效率
為了進一步驗證染料對EVs的標記效率和特異性,研究者將膜染料與抗四跨膜蛋白抗體 (CD9、CD63、CD81) 進行了共標記。通過分析四跨膜蛋白陽性顆粒中膜染料標記的百分比來評估染料的標記效率和特異性。結(jié)果顯示,MemGlow 640、CMDR和MemGlow 488的標記效果最佳,熒光陽性率大于95%(圖3a)。未能被染料標記的四跨膜蛋白陽性顆粒的粒徑遠小于被標記的顆粒(圖3b-e),這可能是由于小粒徑EVs表面靶標(如GM1 糖鞘脂或酯酶)表達量過低而影響了染料的標記效率。
圖3. 不同膜染料與三種抗四跨膜蛋白抗體共標記
三、膜染料自團聚對比
膜染料的自團聚可能會導致染料形成與EVs大小相似的熒光顆粒,并在熒光檢測中產(chǎn)生假陽性信號,從而影響實驗的準確性和可靠性。為了評估自團聚現(xiàn)象,研究者將每種膜染料分別與無顆粒磷酸鹽緩沖液 (PBS) 進行標記,以確定是否產(chǎn)生自團聚。結(jié)果顯示,在最佳標記濃度下,所用膜染料緩沖液中形成的熒光陽性顆粒數(shù)量極低(圖4a-g)。這表明所選熒光染料自團聚對EVs脂膜標記結(jié)果影響較小。
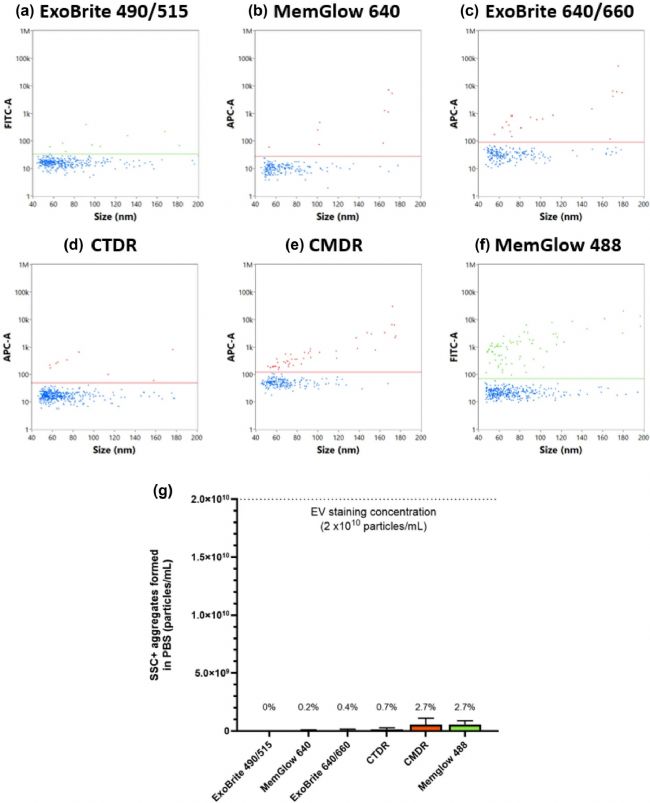
圖4. 膜染料在PBS中自團聚情況
四、膜染料特異性對比
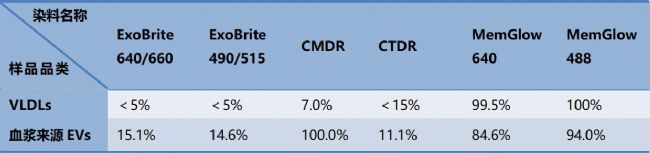
為了評估膜染料是否會特異性地標記其他脂質(zhì)結(jié)構(gòu),研究者嘗試用膜染料標記極低密度脂蛋白 (VLDLs)。結(jié)果顯示,MemGlow 488和MemGlow 640對VLDLs的標記效率接近100%,而其他膜染料標記比例均低于15%(表2)。這表明MemGlow系列染料對VLDLs存在顯著性結(jié)合。
為了進一步評估膜染料在復雜環(huán)境中的標記特異性,研究者利用血漿來源EVs進行測試。結(jié)果顯示,CMDR、MemGlow 488和MemGlow 640呈現(xiàn)出較高的標記效率,而ExoBrite 640/660、CTDR和ExoBrite 490/515的標記比例均低于15%(表2)。
綜上結(jié)果表明,MemGlow 488和MemGlow 640雖在血漿EVs中具備高效標記能力,但其對VLDLs的強非特異性親和力會干擾復雜樣品中EVs的準確檢測,限制了它們的應用場景。而CMDR不僅能高效標記血漿EVs,同時對VLDLs的非特異性結(jié)合較低,更適合在復雜生物樣本中使用。
表2. 膜染料標記VLDLs和血漿來源EVs陽性率
五、膜染料亮度對比
熒光強度是評估染料性能的關鍵指標之一,它直接關系到EVs在不同靈敏度儀器的檢測效果。高亮度的染料不僅能夠提升對微小細胞外囊泡的檢測能力,還能在低靈敏度儀器上實現(xiàn)EVs的有效檢出。這不僅拓寬了EVs的檢測范圍,還能提高檢測效率和準確性。為了量化評估染料的亮度,研究者提出了染色指數(shù) (stain index) 的概念。染色指數(shù)是熒光陽性群體與陰性群體的MFI差值與陰性群體熒光背景水平的兩倍標準差的比值。染色指數(shù)越高,表明染料的亮度越高。結(jié)果顯示,MemGlow 488的亮度最高,染色指數(shù)高達242.4(圖5a)。相比之下,ExoBrite 490/515和ExoBrite 640/660的亮度較低,染色指數(shù)分別為12.5和10.0(圖5b)。此外,nFCM原始信號脈沖圖直觀呈現(xiàn)了不同染料標記的EVs的熒光信號強度差異(圖5c, d),進一步驗證了上述量化分析結(jié)果,為染料選擇提供了可視化依據(jù)。
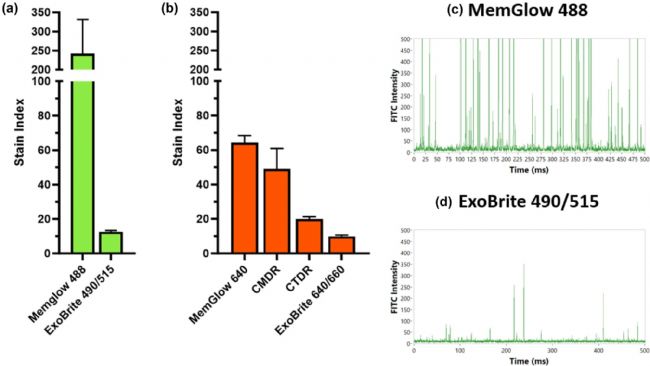
圖5. 不同膜染料的熒光亮度
總結(jié)
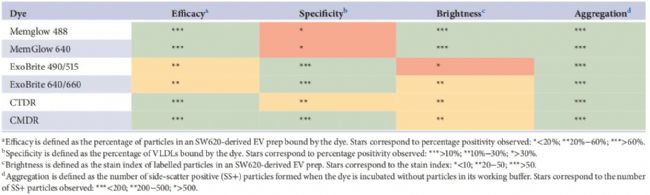
研究者從標記效率、特異性、亮度和自團聚四個方面系統(tǒng)性評估六種膜染料在EVs標記中的性能(表3)。結(jié)果顯示,MemGlow 488和MemGlow 640在標記效率和亮度方面表現(xiàn)出色,但對VLDLs的高親和力限制了它們在復雜生物樣本中的應用。CMDR則在特異性和低背景熒光方面表現(xiàn)出色,適合在復雜生物樣本中使用。此外,研究者提出了未來研究的方向,包括拓展染料篩選范圍、優(yōu)化標記方法、多平臺驗證以及選取更多樣化的臨床樣本等。這些發(fā)現(xiàn)不僅為EVs研究中染料的合理選擇提供了科學依據(jù),也為改進EVs標記技術(shù)、評估/優(yōu)化分離純化流程、制定EVs質(zhì)量控制標準提供了新思路,有望進一步推動EVs的臨床應用。
表3. 膜染料性能對比
- 納米流式檢測技術(shù) (nFCM) 評估六種膜燃料標記細胞外囊泡的性能研究
- 模擬HIV膜融合機制開發(fā)的創(chuàng)新病毒樣顆粒T-FVLPmCAR載體技術(shù)及應用
- 納米流式技術(shù)在單顆粒水平定量分析sEVs表面的唾液酸中的應用
- ApogeeFlow納米流式協(xié)助Mayo Clinic揭示早期結(jié)直腸癌新生物標志物
- Apogee Flow助力COVID-19重癥感染導致凝血和止血障礙研究
- NanoFCM納米流式檢測技術(shù)在探究空載對LNPs結(jié)構(gòu)表征影響中的應用
- Apogee流式分析儀助力開發(fā)單細胞和單噬菌體方法監(jiān)測噬菌體感染關鍵
- JEV文獻解讀:一種新型外泌體支架蛋白的發(fā)現(xiàn)及其優(yōu)勢與應用





