LaVision雙光子顯微鏡-呼吸道網絡中的神經元活動
Glycinergic interneurons are functionally integrated into the inspiratory network of mouse medullary slices
Stefan M. Winter & Jens Fresemann & Christian Schnell & Yoshitaka Oku & Johannes Hirrlinger & Swen Hülsman
摘要:呼吸道網絡中的神經元活動功能性地依賴于抑制性突觸傳遞。我們使用雙光子顯微鏡分析了獨立吸氣“pre-Bötzinger”復合物驅動網絡的節律性切片。通過在吸氣相關的呼吸過程中分別升高或降低細胞溶質內自由鈣離子的濃度,我們識別出吸氣(96%)和“緊張性”呼氣(4%)神經元。而且,在GlyT2啟動子控制下表達EGFP的BAC轉基因的小鼠中,鈣離子成像的50%的吸氣神經元被甘氨酸化。切片中甘氨酸化神經元的吸氣過程通過整個細胞記錄的形式確認。我們同樣發現了接受來自其它甘氨酸化神經元相位抑制的甘氨酸化神經元。我們的鈣離子數據表明在節律性切片中的“pre-Bötzinger”復合物驅動網絡中的甘氨酸化神經元包含了大量的吸氣神經元。
材料與方法
實驗動物
野生型和在甘氨酸化神經元中表達綠色熒光蛋白EGFP的BAC(GlyT2-EGFP)轉基因小鼠被飼養在大學醫院Göttingen的動物飼養設施中,并按照德國生理學會、lower saxony州和德意志聯邦共和國的相關指導進行喂養。野生型和BAC(GlyT2-EGFP)轉基因型小鼠被用于制備雙光子激發顯微鏡切片,只有BAC(GlyT2-EGFP)轉基因小鼠被用于完整細胞記錄和免疫組織化學研究。
雙光子激發顯微鏡的鈣離子成像
腹側呼吸列的鈣離子成像由基于商業掃描頭(TriM Scope,LaVision BioTec,Bielefeld,Germany)的用戶定制的雙光子顯微鏡實現。在這個掃描頭中,脈沖紅外激光束可以被分解為高達64個一連串的焦點,在沒有增加光損傷的同時增加單位時間內發射熒光的數量。掃描頭被安裝在一個固定載物臺的正置顯微鏡(Axioscope FS2, Zeiss, Oberkochen, Germany)上,使用X40(0.8NA)或X63(1.0NA)的水浸物鏡(Zeiss, Oberkochen, Germany)。雙光子激發通過一個裝配了寬帶光學器件的Ti:Sa激光器(MaiTai BB, Spectra Physics, Darmstadt, Germany)獲得。對于釋放熒光的場檢測,我們使用CCD相機(Ixon 885 Andor Technology, Belfast, Northern Ireland, or PCO; Sensicam QE; Kehlheim, Germany) 快速鈣離子成像我們使用多束激光模式(16 或32 束),掃描場為200 X 200μm (Ixon camera) or 170 X 220μm (Sensicam QE)。曝光時間為25–40 ms (4×4 binning=255×256 pixel) ,采樣頻率為10 到 30 Hz. 為了獲取更高的分辨率,激發光束增加到64束,以長積分時間的非像素聯合模式成像。激光能量用掃描頭中的半波板和偏振層板控制,以“ImSpector”成像軟件(LaVision BioTec, Bielefeld, Germany)控制, 10μm 步長的3D堆棧使用一個piezo-focus (Physik Instrumente, Karlsruhe, Germany)來確定深達100μm的呼吸神經元的空間分布。 組織更深處的細胞無法確認邊界。顯微鏡也裝配了兩個光電倍增器(Hamamatsu Photonics, Hamamatsu,Japan)用于非掃描熒光檢測,用于高分辨率掃描和1μm的z軸堆棧 (Fig. 2).
主要結果
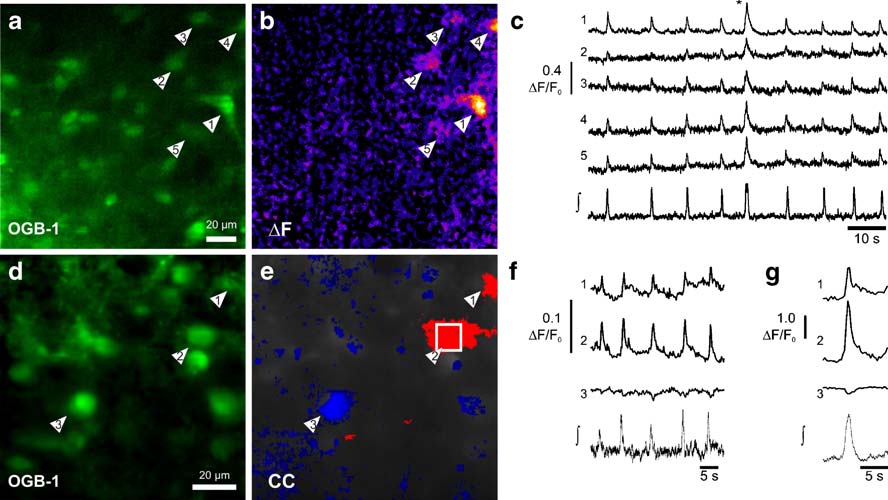
Fig. 1節律性切片中呼吸神經元的雙光子激發顯微圖像。
A由多焦點雙光子激發顯微鏡觀察到的俄勒岡綠BAPTA1-AM (OGB-1-AM) 標記的位于腹側呼吸列中的神經元。b.一次較大的呼吸活動:ΔF圖像在C中型號標記的時刻獲取,展示了5個神經元細胞(箭頭處)中的鈣離子濃度變化(橙色)。c 同時記錄了群場勢能(∫)和細胞內自由細胞溶質鈣離子瞬變。C中的跟蹤曲線表示了來自5個呼吸神經元(a、b中箭頭處)的鈣離子變化(ΔF/F0)。d.俄勒岡綠BAPTA1-AM標記的呼吸神經元。e. 交叉區域(CC)呼吸神經元鈣離子信號的假彩圖。紅色表示吸氣神經元 (CC>0.8),藍色表示一個呼氣神經元的吸氣抑制 (CC<−0.3)。f.d和e中表明的三個神經元鈣離子變化(ΔF/F0)及場勢能(∫)的同步記錄
g循環觸發的十次連續呼吸活動的與f中數據同樣的平均值
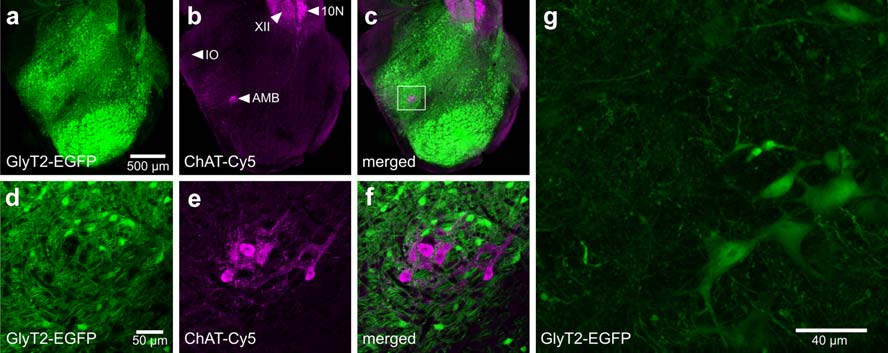
Fig. 2 延髓尾段中EGFP標記的甘氨酸化神經元的分布
a–c 概觀了BAC(GlyT2-EGFP)-小鼠EGFP標記的甘氨酸化神經元 (a) 和延髓尾段中膽堿乙酰轉移酶(ChAT)的表達 (b). ChAT抗體使用Cy5結合的熒光二抗通過共聚焦激光掃描顯微鏡檢測。C中顯示了兩個通道的疊加。
d–f通過高水平CHAT表達確認的疑核區域放大。 (e).疑核致密部發現的非甘氨酸化神經元. f.d和e的疊加,揭示CHAT陽性神經元中沒有EGFP的表達。XII舌下神經核,IO下橄欖體,10N迷走神經背核,AMB 疑核。g.這一版顯示了甘氨酸化神經元的形態。82幅圖像合成的最大密度投影,來自于雙光子激發顯微鏡掃描(步長1um)
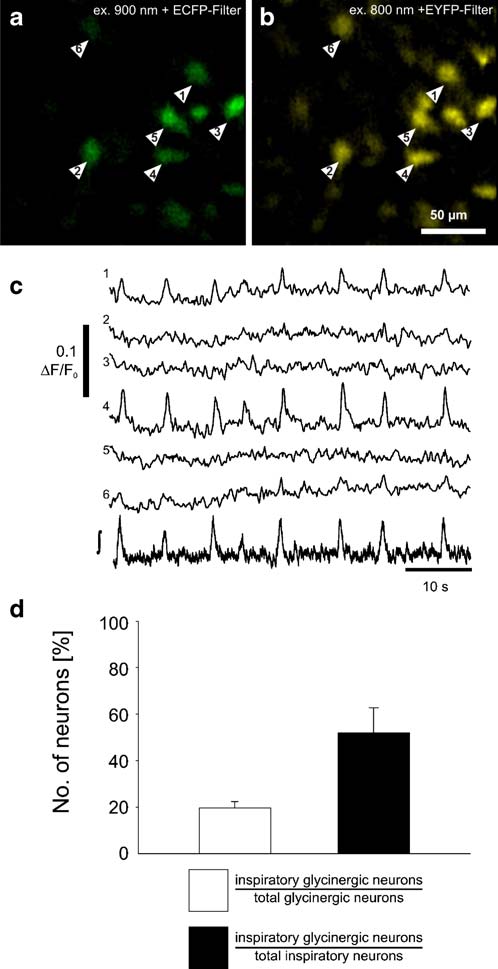
Fig. 3 甘氨酸化神經元中節律性鈣離子瞬變。a 通過雙光子在900nm激發,以帶有CFP優化濾波器(465–495 nm)的CCD檢測,確認GlyT2-EGFP神經元(箭頭)b 通過使用800nm激發波長和一個501–551 nm發光帶通濾波器顯示和測量的 OGB-1-AM熒光.所有的GlyT2-EGFP 細胞 (a) 都被OGB-1-AM (b)標記. c 從甘氨酸化神經元細胞記錄的胞內自由細胞溶質鈣離子瞬變。跟蹤曲線的條數相應于圖像a和b中神經元的個數。下面的跟蹤曲線(∫)顯示的是來自preBötC的積分的群場勢能。d 實驗的圖像綜合。左軸(白色)顯示吸氣EGFP表達的甘氨酸化神經元(占總甘氨酸化神經元)的比例,右軸(黑色)顯示的是吸氣甘氨酸化神經元(占總吸氣神經元)的比例。數據基于5張切片的20幅圖像,以mean±SEM 的形式給出。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





