干貨:腺相關病毒(AAV)技術快速入門手冊
腺相關病毒(AAV)作為一種安全、持久、高效、高特異性的基因操作工具,在生物學特別是神經生物學領域中被廣泛使用。許多新手對于AAV的使用往往是知其然而不知其所以然。這篇短文將以圖文結合的形式爭取讓大家在最短的時間內全面了解這種病毒工具。
什么是AAV?
野生型AAV是一種復制缺陷型微小病毒,需要腺病毒或皰疹病毒幫助其在體內復制擴增。而我們做實驗用的是不需要輔助病毒的重組AAV病毒(rAAV)。將目的基因的CDS區序列或者RNAi干擾序列插入rAAV表達質粒中,包裝病毒,然后直接使用rAAV感染細胞就能完成目的基因操作。
什么時候用rAAV?
當我們需要對特定基因進行過表達或干擾時,特別是做動物實驗的時候,就可以使用rAAV病毒。針對不同的實驗需求,下表可以幫助您選擇合適的病毒工具。
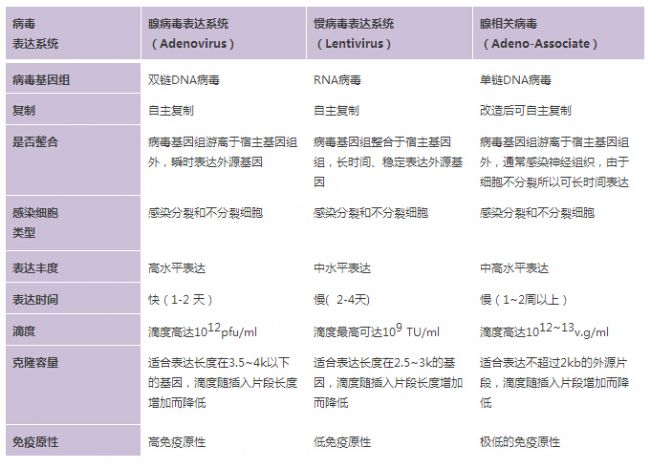
rAAV的優點是什么?
1.安全性高,目前還沒有發現AAV對人體致病;每10個人中就有8個人在一生中會感染AAV,而rAAV更是去除了96%的AAV基因組,進一步確保了安全性。目前唯一通過歐盟藥監局的基因治療藥物Glybera也是一種rAAV。
2.免疫原性低:當AAV用局部大劑量感染肌肉、腦、眼等組織時,很少有感染上的細胞之后被免疫系統所清除。這種特性對于動物實驗上顯然極有幫助。
3.感染譜廣:幾乎所有處于分裂期和靜止期的細胞都可以使用AAV來感染。
4.表達時間長:rAAV可在宿主細胞中形成附加體(episome)存在于細胞核中,在細胞分裂不旺盛的組織中可持續表達5個月以上。
5.擴散性強:rAAV具有遠高于腺病毒和慢病毒的擴散性,可以穿透血腦屏障,是最理想的神經元和膠質細胞感染工具。
6.高穩定性:rAAV病毒可使用冰袋運輸,并且對氯仿等試劑具有抗性
7.特異性強:rAAV有十數種常用的血清型,不同的血清型對不同的臟器有較高的識別及感染能力。
rAAV的局限性有哪些?
1.體外實驗表達水平較低:主要是因為rAAV病毒的基因組是單鏈DNA,在體外環境形成雙鏈并轉錄翻譯外源基因的效率非常低。可以在體外水平感染rAAV病毒的同時感染輔助病毒比如Ad5型腺病毒或者終濃度10~50mM的丁酸鈉等方法提高細胞實驗的rAAV表達量。
2.需較長時間開始表達:同樣是需要從單鏈DNA變成雙鏈DNA,rAAV在感染后需要較長的時間來表達外源基因,所以rAAV感染后建議至少1周后做切片觀察。
怎么選擇合適的rAAV血清型?
目前文獻中使用最多的rAAV血清型包括2,5,8,9。這幾種血清型基本涵蓋了所有組織和臟器的特異性感染,吉凱基因也可以提供這些常用血清型的rAAV改造和包裝服務。下圖是常用血清型所對應的組織臟器總結:
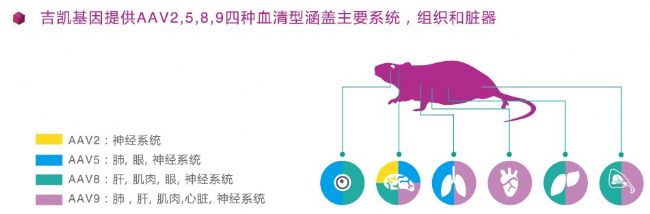
怎樣實現器官/細胞特異的表達?
很多時候我們需要在特定的器官/細胞中表達外源序列而不影響其他臟器,這時我們有以下幾種策略:
1.局部注射,顧名思義就是直接在想表達的地方注射rAAV就可以了,適合器官水平特異感染,容易操作。
2.使用組織/器官特異啟動子來表達外源基因包裝rAAV,此類rAAV即使感染了其他組織也由于特異性啟動子而不會在其他組織中表達。
3.Cre-on,Flex,DIO,double floxed這些技術名稱經常在文獻中被提及,其實都是一回事,就是使用Cre-Loxp系統,經過兩次染色體重組在特定臟器中表達外源基因。前提是我們需要獲得特定的Cre小鼠后才可以使用這個技術。Cre-on系統的技術原理如下:
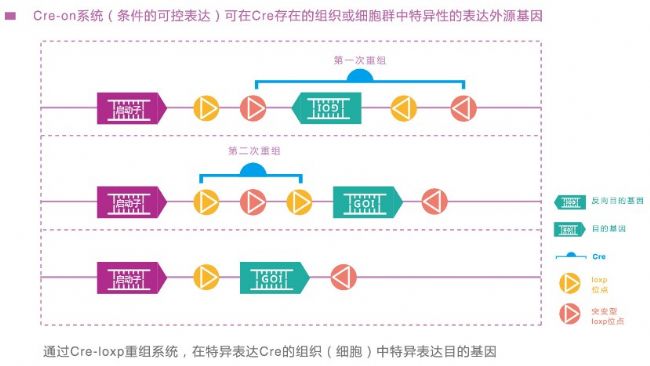
吉凱基因可以提供適合各種器官/細胞特異表達的rAAV工具滿足實驗需求。
體內使用rAAV的操作注意點有哪些?
1.小鼠的操作通過尾靜脈注射的rAAV量推薦在10E11~12v.g數量級,體積推薦在100~200ul;針對腦部的感染建議用量參考下表:
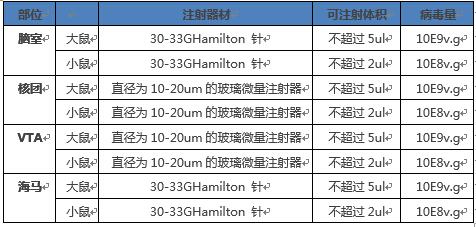
2. 在實驗過程中稀釋病毒產品的等滲溶液沒有其他特殊要求,常規的動物試驗用等滲溶液即可,如PBS、生理鹽水等。
體外使用rAAV的操作注意點有哪些?
1.胰酶會破壞細胞表面的rAAV病毒受體,因此需要在胰酶消化12h后再進行rAAV感染操作。
2.如感覺rAAV感染效果不佳,可嘗試去除血清。
3.rAAV與細胞的吸附過程非常迅速,需要實現混勻后再處理細胞,不然會出現局部未被感染的情況。
4.rAAV感染不需要添加慢病毒助感染試劑諸如polybrene等。
用完后怎么處理?
對AAV最有效的消毒劑是新鮮配制的1%次氯酸鈉溶液:
1. 配制時,將84消毒液原液加水稀釋
2. 浸泡15 min以達到消毒目的
3. 可以用它處理可回收的物品如玻璃器皿或是污染廢液(終濃度是1%),但如果是不銹鋼器物切不可直接擦拭,否則會引起表面腐蝕。
其他的處理方式包括用2%戊二醛溶液或是0.25% SDS溶液,還可以121℃高溫消毒1小時。
本文列舉了一些常見的rAAV問題,如有在具體實驗中遇到其他問題也歡迎聯系當地吉凱基因業務員或撥打全國免費技術支持熱線800-720-0302咨詢。






