【SCI文章解析】lncRNA UICLM通過ceRNA機制調控結直腸癌的肝轉移
中山大學附屬腫瘤醫院院長、主任醫師徐瑞華教授長期從事消化道腫瘤個體化治療領域及抗癌藥物研究,在消化道腫瘤的轉移與轉歸、化療藥物耐受及其機制和優化臨床治療方面具有國際領先的創新性成果。近期,該課題組應用Arraystar lncRNA芯片在肝轉移的結直腸癌組織中分析了lncRNAs的表達情況。課題組篩選到與結直腸癌肝轉移顯著相關的lncRNA UICLM,并闡明了lncRNA UICLM在結直腸癌肝轉移中的功能和調控機制。該研究成果于2017年發表在國際著名學術期刊Theranostics(IF = 8.766)上。(芯片實驗由康成生物提供技術服務)
研究背景
結直腸癌(CRC)是世界上第二大常見和第三大引起死亡的惡性腫瘤疾病。盡管近年來CRC的治療已取得了巨大的進展,但是效果還不盡人意。CRC晚期會發生腫瘤轉移,其中最常見的是肝轉移。肝轉移患者預后非常差,生存率很低。長鏈非編碼RNAs(lncRNAs)是一類長度大于200nt的轉錄本,lncRNAs的異常表達和癌癥的發生有著緊密的聯系,如HOTAIR、MALAT1和H19等在癌癥的發生中扮演著重要的角色。雖然已經有越來越多的lncRNAs被挖掘和注釋,但是lncRNAs在CRC肝轉移中的功能和分子調控機制目前仍不清楚。
本研究通過lncRNA芯片篩選出與CRC肝轉移相關的lncRNAs,并通過大量的功能實驗研究異常表達的lncRNA如何調控結直腸癌的肝轉移。
研究思路
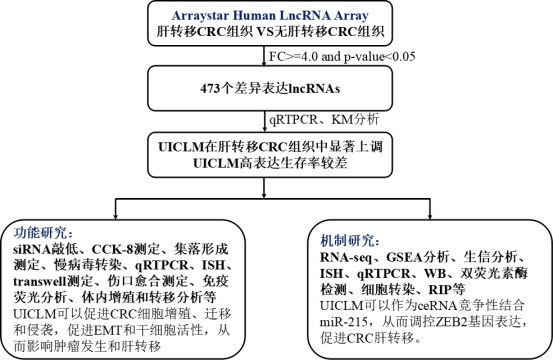
首先,作者選取了7個具有肝轉移和8個沒有肝轉移的CRC組織進行lncRNA芯片篩選(Arraystar Human LncRNA Microarray V3.0)。作者采用FC >= 4.0和p-value < 0.05的標準篩選到了493個差異表達的lncRNAs,接著對上調最顯著的12個lncRNA進行了RT-PCR驗證,其中有9個lncRNA在肝轉移的CRC組織中出現了高表達。隨后作者通過擴大樣本量驗證發現lncRNA UICLM在肝轉移的CRC組織中顯著上調。
接著,作者通過過表達和干擾實驗探究了UICLM的生物學功能。實驗表明干擾UICLM會顯著抑制細胞增殖、集落形成和細胞遷移侵襲,過表達則會出現相反表型。免疫熒光分析以及RT-PCR實驗顯示了UICLM對CRC細胞中EMT的影響。細胞注射實驗顯示注射SW620sh-UICLM細胞的小鼠肝轉移瘤的比例明顯低于注射SW620sh-NC細胞,并且肝臟轉移結節數目也顯著降低。另外,作者還發現UICLM可以影響結直腸癌細胞干性。
最后作者深入研究了lncRNA UICLM調控CRC肝轉移的分子機制。lncRNA 芯片數據分析顯示UICLM與ZEB2存在正相關,IHC和RT-PCR結果顯示ZEB2 mRNA和蛋白水平在肝轉移的CRC組織中顯著過表達。RNA-seq結果也表明干擾UICLM會導致ZEB2的表達水平明顯下降。然后,作者通過生物信息學預測發現UICLM和ZEB2具有共同結合的miRNA——has-miR-215。后續實驗表明CRC組織中miR-215的表達水平明顯下調,并且抑制miR-215會顯著增加UICLM的表達,反之,敲低UICLM顯著增加miR-215表達。最后,作者通過pull down實驗也表明miR-215和Ago2形成沉默復合物(RISC),可以結合在lncRNA UICLM的 miRNA的結合位點上。也就進一步佐證了lncRNA UICLM可以通過ceRNA機制調控靶基因ZEB2的表達。
上述研究表明CRC組織中表達水平顯著上調的lncRNA UICLM通過ceRNA機制競爭性結合miR-215來調控ZEB2的表達,從而調節EMT和干細胞特性,最終影響細胞的侵襲和轉移,促進CRC的肝轉移。
研究路線
結果展示
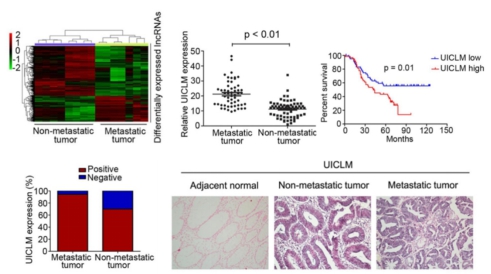
圖1芯片篩選差異lncRNA、驗證以及臨床相關性分析
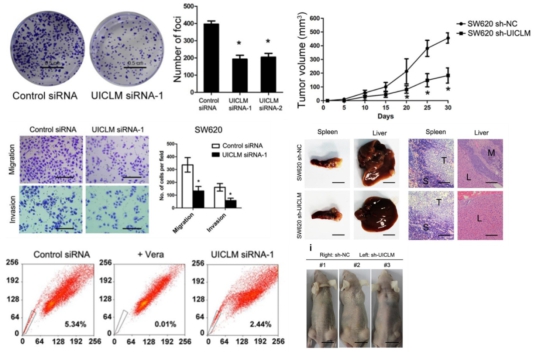
圖2 lncRNA UICLM功能實驗結果展示
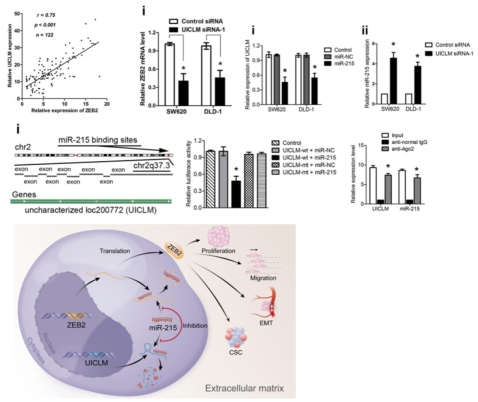
圖3 lncRNA UICLM分子調控機制模式圖
研究意義
作者借助Arraystar lncRNA芯片篩選出參與CRC肝轉移的重要指標lncRNA UICLM,并且通過功能和機制實驗表明了UICLM可以競爭性結合miR-215調控ZEB2表達,從而促進CRC肝轉移發生,這對于研究結直腸癌的肝轉移以及探究非編碼RNA的分子機制奠定了基礎。
原文出處
Long non-coding RNA UICLM promotes colorectal cancer liver metastasis by acting as a ceRNA for microRNA-215 to regulate ZEB2 expression. Theranostics. 2017.





