【客戶成果】外泌體circRNA PDE8A促進胰腺導管癌細胞侵襲
研究背景
胰腺導管腺癌(PDAC)是目前臨床上預后最差的惡性腫瘤之一,由于侵襲性強、復發率高出于癌癥相關死亡原因第6位。MET 為酪氨酸跨膜受體,是上皮細胞癌中的一個經典的原癌基因,激活后影響細胞遷移、入侵、血管生成、細胞分散、EMT和其他生物學過程。circRNA是一種內源性的非編碼RNA,首尾相接形成共價環狀結構。已報道circRNA在多種癌癥中發揮調節作用,大部分是作為miRNA的吸附海綿來發揮功能。在PDAC中circRNA的作用機制還沒有詳細的報道。
外泌體是由細胞內多泡體與細胞膜融合后,釋放到細胞外基質中的一種直徑約30~150nm的膜性囊泡。外泌體中包含多種蛋白、RNA 、以及部分DNA分子,被分泌出的外泌體會進入血液、唾液、尿液、及乳汁等體液中,通過循環系統到達其他細胞與組織,產生遠程調控作用。近期有多篇文章報道外泌體中的miRNA、lncRNA在癌細胞侵襲或代謝過程中發揮作用,PDAC外泌體中的circRNA的作用值得探究。
研究思路
為了探究外泌體中circRNA的作用,作者選取PDAC細胞系Hs 766T與高侵襲性的Hs 766T-LS提取外泌體總RNA,通過Arraystar human circRNA Array進行高通量篩選,對Hs 766T-LS細胞中顯著上調的9個指標進行qPCR驗證,circ_PDE8A
(hsa_circ_0036627)趨勢相符且在PDAC細胞系中過表達敲減顯著影響細胞侵襲。擴大樣本驗證,在胰腺導管癌和癌旁樣本中circ_PDE8A表達差異顯著(P=0.014),可以作為預后不良的biomarker。
MET是影響癌細胞侵襲的原癌基因,MACC是 MET上游主要調控因子,結合circRNA 可以作為miRNA吸附海綿的機制。通過FISH、RNA pull down、RIP實驗驗證circ_PDE8A通過吸附miR-338,抑制miR-338對下游靶基因MACC的調控。從而上調的MACC激活下游MET/AKT以及ERK通路,促進細胞侵襲。小鼠模型中驗證得到相同結果。
電鏡以及標志物CD63/CD81 WB檢測PDAC 細胞培養基中的外泌體,通過confocal驗證PDAC細胞之間可以進行外泌體攝入。Hs 766T-LS中過表達circ_PDE8A,驗證外泌體中circ_PDE8A值升高,與BxPC-3細胞共培養,BxPC-3中MACC顯著上調,促進MET 升高。小鼠中注射過表達circ_PDE8A的Hs 766T細胞,顯著促進裸鼠成瘤,且在血液中檢測到熒光標記的外泌體。提取PDAC病人血漿中外泌體,檢測circ_PDE8A表達,circ_PDE8A升高與病人的生存時間呈負相關。提示外泌體中的circ_PDE8A與PDAC的進程相關,參與癌癥的發生發展。
技術路線
結果展示

圖一、A:circRNA表達譜檢測流程;B:qPCR 驗證;C: 擴大樣本量檢測circ_PDE8A在癌癥樣本中顯著上調;D: kM 曲線分析circ_PDE8A與預后不良相關。
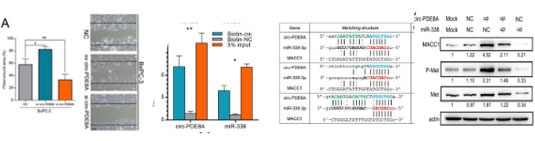
圖二、e :過表達circ_PDE8A促進細胞侵襲;f:RIP 驗證circ_PDE8A與miR-338結合;G:預測miR-338與MACC1結合;F:circ_PDE8A 通過miR-338 促進MACC1/MET 表達
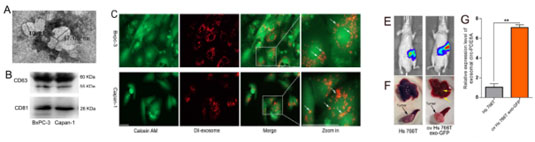
圖三、A、B :外泌體檢測;c.cofocal 觀察細胞攝入外泌體;EFG:小鼠中驗證外泌體中circ_PDE8A高表達促進癌癥發生發展
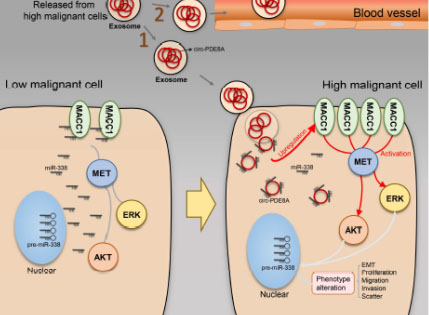
圖四: circ_PDE8A 作用機制模式圖
研究意義
該研究揭示了circ_PDE8A 通過miR-338 調控MACC1/MET途徑,影響胰腺導管癌發展;并研究了外泌體中circ_PDE8A參與細胞通訊,介導受體細胞侵襲,可以作為潛在的治療biomarker。
原文出處
Tumor-released exosomal circular RNA PDE8A promotes invasive growth via the miR-338/MACC1/MET pathway in pancreatic cancer. Cancer letters, 2018.
https://www.sciencedirect.com/science/article/pii/S0304383518303021





