細胞系開發過程中IgG檢測流程的簡化
簡介
在不同的研究人員中,以抗體為基礎的治療藥物的細胞系開發過程可能有很大不同。最終目標是找到可以穩定產生大量單克隆抗體的細胞克隆。IgG 產物檢測在開發和生產單克隆抗體的多個階段都是非常重要的一步 ( 圖 1 )。通常 IgG 定量的方法都需要專門的儀器和技術人員,例如 HPLC 和表面干涉測量,或是要花費大量時間的 ELISA 檢測 ( 酶聯免疫吸附實驗 )。盡管 ELISA 是蛋白定量的成熟方法,但它也是一種冗長的、多個步驟的實驗過程 ( 表 1 )。這里,我們向大家介紹使用 Valitacell 公司Valita®TITER實驗來檢測抗體開發和生產過程中 IgG 的方法。
ValitaTITER 實驗使用簡單“add-and-read”( 添加和讀數 ) 方式測定 2.5 ‒ 100 mg/L 濃度的 IgG。此實驗過程不到 1 小時即可完成且能夠整合到以 96 孔板為規格的生物反應工作流程中。此實驗可實現高通量和全自動。其過程可在細胞培養基中用少量樣品進行,沒有復雜的準備步驟。
可用于實驗檢測的 Molecular Devices 公司多功能微孔讀板機有:SpectraMax®iD5多功能微孔讀板機、帶熒光偏振檢測卡盒的 SpectraMax® i3x 多功能微孔讀板機和 SpectraMax® M5 多功能微孔讀板機。
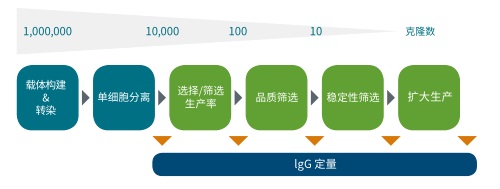
圖 1 從細胞轉染到擴大生產的細胞系開發過程
優點
- 輕松采集數據并利用 SoftMax Pro軟件的預設模板分析數據
- 快速、均相實驗,不超過 1 小時即可獲得結果
- 2.5-100 mg/L IgG 濃度范圍的精確測定
表 1 比較 ValitaTITER 實驗與其他方法在 IgG 定量檢測方面的性能表現
| ValitaTITER | 表面干涉測量 | ELISA | HPLC | |
| 總實驗時間(96個樣品) | 45min | 55-65min | 6+hours | 25-45 hours |
| 測定范圍(mg/L) | 2.5-100 | 0.025-2000 | 0.5-5 | >10 |
| 樣品體積 | 5-30 µL | 180 µL+ | 100 µL | 1-2 mL |
| 精準度 | <2% | <5% | <5-10% | <2% |
實驗原理
ValitaTITER 實驗基于對 IgG Fc 片段與蛋白 G 的相互作用采用熒光偏振 ( FP )技術檢測。96 孔微滴度板的每個孔中都包被有熒光標記的 IgG 結合多肽,蛋白 G。當加入樣品到孔板中時,蛋白G 分子被重懸并發生結合。一旦結合抗體,蛋白 G 分子的運動速率便會下降,導致熒光偏振 ( FP ) 值的增加 ( 圖 2)。
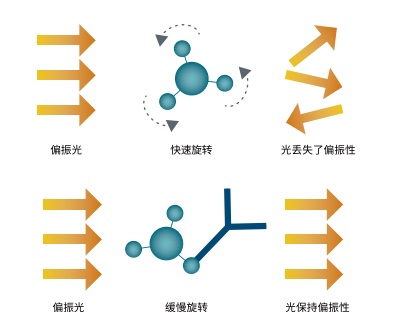
圖 2 ValitaTITER 實驗原理使用 FP 技術檢測。自由的蛋白 G 分子很小且在緩沖液中快速旋轉。結果是偏振激發光丟失了偏振性 ( 上圖 )。當蛋白 G 分子在樣品中結合了抗體,較大的復合體旋轉就會減慢導致 FP 值的增加 ( 下圖 )
材料
• ValitaTITER 檢測試劑盒(Valitacell cat. #00010)
• IgG 蛋白標準品 (Sigma cat. #I2511)
• CD CHO 培養基(Thermo Fisher Scientific cat. #10743011)
• 實驗過程中的樣品:懸液培養產生CHO 細胞系的重組 IgG 培養上清液
• 安裝有 535-nm FP 發射濾片的SpectraMax iD5 多功能微孔讀板機
• 帶有熒光偏振 ( FP-FLUO ) 檢測卡盒的 SpectraMax i3x 多功能微孔讀板機
• SpectraMax M5 多功能微孔讀板機
方法
IgG 標準品梯度稀釋到 CD CHO 細胞培養基中使濃度在 2.5 和 100 mg/L 之間。細胞培養上清中的一系列 IgG 樣品按需要稀釋到細胞培養基中。加入 60 µLValitaMab 重組緩沖液到 ValitaTITER板的每個孔中,然后再迅速加入 60 µL準備好的細胞樣品或蛋白標準品。混勻樣品或標準品并在室溫下避光孵育30 分鐘。在 SpectraMax iD5 讀板機上 使 用 內 置 的 光 柵 光 路 激 發 并 用535-nm 發射濾片檢測FP 信號。使用SoftMax Pro 軟件中的預設模板獲取數據并進行分析 ( 圖 3 )。同樣在Spectra-Max i3x 和 SpectraMax M5 讀板機上檢測 FP 以驗證它們的性能表現 ( 數據未示 )。
用蛋白 A 的 HPLC 數據對比。根據生產廠家操作說明進行實驗。

圖 3 ValitaTITER 實驗流程。(A) ValitaMab 重組緩沖液加入到 ValitaTITER 板的每個孔中。(B) 樣品或 IgG 標準品加入到孔中。(C) 孔板孵育 30 分鐘為結合的發生。(D) 使用 SoftMax Pro 軟件在SpectraMax iD5 讀板機上檢測 FP
結果
ValitaTITER 實驗利用簡單的“add-and-read”( 添加和讀數 ) 方式獲得 IgG 標準曲線,中間無洗滌步驟且只需少量樣品 ( 5-30 µL )。在 SpectraMax iD5讀板機上使用內置的光柵激發光路和535-nm FP 射濾片可獲得最佳結果。濃度從 3.1 到 100 mg/L 的標準品所檢測到的結果在整個濃度范圍內均保持了高度線性 (r 2 = 0.998) ( 圖 4 )。Spectra-Max i3x 和 SpectraMax M5 讀板機也獲得了相似的數據 ( 數據未展示 )。SoftMax Pro 軟件中的預設模板可自動計算出 mP 結果并繪制曲線圖。對進料間歇反應器條件培養基樣品的ValitaTITER 實驗結果與 HPLC 進行了
比較。兩種方法呈現出高度的一致性,r 2 = 0.994 ( 圖 5 )。
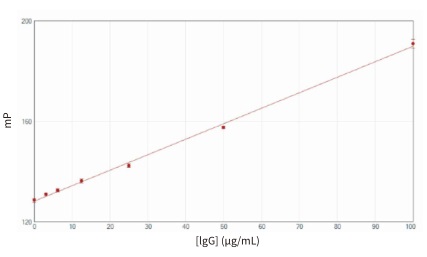
圖 4 使用 ValitaTITER 實驗在 SpectraMax iD5 讀板機上生成 IgG 標準曲線。數據采用SoftMax Pro 軟件中的線性擬合繪制曲線圖 (r 2 = 0.998)。誤差線表示 6 個重復標品的標準偏差
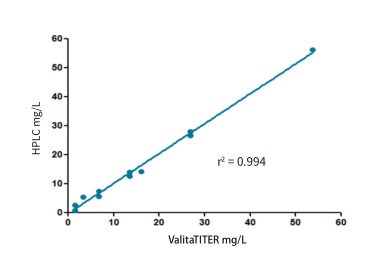
圖 5 ValitaTITER 實驗的 IgG 定量結果和蛋白 A 的 HPLC 分析結果進行比較。進料間歇生物反應器中一系列條件培養基的 IgG 滴度通過 ValitaTITER 熒光偏振實驗進行定量。這些樣品同樣也通過蛋白 A 的 HPLC 進行分析
總結
IgG 定量必須在細胞系開發過程的多個步驟中進行以保證最終擴大化生產的產品質量,因此一種以盡可能少的時間獲得最準確結果的測定方法對成功至關重要。這里我們展示了由 ValitaTITER實驗得到的IgG 定量數據與 HPLC 的分析結果高度匹配,后者被廣泛認為是檢測的金標準,然而前者所需的時間還不到 HPLC 的 3% 。ValitaTITER 實驗是一種均相的、高通量的方法,可在細胞系開發工作流程中精確快速的檢測 IgG 含量。這種實驗的96 孔板檢測已在 SpectraMax iD5 讀板機和其他具有 FP 功能的 MolecularDevices 公司讀板機上被充分驗證通過,保證結果的可靠性。而 SoftMax Pro 軟件則大大減少檢測參數的設置時間并自動擬合標準曲線和計算樣品濃度。






