Biopen助力肌球蛋白Ⅱ調節輕鏈在活細胞內磷酸化動態過程的定量觀測
調節輕鏈(RLC)的磷酸化引起非肌肉肌球蛋白Ⅱ(NMMⅡ)與肌動蛋白纖維的匯合,從而導致肌動球蛋白細胞骨架的形成與收縮。NMMII在細胞骨架動力學過程中發揮重要作用,但是如何在亞細胞水平精確的調控RLC的磷酸化水平仍舊未知。
目前的研究手段并不適合用于觀測活細胞及生物體內的RLC磷酸化。例如使用雙色熒光共振成像技術的局限在于:占用大部分可用光譜導致無法兼容其它光學傳感器并且存在光毒性與光漂白現象。本研究開發了一種同源FRET方法用于觀測熒光蛋白標記的RLC磷酸化。

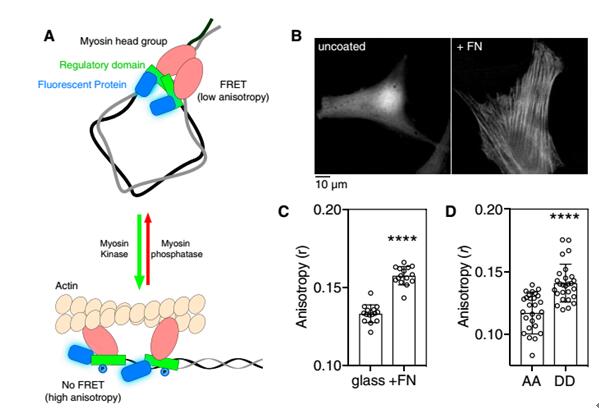
如圖1A所示,磷酸化導致RLC二聚體的解離,減弱FRET,異向性增加。將融合有熒光蛋白的RLC轉染至成纖維細胞分別培養在玻璃皿及鍍有纖連蛋白的玻璃皿中,發現鍍有纖連蛋白的實驗組異向性顯著升高。并且RLC突變體AA(缺少磷酸化位點)實驗組的異向性明顯降低。
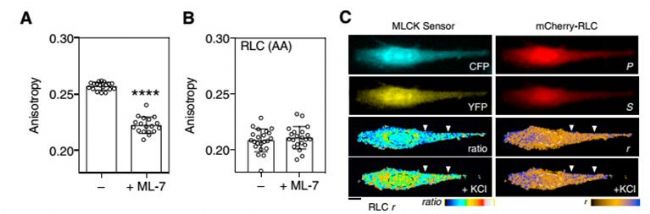
接下來使用mCherry-RLC來探究活細胞內RLC-FRET的動力學。MLCK能夠磷酸化RLC,如圖2A所示,ML-7處理抑制MLCK活性后,mCherry-RLC的異向性明顯降低。將mCherry-RLC同MLCK FRET生物傳感器共表達,使用KCL激活MLCK后,細胞質內mCherry-RLC的極化也同樣增加。
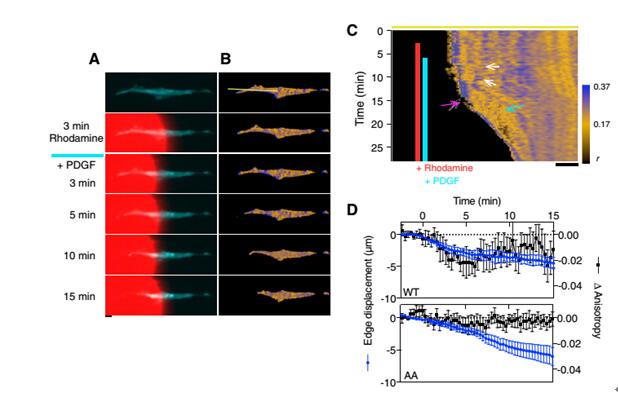
接下來,研究人員需要進行單細胞刺激以觀察亞細胞水平的肌球蛋白磷酸化動態過程。在細胞收縮前,細胞外突出包含穩定的高異向性磷酸化區域(圖3B),之后使用Biopen對細胞外突出進行PDGF刺激,瑞典Fluicell公司的單細胞微流控給藥系統Biopen采用高端的微流控技術,可以在顯微鏡下精確的控制液體覆蓋范圍,如圖中若丹明紅色染料所覆蓋區域即為本次實驗的刺激區域。首先,細胞骨架收縮10-20μm(圖3C,白色箭頭),收縮前端的RLC異向性的提高(圖3C,粉色箭頭前方),肌球蛋白的去磷酸化,包括收縮前端(圖4C,粉色箭頭下方)和內部(圖3C,藍色箭頭)。整個過程收縮邊緣肌球蛋白RLC的異向性改變定量統計見圖3D,mCer3-RLC(AA)邊緣的異向性無明顯改變,野生型的RLC異向性明顯降低。
Biopen利用吸入流的流速高于注入流的流速所形成的表面張力,自動形成液流回路,將細胞培養體系與灌流液體通過虛擬邊界分離,產生局部液流腔。液流腔的大小可控制在培養細胞或組織中單個細胞周圍的環境。5-25nL/s亞秒級的給藥速度,可實現4種不同藥液的快速切換。
借助于我們的單細胞微流控給藥系統,研究人員完成了單細胞水平的肌球蛋白磷酸化研究,建立了一種兼容多種不同熒光蛋白與生物傳感器的檢測方法,可以說Biopen實乃單細胞研究領域的一大利器!

Biopen 技術優勢
★精確的單細胞或多細胞藥物環境控制分子;
★低藥物消耗,35µL/孔;
★4種溶液快速切換;
★無需清洗;
★非接觸式給藥,無污染;
★槍頭頂部非玻璃材質高分子軟性材料,不易碎,避免損傷細胞;
★最大限度利用培養的細胞;
★兼容各大品牌正倒置顯微成像系統;
Biopen 應用領域
★酶學;
★電生理;
★藥理;
★組織病理;
★藥物發現;
★生物打印;





