應用紀要:輕斷食促健康奧秘-靶向肝臟線粒體機制
隔日禁食 (ADF)是目前流行的熱量限制形式之一,已有動物及臨床研究顯示ADF可改善代謝健康,但其驅動機制尚不清楚。有研究發現ADF可能在胰島素敏感性方面具有重要作用,而肝臟在胰島素作用和血糖管理方面都發揮著至關重要的作用,其中與復雜的線粒體代謝密不可分。但肝臟線粒體是否參與或如何參與ADF介導的代謝益處尚不清楚。西安交通大學馮智輝/劉健康教授團隊等通過代謝組學等技術揭示肝臟在ADF介導的代謝益處的關鍵作用,并表明靶向肝臟線粒體復合物Ⅱ可能是對抗代謝紊亂的新策略,相關成果發表于《Advanced Science》。麥特繪譜提供代謝組學檢測服務。

1. ADF通過擾亂線粒體復合物Ⅱ組裝促進肝臟代謝重塑
本研究中,小鼠接受定期喂養或ADF干預4周,每4天監測一次體重和食物攝入量。ADF組小鼠在干預1周后體重增加減慢,而兩組之間食物攝入量相當。ADF組小鼠血清 ALT、AST、TC、TG、肌酐、尿素和空腹胰島素水平與對照組無顯著差異,而ADF組小鼠葡萄糖耐量和胰島素敏感性顯著提高。肝臟組織代謝組學研究發現47種代謝物在ADF和對照組之間存在顯著差異,這些變化主要與氨基酸代謝有關。
由于線粒體是將非必需氨基酸代謝與三羧酸(TCA)循環耦合的關鍵細胞器,隨后對線粒體展開相關研究。結果表明,在肝臟組織中,電子傳遞鏈 (ETC)五種復合物中只有線粒體復合物Ⅱ(又稱線粒體琥珀酸脫氫酶,SDH)活性在ADF組中顯著降低,而其在外周組織則無顯著差異。線粒體復合物Ⅱ四個亞基mRNA轉錄和蛋白表達水平無差異,且ADF也未改變其他線粒體復合物亞基mRNA轉錄水平。但是,ADF顯著改變線粒體復合物Ⅱ組裝因子——琥珀酸脫氫酶組裝因子 2 (SDHAF2) 和 SDHAF4蛋白質表達水平。其中,ADF不僅顯著降低了 SDHAF4蛋白表達水平,且導致SDHAF4與SDHB結合減少,從而破壞了SDHA與SDHB進一步結合。因此,ADF干預誘導線粒體復合物 Ⅱ 活性降低,主要原因為SDHAF4表達降低進而抑制線粒體復合物 Ⅱ的組裝(圖 1)。
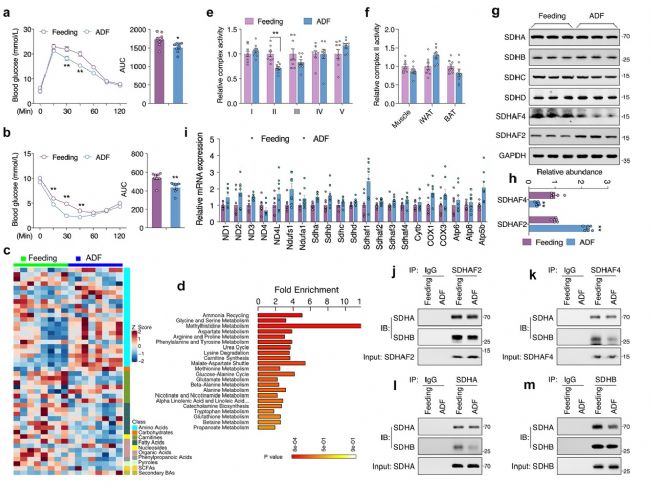
圖1. ADF通過抑制線粒體復合物Ⅱ的組裝促進肝臟代謝重塑
2. 肝臟Sdhaf4敲除抑制線粒體復合物II,但不影響表型
構建肝臟特異性Sdhaf4基因敲除小鼠(Sdhaf4Alb KO)進一步探索肝臟SDHAF4介導的復合物Ⅱ功能障礙對代謝的影響。結果顯示,Sdhaf4敲除對小鼠血清ALT、AST、TC、TG水平無顯著影響。與ADF組小鼠一致,Sdhaf4Alb KO小鼠線粒體復合物亞基表達水平趨勢相似,SDH亞基SDHA和SDHB蛋白水平顯著降低,而復合物 ⅡI、IV和V活性降低不顯著。SDHA/SDHB結合和泛素修飾的免疫沉淀分析表明SDH蛋白水平降低歸因于泛素修飾增強和蛋白降解。
線粒體復合物 Ⅱ 活性降低會抑制線粒體三磷酸腺苷 (ATP)產生,結果表明,在Sdhaf4Alb KO小鼠和ADF組小鼠中,ATP產生減少。不過ATP產生減少并未影響AMPK、mTOR信號、線粒體自噬活性。HE染色結果表明, Sdhaf4Alb KO小鼠肝臟結構正常。電子顯微鏡顯示Sdhaf4Alb KO小鼠線粒體微觀結構和數量未改變,這表明,肝臟中SDHAF4的缺失會抑制線粒體活性,但不會引起劇烈的線粒體應激。Sdhaf4Alb KO小鼠表現出正常的能量代謝,包括總活動、O2消耗、CO2產生、熱量產生、食物攝入和呼吸交換。Sdhaf4Alb KO小鼠糞便成分和卡路里變化與對照組相似。對肝臟進行膽汁酸譜檢測,鵝去氧膽酸 (CDCA) 和 7-酮石膽酸 (7-Keto LCA)發生顯著改變。總之,肝臟中SDHAF4缺失對小鼠的能量吸收/利用無顯著影響(圖2)。
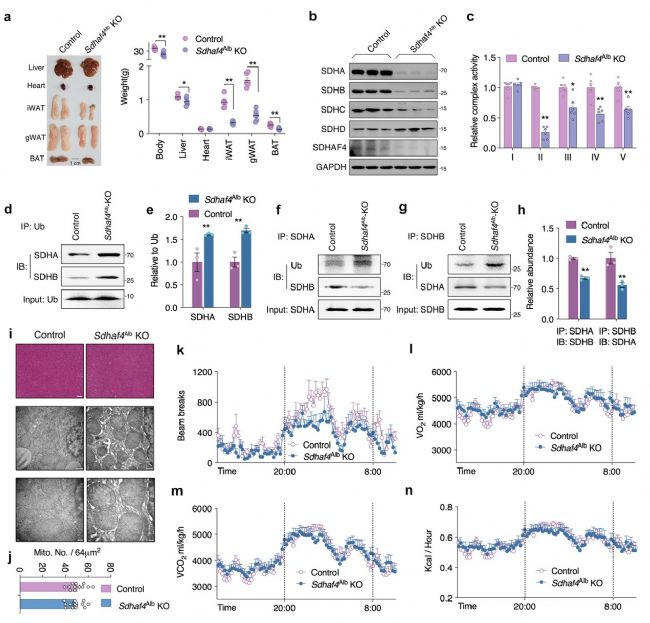
圖2. 肝臟Sdhaf4敲除破壞線粒體復合物,但不影響表型
3. Sdhaf4 敲除提高小鼠全身代謝敏感性
Sdhaf4Alb KO和對照小鼠之間血脂、空腹血糖和空腹胰島素水平保持相似。不過Sdhaf4Alb KO小鼠口服葡萄糖耐量和胰島素敏感性顯著改善,與ADF組一致。此外,KO小鼠在胰島素誘導后肝臟、肌肉(股四頭肌)和腹股溝白色脂肪組織(iWAT)中絲氨酸/蘇氨酸激酶(Akt)磷酸化顯著增加。通過轉染腺病毒來過表達肝臟Sdhaf4,結果表明,Sdhaf4過表達顯著恢復Sdhaf4Alb KO小鼠肝臟中的SDHA和SDHB蛋白水平,而不影響血清脂質水平。同時,過表達并未改變對照小鼠的葡萄糖和胰島素耐受性,但顯著降低Sdhaf4Alb KO小鼠的葡萄糖和胰島素耐受性。在恢復SDHAF4水平后,Sdhaf4Alb KO小鼠Akt 磷酸化也降低,進一步說明肝臟SDHAF4缺失對改善全身代謝能力的驅動作用。此外,對 Sdhaf4Alb KO小鼠進行長達12個月的觀察及小鼠肢體力量測試等分析,揭示對照組和Sdhaf4Alb KO小鼠在 2、6 和12個月齡存在相似變化,提示抑制肝臟線粒體復合物 Ⅱ 組裝可能是改善全身代謝益處安全有效的策略(圖 3)。
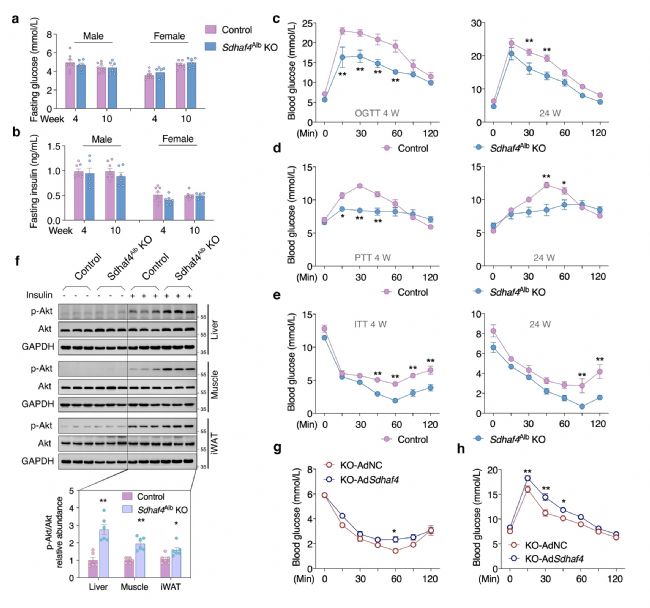
圖3. 肝臟 Sdhaf4 敲除提高小鼠的全身代謝敏感性
由于肝臟SDHAF4缺失改善了代謝能力,隨后評估對代謝應激的益處。在喂食高脂飲食(HFD)12 周后,Sdhaf4Alb KO小鼠表現出對 HFD誘導的體重增加的顯著抵抗,以及對WAT 增加的抵抗,肝臟、棕色脂肪組織 (BAT)、性腺 WAT (gWAT) 和 iWAT 的H&E染色結果進一步佐證。此外,HFD喂養下Sdhaf4Alb KO小鼠肝臟甘油三酯和總膽固醇水平顯著降低。Sdhaf4Alb KO小鼠在 HFD 喂養下仍表現出葡萄糖和胰島素耐受性顯著改善。同時,肝臟、肌肉和 iWAT 中胰島素刺激的 Akt 磷酸化顯著增加。這些結果表明Sdhaf4Alb KO小鼠在常規甚至HFD 環境下都保持較好的代謝敏感性(圖4)。
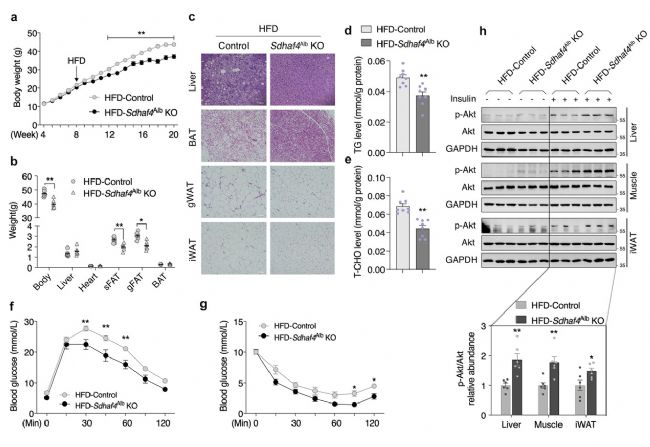
圖4. 肝臟中SDHAF4的缺失保護小鼠免受代謝壓力
4. 抑制線粒體復合物 Ⅱ 組裝可促進氨基酸代謝
在線粒體五種復合物中,復合物Ⅱ是唯一已知的同時參與 TCA 循環和電子傳遞鏈的復合物。SDHAF4缺失破壞了復合物Ⅱ的組裝,從而促進SDH亞基降解。因此,猜測Sdhaf4Alb KO小鼠肝臟TCA活性發生顯著抑制。將對照組和Sdhaf4Alb KO小鼠肝組織進行代謝組學研究,Sdhaf4Alb KO小鼠肝臟中氨基酸增多和碳水化合物降低。生化檢測和染色結果表明, Sdhaf4Alb KO小鼠糖原水平降低。糖原基因Pgc-1、FoxO1、Pck1和G6pc表達顯著降低,表明糖異生受到抑制,這可能是由于胰島素信號傳導增加所致。
SDHAF4缺失影響了TCA循環中的富馬酸和蘋果酸水平,且它們在 Sdhaf4Alb KO小鼠顯著增加,提示存在響應SDH功能障礙的補償通路。盡管 Sdhaf4Alb KO小鼠和ADF組小鼠ATP水平均降低,但NAD+和NADH均無顯著影響,表明盡管SDH活性受到抑制,Sdhaf4Alb KO小鼠和ADF組小鼠仍能實現功能性TCA循環。通路富集結果表明,氨基酸代謝是受影響最大的通路。已有研究報道精氨酸代謝與TCA循環密切相關。精氨酸由精氨酸琥珀酸合酶 (ASS) 和精氨酸琥珀酸裂解酶 (ASL) 生成,產生的副產物富馬酸轉化為蘋果酸進而生成草酰乙酸,用于生成天冬氨酸進入精氨酸合成循環。同時,精氨酸代謝為鳥氨酸和尿素,進行尿素循環。這些數據提示,抑制復合物 Ⅱ 組裝可以激活精氨酸生物合成通路以維持富馬酸水平,從而維持體內TCA代謝功能(圖 5)。
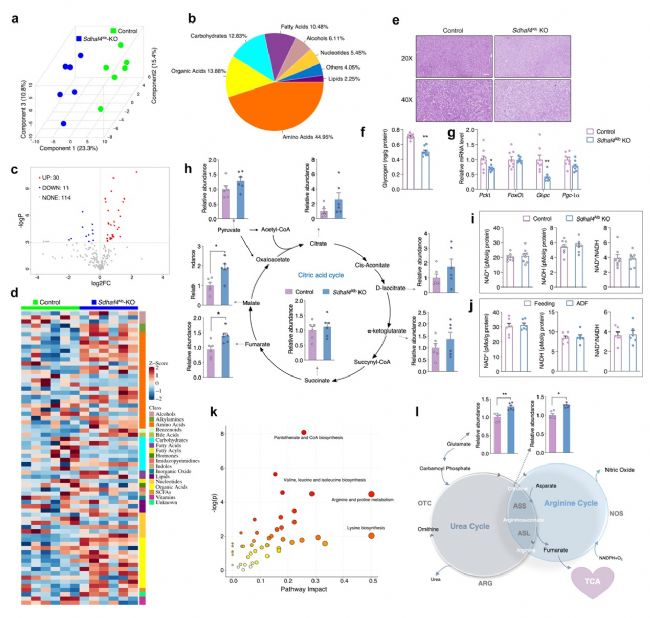
圖5. 抑制線粒體復合物 Ⅱ 組裝可促進氨基酸代謝
5. SDHAF4缺失激活精氨酸-NO循環以改善小鼠胰島素敏感性
肝臟SDHAF4缺失可以改善胰島素敏感性,這提示存在中間介質從肝臟釋放進入循環系統。血清代謝組學分析發現,精氨酸生物合成是Sdhaf4Alb KO小鼠中受影響的顯著通路,且瓜氨酸顯著增加。瓜氨酸是由一氧化氮合酶 (NOS) 催化產生,該反應還產生一氧化氮 (NO),NO是多種生理過程中的關鍵調節劑,因此探究NO是否是調節代謝益處的關鍵效應物。結果表明,Sdhaf4Alb KO和ADF組小鼠血清NO水平均升高,肝臟中NOS1 和 NOS3 表達也顯著增加,而在其他組織中未觀察到這種變化,提示精氨酸-NO循環在Sdhaf4Alb KO和ADF組小鼠肝臟中被激活。通過飲用水添加NOS抑制劑(N-硝基-L-精氨酸甲酯,L-NAME) 來抑制Sdhaf4Alb KO和ADF組小鼠NO,結果顯示,L-NAME顯著消除葡萄糖耐量和胰島素相關的Akt 磷酸化。此外,L-NAME 也可消除Sdhaf4Alb KO小鼠對 HFD 誘導的代謝保護。
為探究肝臟代謝調節作用對肌肉和脂肪組織的影響,對原代肝細胞與小鼠 C2C12 肌管或 3T3-L1脂肪細胞進行共培養。與Sdhaf4Alb KO小鼠肝細胞共培養的 C2C12 或 3T3-L1 細胞中Akt磷酸化顯著增加。循環系統中的NO 是否作用于靶組織,分析結果顯示,Sdhaf4Alb KO小鼠和ADF組小鼠肝臟、肌肉和 iWAT 中NO下游因子cGMP(環磷鳥嘌呤核苷)顯著增加。而且,在有或無L-NAME處理的情況下,Sdhaf4Alb KO小鼠靶組織中cGMP 水平與NO水平變化一致。為闡述組織胰島素敏感性增強是NO直接作用,Sdhaf4Alb KO小鼠進行短期L-NAME干預,肝臟中NO的產生和血清中NO水平顯著抑制,且肝臟、脂肪和肌肉中胰島素信號改善被顯著抑制。這些數據提示,肝臟SDHAF4-精氨酸軸驅動NO產生并通過 cGMP 信號靶向外周組織以增強胰島素敏感性(圖 6)。

圖6. SDHAF4 的肝臟缺失激活精氨酸-NO循環以改善小鼠胰島素敏感性
6. 肝臟NOS3是循環NO變化的原因
由于實驗組小鼠肝臟中NOS1和NOS3均顯著增加,因此進一步確定NO來源。用3種NOS 抑制劑處理Sdhaf4Alb KO小鼠原代肝細胞共培養的 C2C12 肌管,結果顯示,NOS3抑制劑顯著抑制胰島素誘導的Akt磷酸化,表明NOS3介導的NO產生可能是Sdhaf4Alb KO或ADF組小鼠全身代謝改善的原因。隨后構建肝臟Nos3敲除小鼠,其肝臟中Nos3表達和血清中NO水平均降低50%。對Nos3敲除小鼠進行ADF干預,Nos3敲除小鼠中葡萄糖和胰島素耐受被抑制,胰島素誘導的Akt磷酸化降低。Sdhaf4Alb KO小鼠與Nos3敲除小鼠進行雜交的小鼠表現出Sdhaf4完全缺失和肝臟Nos3 50% 表達。與Sdhaf4Alb KO小鼠相比,雜交小鼠NO循環水平顯著降低。同時,Nos3敲低也顯著降低Sdhaf4Alb KO小鼠中Akt磷酸化水平,且顯著抑制Sdhaf4Alb KO小鼠的葡萄糖和胰島素耐受能力。這些數據表明,肝臟NOS3 影響NO循環水平,SDHAF4-精氨酸-NO軸是調節ADF介導的代謝益處的潛在機制(圖7)。
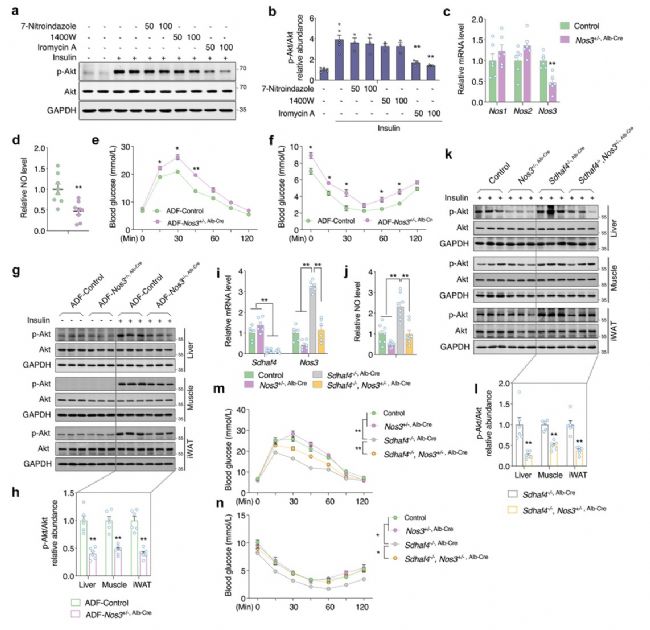
圖7. 肝臟NOS3是代謝改善小鼠循環NO的原因
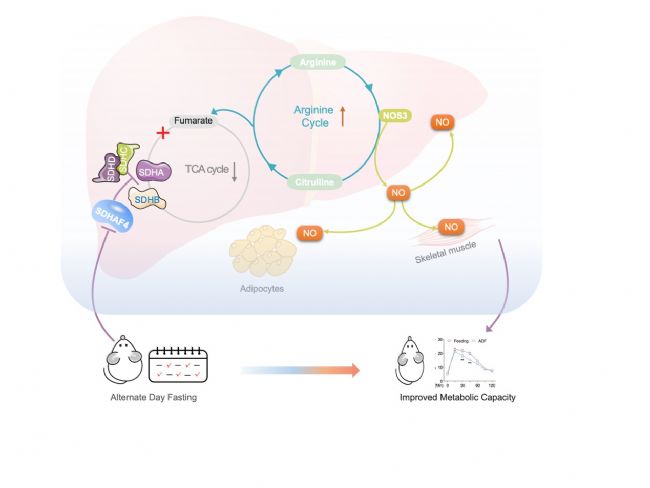
7. 肝臟Sdhaf4過表達減弱ADF對胰島素敏感性的改善作用
構建肝臟Sdhaf4過表達小鼠,在ADF干預下,轉染過表達載體的小鼠的葡萄糖耐量和胰島素敏感性顯著降低,組裝因子和SDH亞基轉錄表達無影響。此外,Sdhaf4過表達顯著改善了ADF誘導的線粒體復合物 Ⅱ 活性和SDH亞基組裝。Nos1、Nos3、Slc7a1 表達和血清 NO 水平降低,表明肝臟精氨酸-NO循環未被激活。肝臟、肌肉和 iWAT 組織中Akt磷酸化降低,表明肝臟 Sdhaf4 過表達顯著抑制ADF干預小鼠全身胰島素敏感性的提高。這些數據揭示了肝臟中高度動態和互作的線粒體代謝網絡,表明抑制肝臟復合物 Ⅱ 組裝可能是改善代謝能力的潛在策略(圖8)。
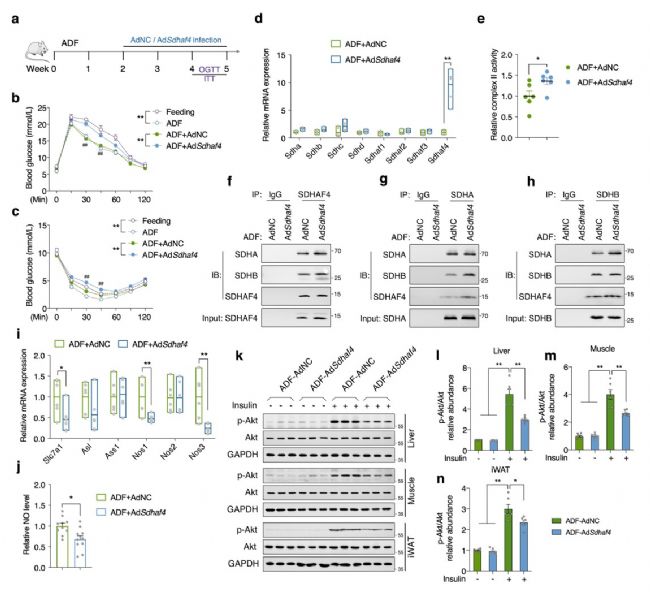
圖8. 肝臟Sdhaf4過表達減弱ADF小鼠對胰島素敏感性的改善
小結
本研究揭示肝臟在ADF干預期間經歷了顯著的代謝重編程,主要通過抑制組裝因子SDHAF4進而抑制線粒體復合物 Ⅱ 組裝。機制上,肝細胞激活精氨酸– NO軸以響應線粒體復合物Ⅱ和TCA循環,釋放NO增強多組織胰島素敏感性。這些結果突出了肝臟在ADF相關全身益處中的關鍵作用,并表明靶向肝臟線粒體復合物 Ⅱ 組裝可能是對抗代謝紊亂的新策略。
繪譜幫你測
麥特繪譜擁有業內強大的Q600全定量代謝組、Q300全定量代謝組、Q200宏代謝組等方法,可提供代謝組學一站式整體解決方案,獨家的檢測技術、全面的數據報告以及專業的售后探討,助力您的科研探索之路不斷創新和突破。詳情歡迎咨詢麥特繪譜熱線400-867-2686,獲取詳細資料!
參考文獻
Hepatic Suppression of Mitochondrial Complex Ⅱ Assembly Drives Systemic Metabolic Benefits. Advanced Science. 2022. https://doi.org/ 10.1002/advs.202105587.
閱讀原文,請掃描下方二維碼






