Drop-off-數字PCR法在快速檢測和定量廢水中新冠病毒及變種VOCs的應用
廢水中檢測到新冠病毒和新冠變種,在世界各地的污水廠都有類似的報道。今年初,美國疾病控制預防中心 (CDC)發布的報告中,指出新冠病毒變種奧密克戎(Omicron)很有可能在美國首例確診病例官方聲明前一周已經存在于紐約市的廢水中,報告同時指出,廢水監測是一個可行的早期預警系統,可以幫助跟蹤新冠病毒變種的傳播。
盡管對廢水中的SARS-CoV-2 RNA測序的方法極具應用意義,可以從單個樣本中追蹤數百人到數千人的新冠變種VOCs,但在樣本收集和分析方面存在時間滯后,測序和生物信息學管道通常需要至少3天的時間才能得到結果,為了能更快速地監測,科學家們開發了基于PCR的分析方法,以識別其特征突變(Vogels等人,2021;Bedotto等人,2021;Chaintoutis等人,2021)。例如,針對單核苷酸多態性的檢測,如突刺蛋白中的N501Y和E484K,或特征缺失,如突刺Δ69-70和ORF1a Δ3675- 3677。
瑞士科學家Lea Caduff等使用drop-off數字PCR方法開發快速、高通量的方法來檢測和量化廢水中新冠變種的兩種缺失頻率,開發統計方法監測特異性突變隨時間的動態變化,從而量化新冠變種的傳播速度,數據與臨床樣本測序結果一致。該方法基于naica®微滴芯片數字PCR系統,針對廢水中新冠病毒特異性突變的數字PCR檢測提供了近實時的SARS-CoV-2 新冠變種VOCs監測,并可能比臨床測序更早地檢測和推斷新冠變種VOCs的傳播速度,方法發表于文章“Inferring Transmission Fitness Advantage of SARS-CoV-2 Variants of Concern in Wastewater Using Digital PCR。DOI:https://doi.org/10.1101/2021.08.22.21262024。

應用亮點:
▶ 利用naica®微滴芯片數字系統,開發出drop-off方法檢測廢水中SARS-CoV-2變種的突變頻率。
▶ 通過對大量廢水及臨床樣本的檢測分析,發現廢水中SARS-CoV-2變種的傳播適應性與臨床樣品一致。
▶ Drop-off RT-dPCR方法為社區內VOCs的快速檢測和定量提供了機會,可用于基于SARS-CoV-2的廢水流行病學的大規模檢測調查。
▶ 與臨床或廢水測序相比,drop-off RT-dPCR檢測提供了一種在社區內跟蹤突變的方法,成本更低,檢測速度更快,而且可以用于篩選VOCs的其它突變。
在COVID-19全球大流行期間,SARS-CoV-2令人擔憂的遺傳變異(VOCs)多次出現。VOCs的特征是傳播性增強,毒性增強,或通過先前感染或接種疫苗獲得的抗體的中和作用減弱。通常追蹤VOCs的輸入和傳播依賴于測序,對臨床樣本進行全基因組測序。現在廢水監測越來越多地被用于通過測序方法跟蹤SARS-CoV-2變種的輸入和傳播。雖然廢水中SARS-CoV-2 RNA測序是一種很有前途的方法,可以在一個樣本中跟蹤成百上千個人的VOCs,但樣本收集和分析存在時間滯后,這與臨床測試相關的滯后類似。在得到RNA樣本后,測序和生物信息學分析通常需要至少3天的時間才能得到結果。為了更快速地識別VOCs,我們開發了基于PCR的快速、高通量的方法來檢測和定量廢水中B.1.1.7、B.1.351和P.1 VOCs的兩種突變頻率。我們進一步開發了一種統計方法來分析RT-dPCR檢測數據的時間動態,以量化傳播適應性,獲得與從臨床樣本獲得的相似的數據。針對廢水中的SARS-CoV-2數字PCR檢測提供了對VOCs的實時監測,并可以比臨床測序更早地發現和推斷傳播適應性。
在一個RT-dPCR檢測中,使用兩個非競爭性水解探針,針對同一擴增子上的保守區域,量化廢水樣品中的突變頻率(“drop-off RT-dPCR檢測”),可以同時定量野生型(不攜帶突變的菌株)和突變型(攜帶突變的菌株)(圖1)。
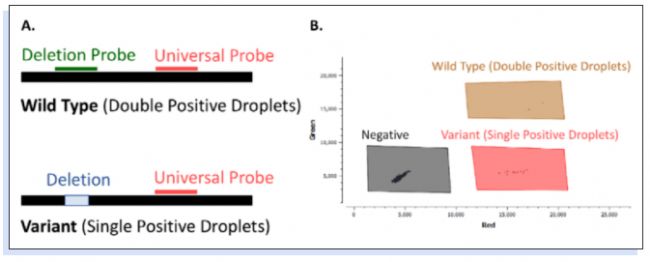
▲圖1 基于兩種不同探針的drop-off RT-dPCR檢測方法概述:一種drop-off探針(Deletion Probe)和一種Reference探針(Universal Probe)。(A)Reference探針可同時與野生型和突變型結合,而drop-off探針只與野生型結合。(B)在dPCR 2D散點圖中,野生型為雙陽性液滴(棕色),而突變型為單陽性液滴(紅色)。
在2020年12月7日至2021年3月26日期間,對從廢水處理廠Werdhölzli(服務于瑞士蘇黎世約45萬人)收集的32個原始進水(24小時流量比例復合)樣本進行了drop-off RT-dPCR檢測,并與在蘇黎世收集并測序的2497個臨床樣本進行對比。使用drop-off RT-dPCR方法在廢水中檢測的突變的時間趨勢與臨床樣本的測序數據一致(圖2)。
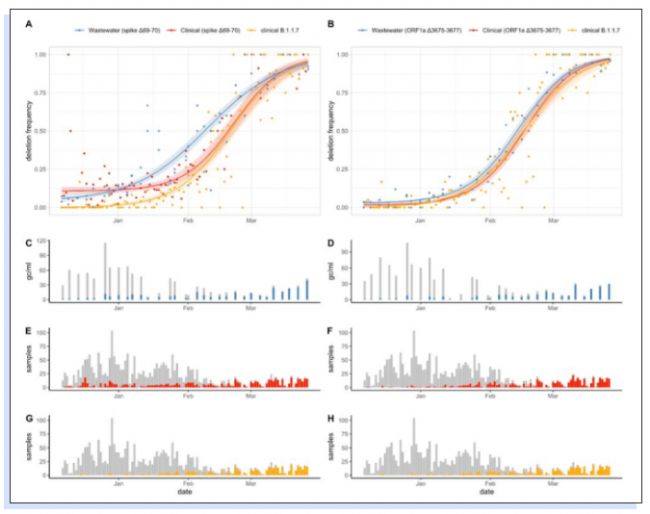
▲圖2 與蘇黎世臨床樣本相比,廢水樣本中 (A) spike Δ69-70 和 (B) ORF1a Δ3675-3677 的突變頻率,以及蘇黎世臨床樣本中 B.1.1.7 譜系的突變頻率。擬合曲線對應于廢水和臨床數據缺失的三參數擬合和 B.1.1.7 臨床數據的兩參數擬合。陰影區域對應于 95% 的置信帶。(C) spike Δ69-70 和 (D) ORF1a Δ3675-3677 的 SARS-CoV-2 RNA(灰色)濃度和缺失等位基因(藍色)濃度,在廢水樣品中。(E) spike Δ69-70 和 (F) ORF1a Δ3675-3677,蘇黎世測序的臨床樣本數量(灰色)和缺失等位基因(紅色)的樣本數量。(G, H) 蘇黎世測序的臨床樣本數量(灰色)和B.1.1.7 譜系的樣本數量(橙色)。
使用dPCR技術跟蹤廢水中VOCs的特征突變(ORF1aΔ3675-3677和spikeΔ69-70)的時間趨勢可以迅速告知變異傳播性。來自廢水的生長速率和傳播適應性估計值與來自臨床樣本的估計值基本一致,95%置信區間重疊。由于dPCR樣本分析比全基因組測序更快,一旦識別出特征突變,可以幫助我們早期洞察新變異的傳播性。本研究可以幫助大家進行SARS-CoV-2變種的傳播性研究。
參考文獻:
1、Bedotto, Marielle, et al. 2021. “Implementation of an in-House Real-Time Reverse Transcription-PCR Assay for the Rapid Detection of the SARS-CoV-2 Marseille-4 Variant.” Journal of Clinical Virology: The Official Publication of the Pan American Society for Clinical Virology 139 (June): 104814.
2、Chaintoutis, et al. 2021. “A One-Step Real-Time RT-PCR Assay for Simultaneous Typing of SARS-CoV-2 Mutations Associated with the E484K and N501Y Spike Protein Amino-Acid Substitutions.” medRxiv. https://doi.org/10.1101/2021.05.31.21257367.
3、Fernandez-Cassi, et al.. “Wastewater Monitoring Outperforms Case Numbers as a Tool to Track COVID-19 Incidence Dynamics When Test Positivity Rates Are High.” https://doi.org/10.1101/2021.03.25.21254344.
4、Crits-Christoph, et al. 2021. “Genome Sequencing of Sewage Detects Regionally Prevalent SARS-CoV-2 Variants.” mBio 12 (1). https://doi.org/10.1128/mBio.02703-20.





