膽汁酸研究的百年歷史和新的突破點
膽汁酸(Bile Acid, BA)是膽汁的主要成分,一方面促進腸道對脂類營養物質的吸收,另一方面具有信號分子功能,在糖脂代謝、能量消耗、機體免疫等諸多生理功能中均具有重要的調控作用。
膽汁酸研究的歷史起源
盡管首次對膽汁的書面記錄可追溯到古埃及時期(公元前1550年),但希波拉底時期(公元前460-377年)其作用才得以突顯,被認定為四大體液之一,而協調四種體液是當時主要的疾病治療方式,也是中醫的基石之一。直到19世紀下半葉,BA才被分離出來,但在BA領域取得的最大成就是在20世紀,BAs化學結構被解析出來。隨后陸續有更多突破性發現:
1943年,研究發現BA是由膽固醇生成;
1950s,BAs色譜分離,次級BA及腸肝循環被發現;
1970s,UDCA和CDCA用于治療膽固醇結石;
1980s進入了BA合成和代謝領域。
1989-1990年,BA合成限速酶CYP7A1被分離出,開啟了BA代謝的分子時代。
1999年,法尼醇X受體(FXR) 被確定為第一個膽汁酸激活受體;
2002年,次級BA激活受體G蛋白偶聯膽汁酸受體1(GPBAR1, 也稱TGR5)被確定,BA復興時代到來;
2005年后,腸道菌群的引入為BA研究又開辟了一條新道路。
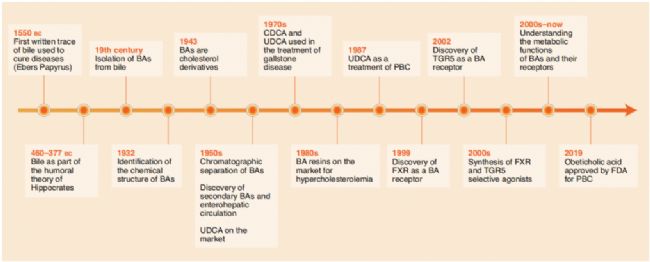
圖1. 膽汁酸領域的重大發現時間表
膽汁酸的合成與轉化
不同體液和組織中膽汁酸的相對組成存在較大差異,這些差異主要因為BAs合成、分泌、轉化及體循環等過程,同時,腸道微生物也影響宿主膽汁酸池組成。在回腸末端,約95%BAs通過位于腸上皮細胞管腔側的頂端鈉依賴性膽汁酸轉運體(SLC10A2或ASBT)進行重吸收。在腸細胞中,BAs被腸道膽汁酸結合蛋白(FABP6或IBABP)結合,并通過有機溶質轉運體復合體被運送到細胞的基底側膜,釋放到門脈循環中。隨后通過門脈循環轉運回肝細胞的基底膜,然后被牛磺膽酸鈉共轉運多肽(SLC10A1或NTCP)和有機陰離子轉運多肽(SLCO或OATP)家族的成員所攝取。一旦進入肝細胞,BAs就參與7α-羥化酶 (CYP7A1) 和固醇 12α-羥化酶 (CYP8B1)對膽汁酸合成的調節,將新合成BAs整合到現有的BAs池。維持膽汁酸池的穩定,這對適當的營養吸收和維持腸道微生物群穩態至關重要。事實上,膽汁酸池組成的紊亂出現在多種疾病中,包括不同來源的腹瀉、吸收不良、炎癥性腸道疾(IBD)、血脂異常、動脈粥樣硬化、糖尿病和慢性肝病等。

圖2. 肝臟和腸道中膽汁酸的合成和生物轉化
膽汁酸受體
雖然過去的三十年中已經確定了幾種BA受體,但FXR 和TGR5因其在健康和疾病中的調節作用而得到了特別充分的研究,并且它們的特性可以表征BAs在體外以不同效力結合并激活受體,不過這些受體在體內的激活很大程度上取決于BA池總組成。FXR廣泛存在于體內各臟器及組織,其中以肝臟和腸道中表達量最高。CDCA是一種天然的FXR激動劑,與類視黃醇X受體α(RXRα)復合物結合,激活其靶基因的轉錄。TGR5是GPCR中視紫質樣亞家族的成員,幾乎所有組織中都有表達,其中膽囊上皮細胞含量最豐富。次級BAs是TGR5最有效的激動劑,它們與牛磺酸或甘氨酸的結合進一步增加了激活效果。因此,BAs是FXR和TGR5的雙激動劑,兩者經常在多個器官中互補,共同調節全身代謝。
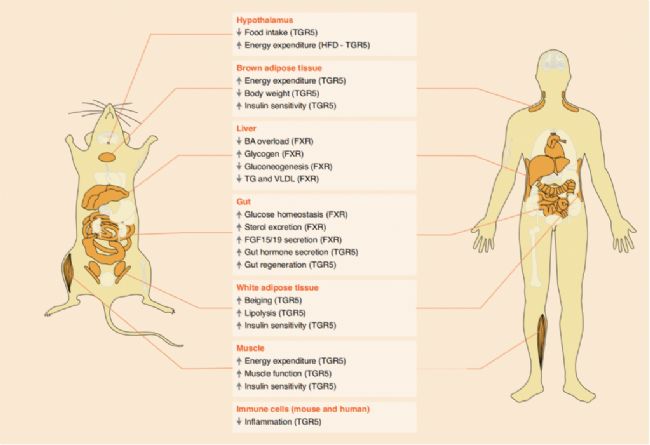
圖3. 膽汁酸的靶組織和生物活性
大量研究表明,通過改變飲食、運動、寒冷暴露、抗生素、益生菌或糞便移植等來調節外周膽汁酸池的大小和組成,可能是調節能量穩態的一個有前途的策略。靶向腸道微生物-膽汁酸軸在治療多種疾病中表現出巨大的潛力,但深入認識其機制聯系以及轉化為臨床實踐還有很長的路要走。此外,許多基于臨床前模型和多種疾病患者的研究已詳細描述了膽汁酸及其受體的功能,而膽汁酸信號通路的很多方面仍需更多研究。
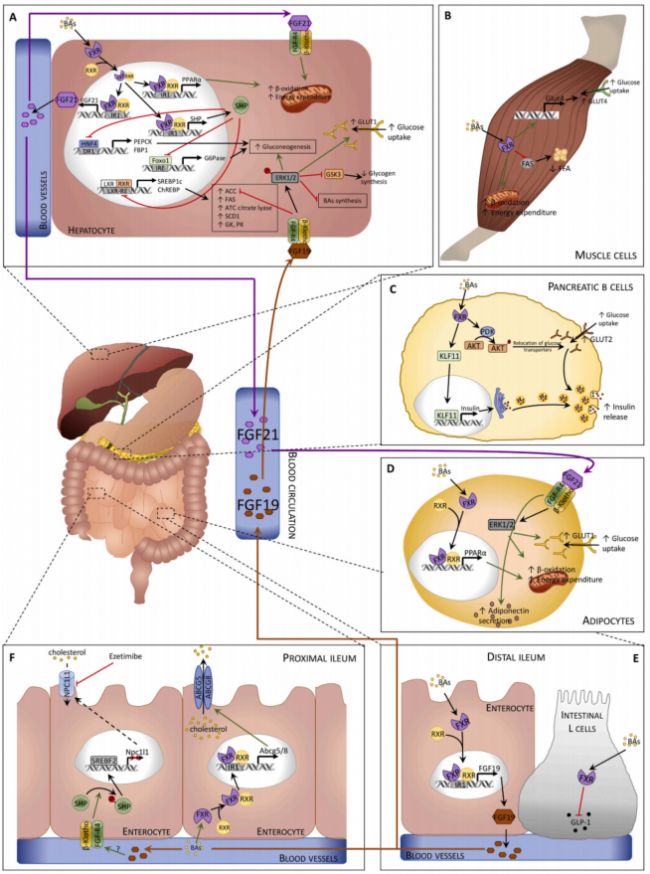
圖4. FXR在各組織中的信號轉導及其生理/藥理作用
膽汁酸譜分析
得益于麥特繪譜科研團隊多年來的探索與成果積累,我們擁有最全最成熟的膽汁酸譜檢測技術,并已積累了上萬例樣本的項目經驗。該方法采用60+種膽汁酸標準品建立絕對定量標準曲線,以穩定同位素標記膽汁酸作為內標,實現60+種膽汁酸的精準定量,并確保多種同分異構體均獲得較好分離。
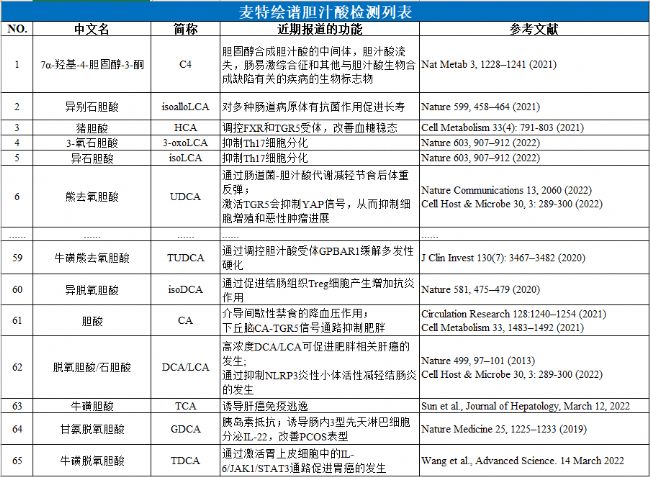
目前,麥特繪譜與合作伙伴已發表多篇膽汁酸相關文章,發表期刊包含Cell Metabolism、Nature Communications、Advanced Science、Diabetes Care、Microbiome、Science Advances等,涵蓋肝病(慢性肝病與肝癌)、膽道疾病、胃腸道疾病、神經系統疾病、心血管疾病、糖尿病、肥胖與減重等領域。
點擊下方鏈接,進入膽汁酸相關文章閱讀:
膽汁酸研究的高端“利器”,麥特繪譜膽汁酸譜福利活動火熱進行中!超值特惠,不容錯過!歡迎咨詢,了解詳情。

參考文獻
1. Metabolic Messengers: bile acids. Nature Metabolism. 2022.
2. Bile acids and their receptors in metabolic disorders. Progress in Lipid Research. 2021.
3. Gut microbiota-derived bile acids in intestinal immunity, inflammation, and tumorigenesis. Cell Host & Microbe. 2022.






