人源化單克隆抗體CD28的共刺激作用與研究進展
人源化單克隆抗體CD28
單克隆抗體(Mab)目前已被納入惡性腫瘤、移植排斥、自身免疫和傳染病等以及一系列新適應癥的靶向治療方案。而人源單克隆抗體(Human monoclonal antibody,HuMAb) 更是成為未來抗體發展的主要研究方向。HuMAb是指完全由人類基因編碼表達的單克隆抗體,它具有更豐富的表位、更低的免疫原性、更長的半衰期、更佳的生物活性等優勢,使之在體內中發揮著良好的用途,如體內診斷、傳染病預防、抗體療法和疾病預后判斷等。其中,CD28作為一個機制清晰的老靶點,它在免疫治療中發揮著重要的價值。
CD28分子是由二硫鍵合的44 kDa亞基組成的同源二聚體糖蛋白。每個CD28單體含有134個細胞外氨基酸,具有單個跨膜結構域和短細胞質尾。CD28的細胞外結構域與免疫球蛋白可變區域結構域顯示其同源性。CD28分子的編碼基因由四個外顯子組成,每個外顯子分別定義其蛋白質的功能結構域。
CD28共刺激作用
T細胞的完全活化依賴于T細胞抗原受體(T-cell receptor, TCR)提供的抗原刺激信號和共刺激受體提供的共刺激信號。CD28是T細胞中關鍵的共刺激受體,它調控T細胞的發育、分化、代謝、遷移等生理過程[1] 。初始T細胞的完全活化通常需要三個信號,第一信號是抗原和抗原受體的結合,第二信號是共刺激信號,第三信號是細胞因子信號。CD28作為共刺激分子,參與了第二信號的接收。
對于Tc細胞(細胞毒性T細胞)和Th細胞(輔助性T細胞)來說,共刺激信號傳導降低了T細胞活化的閾值,促進了T細胞的增殖和分化。在沒有CD28共刺激存在時,初始T細胞不會被活化,也不會發生應答。CD28參與的共刺激過程能產生多方面重要的分子效應:
1. 誘導T細胞表面IL-2R(白介素-2受體)的表達,從而 允許細胞接收第三信號;
2. 使Th細胞開始分泌大量的細胞因子和趨化因子;
3. 誘導表達和上調表達在Th和Tc細胞內其他共刺激和調節分子[2]。
當DC(樹突狀細胞)表面的特異pMHC結合了初始Th或Tc細胞表面多拷貝的某個TCR時將傳遞第一信號。TCR和pMHC結合,將導致與TCR緊密相鄰的CD3鏈上ITAM被Lck激酶磷酸化。其他胞內信號轉導相關酶隨后被募集到此處,與CD4或CD8共受體及CD3鏈的胞質尾區相接觸。這些酶一起介導酶級聯化學反應,導致其他多個酶的活化。當這種活化級聯反應出現于多個TCR時,T細胞將接收到第一信號 [2] 。
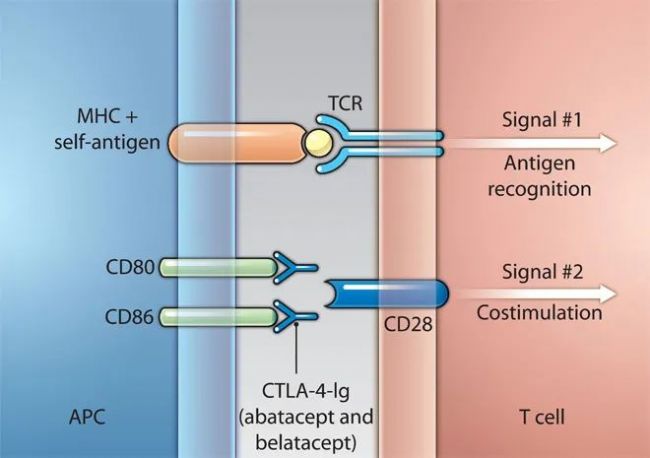
在多數情況下,TCR和pMHC的結合不足以完全活化一個初始Th細胞或Tc細胞,共刺激信號傳導形式的第二信號是必需的。對于Th細胞,接收第一信號后導致Th細胞表面的重要共刺激分子CD28的表達上調。然而CD28要傳遞第二信號到Th細胞核內,其必須同遞呈活化性pMHC的DC表面的配體B7分子相結合。當免疫突觸最初開始形成時,成熟的DC細胞并沒有表達最佳水平的B7分子,第一信號傳遞到Th細胞及CD28和B7最初結合的關鍵結果是Th細胞表面跨膜蛋白CD40L的表達上調,一旦Th細胞表面的CD40L與DC表面的CD40結合,DC將大大提高其B7的表達及隨后其同Th細胞表面CD28的更強結合。最終,強有力的第二信號被傳遞到T細胞內,從而提高活化性胞內信號傳導,而這種出現在T細胞內的活化信號轉導也是第一信號的結果。
CD28研究進展
由于CD28表達于T細胞表面,且CD28分子的表達情況在健康人中具有一定的年齡相關性[3]。人剛出生以后,人體體內循環中幾乎沒有CD28-T細胞,但隨著年齡的增加,CD28-T細胞的數量便逐漸增多。CD28分子的缺失減少了T細胞抗原受體的多樣性,抑制了抗原誘導的增殖[4]。CD28表達減少通常被認為是T細胞衰老的標志[5],且CD28缺失是老年人免疫功能不全的關鍵預測因子。
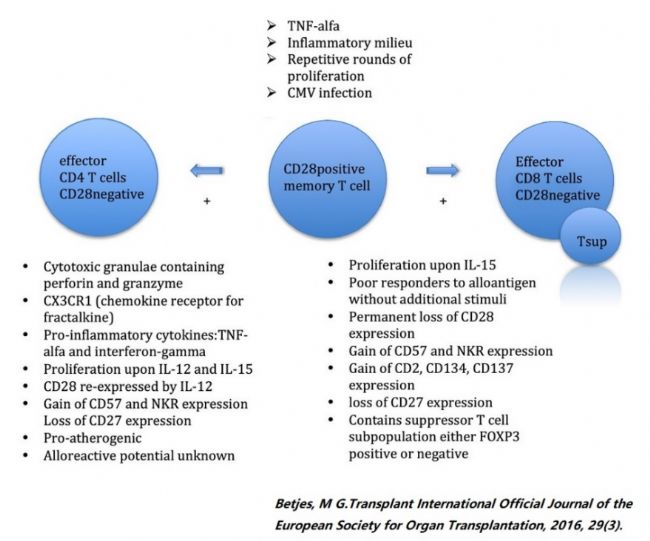
抗CD28單克隆抗體通過靶向CD28分子胞外結構起作用,根據其靶抗原表位及其對T細胞的刺激活性可大致分為2類:常規抗CD28特異性抗體和抗CD28超激動抗體(又名CD28超激動劑,即CD28sa)。在大多數藥物研發中,抗CD28抗體藥物主要是指CD28sa。
早期的CD28sa分子起源于1990年后期Thomas Hünig的實驗室,其基于大鼠模型為類風濕性關節炎(RA)、多發性硬化癥、格林-巴雷綜合征或1型糖尿病等自身免疫性疾病開發的免疫療法項目。
然而,CD28的靶向治療手段的應用卻是“命運多舛”。2006年,CD28激動劑(TNG1412)進入臨床實驗,但卻以悲劇收場,并成為當年免疫治療領域的頭條新聞。爾后,TNG1412更名TAB08。研究發現,當濃度控制在較低水平時,試驗效果良好,目前仍處于臨床試驗階段用于腫瘤治療;2016年,強生公司的CD28單抗藥物(FR04)能夠抑制T細胞的增殖,活化以及阻斷信號通路來達到免疫耐受的效果;2020年10月,首款CD28拮抗劑免疫療法FR104獲得歐洲專利;近年來科研人員對CD28 單克隆抗體的研究依然沒有停止......
研究1
南方科技大學的田瑞軍、李鵬飛和來自中國科學院大連化學物理研究所的王方軍在《Cell Chem. Biol.》期刊上發表了一篇以“Motif-DependentImmune Co-receptor Interactome Profiling by Photoaffinity Chemical Proteomics”為題的論文[6] 。

他們利用CD28通過酪氨酸磷酸化(pY)這種翻譯后修飾激活,然后招募下游信號蛋白形成復合物。這些復合物對于T細胞的激活與TCR信號通路至關重要,因此分析其相互作用組有助于更全面地理解CD28的調節功能及其在免疫治療中的應用。
研究2
2017年10月,中科院生物化學與細胞生物學研究所許琛琦研究組與牛津大學Omer Dushek研究組合作在《Nature Structural & Molecular Biology》在線發表了題為“Dynamic regulation of CD28 conformation and signaling by charged lipids and ions”的論文[7]。

該項研究揭示了CD28的活性調控機制以及T細胞高抗原敏感性的信號基礎,提出了TCR-Ca2+-CD28所組成的正反饋調控環路可以迅速放大T細胞信號強度的機制;揭示了TCR-Ca2+-CD28之間由此形成了正反饋環路,可以迅速放大抗原刺激信號,從而為T細胞產生高抗原敏感性提供信號基礎。
總結
無論是抗腫瘤免疫治療還是器官移植后免疫抑制治療,以及機會性感染的控制,共刺激分子CD28都不失為一個有用的敏感靶點。通過流式技術監測免疫細胞的表型,能夠為臨床研究和治療提供有關受體免疫狀態極具價值的信息。我們相信,在未來幾年里,市場上將會有越來越多以CD28為靶點的生物制劑,為廣大深受免疫疾病困擾的患者帶來福音。
同立海源CD28驗證數據
高純度HPLC和SDS-PAGE驗證
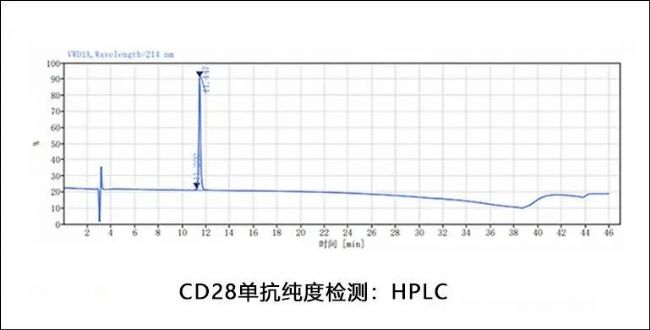
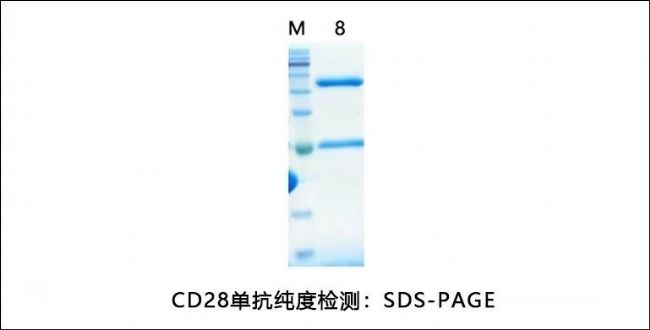
測試結果顯示純度達到藥用級標準(≥95%)
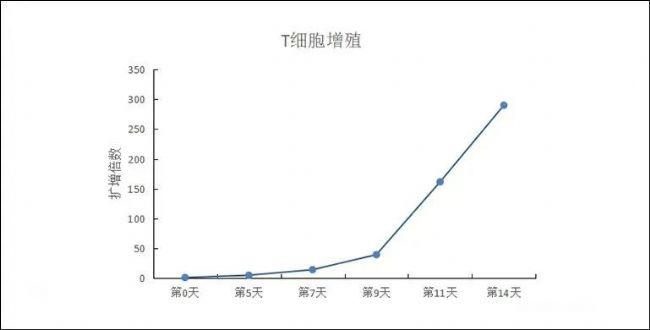
高生物活性經細胞水平生物活性驗證
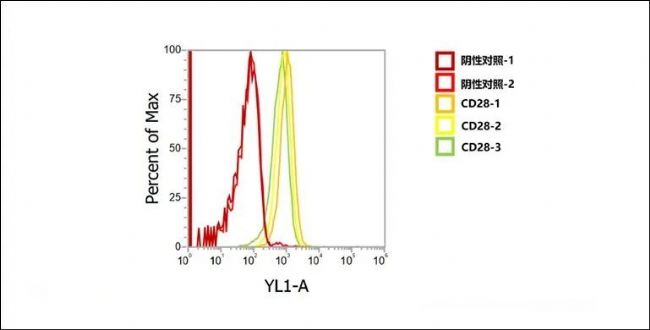
流式細胞術檢測CD28抗體與Jurkat細胞
(人外周血白血病T細胞)
表面CD28的結合活性,CD28抗體在低濃度
100-300ng/mL下仍然表現出優良的結合能力
參考文獻:
[1]Chen, L. & Flies, D.B. Molecular mechanisms of T cell co-stimulation and co- inhibition. Nat. Rev. Immunol. 13, 227–242 (2013).
[2]塔克·馬可、瑪麗·桑德斯.免疫應答導論:科學出版社,2012:159-160
[3]FAGNONI F F, VESCOVINI R, MAZZOLA M, et al. Expansion of cytotoxic CD8+ CD28- T cells in healthy ageing people, including centenarians [J]. Immunology, 1996, 88(4): 501-7.
[4] QIN L, JING X, QIU Z, et al. Aging of immune system: Immune signature from peripheral blood lymphocyte subsets in 1068 healthy adults [J]. Aging (Albany NY), 2016, 8(5): 848-59.
[5] VALLEJO A N, NESTEL A R, SCHIRMER M, et al. Aging-related deficiency of CD28 expression in CD4+ T cells is associated with the loss of gene-specific nuclear factor binding activity [J]. J Biol Chem, 1998, 273(14): 8119-29.
[6]Motif-DependentImmune Co-receptor Interactome Profiling by Photoaffinity Chemical Proteomics,Xiong Chen, Shanping Ji, Zheyi Liu, et al.Cell Chem. Biol.DOI:10.1016/j.chembiol.2022.01.005.
[7]Dynamic regulation of CD28 conformation and signaling by charged lipids and ions,Wei Yang,Weiling Pan,Shuokai Chen,et al.Nature Structural & Molecular Biology,2017-10-23 , DOI: 10.1038/nsmb.3489 .





