DC細胞簡介與其在疫苗研發中的應用介紹
DC細胞又叫樹狀細胞或者樹突細胞,1869年由保羅·蘭格爾翰斯發現,一開始被誤以為是神經細胞的一種,直到1973年皮膚科醫師Inga Silberberg發現了他的免疫功能,同年,被拉爾夫·斯坦曼和贊威爾·A·科恩兩人正式命名為“dendritic cells”(簡稱DC細胞)來稱呼這一細胞。
DC細胞的發展
DC由HSC產生,HSC產生MP和LP。MP進一步分化為MDP[1], MDP可分化為CDP和單核細胞。CDP進一步分化為pDC或pre-cDC。LP也可以產生pDC,盡管這一個體發生途徑尚未完全闡明。一旦進入血液,pre-cDC會產生兩種主要的DC亞型:cDC1和cDC2。pDC和cDC均可從血液向淋巴組織和非淋系組織遷移。在人類血液中,可以找到兩個主要的 DC 群體,稱為常規 DC (cDC) 和漿細胞樣 DC (pDC)。cDC可進一步細分為cDC1和cDC2。DC 的所有三種亞型都可以通過它們的特征轉錄因子和特定表面標記的表達來區分,除此以外還有單核細胞來源的DC(mo-DC),DC疫苗中使用的主要DC類型就是Mo-DC,他可以用不同的方法進行修飾[2]。
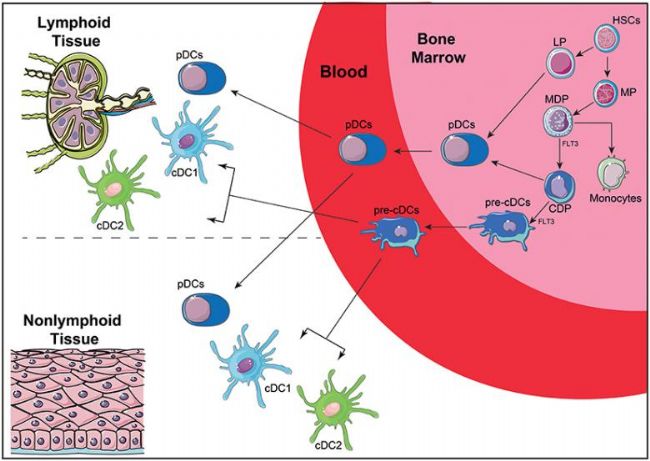
圖1:HSC產生DC細胞(doi: 10.3389/fifimmu.2018.03176)
樹突狀細胞誘導的CD4+T細胞當與DC接觸時,naïve CD4+ T細胞可分化為多種亞型[3]。其中有調節性T細胞(Treg)和輔助性T細胞(Th)亞群,包括Th1、Th2和Th17細胞。每個亞型表達不同的轉錄因子,這些轉錄因子調節細胞的功能和細胞因子分泌模式。T細胞命運的決定是一個復雜的現象,在很大程度上取決于DC與T細胞以及微環境中細胞因子的相互作用。
DC細胞的作用
DC幾乎可以在所有組織中發現,它們可以檢測穩態失衡,處理抗原并將其呈遞給T細胞,從而在固有免疫和適應性免疫應答之間建立聯系。DC細胞少量分布于血液、與外界接觸的皮膚、黏膜等部位,DC是專職抗原提呈細胞,具有獨特的誘導naïve T細胞活化和效應T細胞分化的能力。同樣,它們也參與誘導和維持穩態條件下的免疫耐受。它們的表型和功能異質性表明,DC細胞的分類復雜,并且具有很強的可塑性,能夠根據所處的微環境來調節獲得性免疫反應。此外,DC可以分泌細胞因子和生長因子來改變持續的免疫反應,并受到它們與其他免疫細胞(如自然殺傷細胞和固有淋巴細胞)相互作用的影響。
DC有"成熟"和"未成熟"兩種不同的功能狀態[4]。DC成熟是由組織穩態紊亂觸發,通過識別病原體相關分子模式(PAMP)或損傷相關分子模式(DAMP)來檢測,在成熟過程中,DC失去黏附結構,重組細胞骨架并增加其運動性,DC成熟也導致其內吞活性降低,但MHC-II和共刺激分子的表達增加,成熟DC表達較高水平的趨化因子受體CCR7,并分泌T細胞活化所必需的細胞因子。DC成熟后開啟代謝和基因轉錄程序,并且從外周組織遷移至次級淋巴器官的T依賴區域,成熟DC的標志是在次級淋巴器官中能激活抗原特異性naïve T細胞,從而觸發抗原特異性免疫應答[5]。
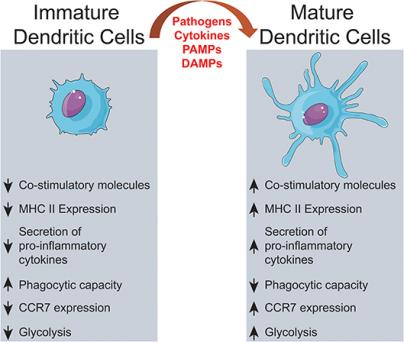
圖2:樹突狀細胞活化(doi: 10.3389/fifimmu.2018.03176)
DC疫苗
DC細胞的正常功能可以防止感染、癌癥、自身免疫和超敏反應等。DC細胞作為適應性免疫應答的關鍵激活因子,有望在誘導抗腫瘤免疫應答中發揮核心作用,其中DC疫苗是當前DC細胞最火熱的應用,制備DC疫苗的原理很簡單,患者的樹突狀細胞前體細胞在體外分離培養,裝載腫瘤抗原,然后轉移回患者體內,DC主要用于刺激特異性抗腫瘤T細胞發揮抗腫瘤作用。時至今日,許多科學研究和臨川應用都表明抗原提呈細胞在免疫反應中的重要作用,隨著對其調節途徑深入研究,可以預測其在癌癥、糖尿病等其他疾病均可應用,并且相應的不良反應也許會更少。
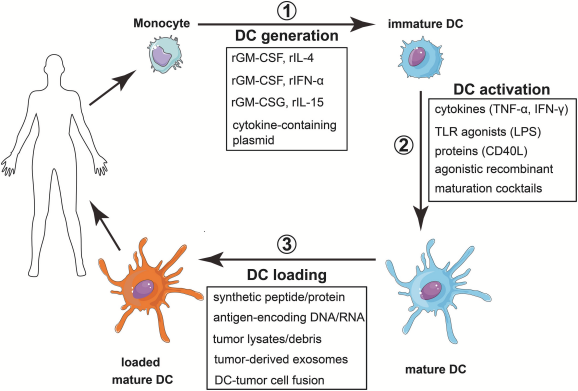
圖3:單核細胞來源的樹突狀細胞的疫苗接種策略
(doi: 10.3389/fifimmu.2018.03176)
DC相關產品信息 >>
| 貨號 | 產品名稱 | 表達宿主 | 規格 |
|
AS-03 |
AMMS®DC細胞培養添加劑 |
... |
500μL |
| GMP-TL602 |
AMMS®CD3/CD19 雙特異性抗體 |
... | 100μg |
|
GMP-TL301 |
重組人IL-4蛋白 |
CHO |
50μg/100μg |
|
GMP-TL302 |
重組人GM-CSF蛋白 |
HEK293 |
100μg |
|
GMP-TL303 |
重組人TNF α蛋白 |
HEK293 |
100μg |
|
GMP-TL512 |
重組人IL-6蛋白 |
HEK293 |
50μg/100μg |
|
GMP-TL513 |
重組人IL-1β蛋白 |
HEK293 |
10μg/100μg |
參考文獻:
【1】 van Montfoort N, Camps MG, Khan S, Filippov DV, Weterings JJ, Griffiffiffith JM, et al. Antigen storage compartments in mature dendritic cells facilitate prolonged cytotoxic T lymphocyte cross-priming capacity. Proc Natl Acad Sci USA. (2009) 106:6730–5. doi: 10.1073/pnas.0900969106
【2】Haniffffa M, Collin M, Ginhoux F. Ontogeny and functional specialization of dendritic cells in human and mouse. (2013) 120:1–49. doi: 10.1016/B978-0-12-417028-5.00001-6
【3】 Huang G, Wang , Chi H. Regulatio n of TH17 cell difffferentiation by innate immune signals. Cell Mol Immunol. (2012) 9:287–95. doi: 10.1038/cmi.2012.10
【4】Geissmann F, Manz MG, Jung S, Sieweke MH. Development of monocytes, macrophages, and dendritic cells. Science (2010) 327:656–61. doi: 10.1126/science.1178331
【5】Levings MK, Gregori S, Tresoldi E, Cazzaniga S, Bonini C, Roncarolo MG. Difffferentiation of Tr1 cells by immature dendritic cells requires IL-10 but not CD25+CD4+ Tr cells. Blood (2005) 105:1162–9. doi: 10.1182/blood-2004-03-1211





