3D細胞培養技術解析:類器官及其“肥料”細胞因子
一、類器官簡介
類器官是一類基于干細胞在體外進行3D培養而形成的具有一定組織結構和功能的微型組織或器官類似物。類器官擁有與來源組織器官高度相似的組織學特征,并能一定程度上擁有該組織器官相似的生理功能。
隨著 3D 細胞培養技術的興起,以3D細胞培養技術為基礎的類器官培養技術開始成為研究熱點。根據新思界產業研究中心發布的《2021-2025年全球類器官行業深度市場調研及重點區域研究報告》顯示,2020年,全球類器官市場規模在5億美元左右,隨著醫療技術進步,類器官市場規模將進一步擴張,預計2021-2026年,全球類器官市場規模將保持以18.2%的年均復合增長率增長。在國家多項政策的支持下,類器官的發展也進入了“快速通道”。
表1類器官相關的支持性政
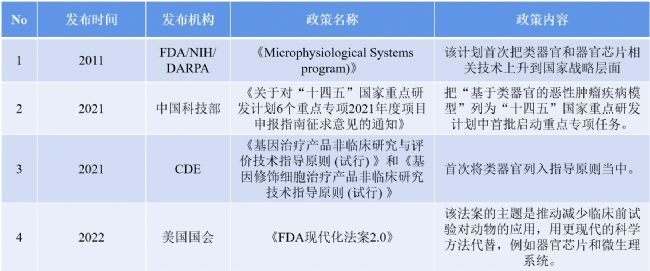
表2 國內施行的類器官相關團體標準
DROST團隊[1]曾將2D細胞和類器官模型進行了對比,發現類器官不僅能高度模擬體內細胞生長環境,保持細胞生長的空間結構,而且能更好地代表來源組織器官的生理功能和生物學特性。目前,類器官已成功應用于病原微生物致病模型構建[2]、腫瘤研究[3]、臨床藥物篩選[4]、藥物研發等多個領域[5],此外,新興的單細胞測序技術[6]、CRISPR-Cas9 基因編輯技術更是為類器官研究提供了進一步發展的空間[4]。
但類器官培養并不如普通 2D 細胞培養簡便,其構建成功率不僅與組織來源種類、來源組織質量、細胞生長階段等多種因素有關,還會遇到培養基成分復雜培養條件較難優化的挑戰。隨著近年來各領域對類器官培養的重視,多種組織器官來源的類器官模型均有報道,但仍有某些類器官建模成功率低、培養條件不夠穩定等問題存在,特別是在低分化腫瘤組織來源的類器官培養中,其成功率明顯低于高分化腫瘤來源組織或正常組織,因此對已有類器官培養基相關成分進行了解和剖析就顯得尤為重要,本文將重點對在類器官培養基中起到部分關鍵調控,如同培養類器官的“沃土”中的“肥料”——細胞因子進行介紹。
二、類器官培養的“肥料”——細胞因子
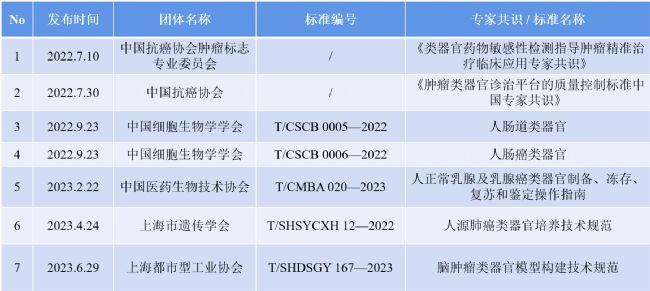
成功建立類器官的關鍵,除了所需的生物材料基質外,生長因子作為細胞培養、增殖及分化所必需的物質也必當優先考慮,從而保證類器官中的干細胞長期生存的能力。通過優化培養物生長條件模擬生理組織自我更新或損傷修復過程中的干細胞巢環境,如提供基底膜基質(即Matrigengel)并添加一系列激動劑(如Wnt和酪氨酸激酶受體)和抑制劑(如骨形態發生蛋白/轉化生長因子-β)可達到上述目的。不同的生長因子組合也能誘導多能干細胞向不同的類器官細胞分化進而獲得我們需要的類器官類型(圖1),同時不同的細胞因子也是培養不同種類的類器官的關鍵物質(圖2)。

圖1:生物化學型號誘導類器官形成[7]
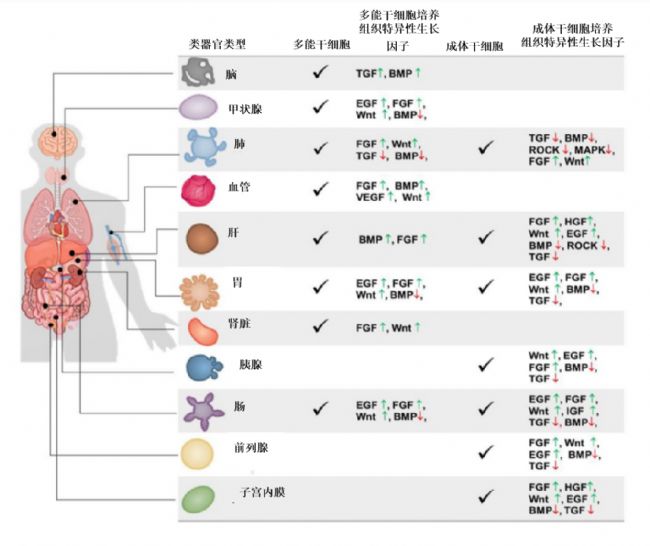
圖2不同來源和類型的類器官對生長因子偏好性[8]。
生長因子的添加配方仍在不斷改進,以進一步提高類器官體外存活率。下面將對部分生長因子進行逐一介紹。
1. 表皮生長因子(epidermalgrowth factor,EGF):
表皮細胞生長因子是人體內一種重要的細胞因子,其功能主要是促進皮膚細胞的分裂,同時表皮細胞生長因子也可以促進細胞的增殖。在輸卵管的類器官培養中,表皮細胞生長因子可以促進細胞增殖和分化[9]。此外,在小腸類器官培養中,表皮細胞生長因子可以促進腸道的生長,表皮細胞生長因子信號通路在腸類器官生長中發揮重要作用[10]。此外,表皮細胞生長因子對膠質瘤干細胞具有促進增殖的作用[11]。
2. 成纖維細胞生長因子(fibroblast growth factor,FGF):
成纖維細胞生長因子廣泛分布于體內多種組織器官,是一種對細胞生長、增殖以及分化具有調控作用的生長因子,其家族目前發現23個成員。成纖維細胞生長因子通過對多種信號通路發揮作用從而調控體內細胞的生長。有研究表明,成纖維細胞生長因子通過抑制骨形態發生蛋白信號以及提高 Wnt 信號傳導從而在類器官培養中發揮作用[12]。而且,Sox10 可以標記乳腺類器官培養的干細胞群,成纖維細胞生長因子信號可以調節不同 Sox 家族轉錄因子在體內的表達以及功能[13]。在類器官培養中最常見的家族成員為成纖維細胞生長因子2(bFGF)、成纖維細胞生長因子7(KGF)以及成纖維細胞生長因子10。成纖維細胞生長因子2 可以促進類器官的形態發生,維持胚胎干細胞的干性,也可以與胰島素樣生長因子 1 結合增強人腸干細胞的集落形成能力,促進神經干細胞的增殖、分化[14]。由此看出,成纖維細胞生長因子家族對于機體內多種細胞生長、增殖、分化具有重要的調控作用,因此也成為體外類器官培養中較常見的細胞因子之一。
3. 血管內皮生長因子( vascular endothelial growth factor,VEGF):
血管內皮生長因子是一個家族,包括血管內皮生長因子 A、血管內皮生長因子 B、血管內皮生長因子 C 等多個家族成員,其主要作用為促進血管內皮細胞的生長。通常所提到的血管內皮生長因子指的是血管內皮生長因子 A,也是在類器官培養中比較常用的血管內皮生長因子,其在血管生成和內皮細胞生長中發揮作用。但在類器官培養中,其功能不再僅僅局限于血管生成等作用。研究發現,血管內皮生長因子 A 在腎臟類器官培養中可以促進小鼠后腎間充質細胞的增殖,而對于細胞的遷移沒有影響[15]。在心臟類器官研究中,血管內皮生長因子信號通路通過促進Cx43 表達,以此增強心臟功能[16]。在腦類器官研究中發現,血管內皮生長因子 A 可以促進血管生成、神經分化[17]。由此看來,血管內皮生長因子促進類器官擴增、維持內環境平衡發揮重要作用。
三、植物源細胞因子
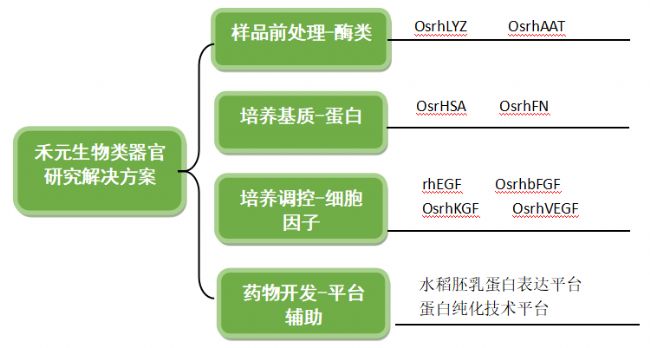
類器官行業在國內的發展勢頭強勁,但是仍有一些問題和阻礙亟待解決,首當其沖的就是上游耗材受到限制。細胞因子作為類器官培養的重要調控者,是類器官培養基,類器官3D打印墨水等新型產品的重要組成部分。因此類器官的培養研究,到后期的批量化擴大化的量產對相關耗材的產量與批間穩定性都提出了很高的要求。目前,類器官產品的耗材(如基質膠、維持類器官生態和分化所需的生長因子、細胞培養板等)大都處于進口壟斷的狀態。企業若能實現耗材的進口替代,成本有望大幅下降。而禾元生物正是將打破上游供應的國外壟斷為己任,通過利用全球首創的水稻胚乳細胞生物反應器高效重組蛋白表達平臺,實現規模化、批間穩定性好的產品為類器官研究提供全方位的蛋白原料解決方案,助力中國類器官產業發展走到世界最前列!
參考文獻
[1] Drost J, Clevers H. Organoids in cancer research. Nat Rev Cancer. 2018;18(7):407-418.
[2] Xiao S, Zhou L. Gastric Stem Cells: Physiological and Pathological Perspectives. Front Cell Dev Biol. 2020;8:571536.
[3] Frappart PO, Hofmann TG. Pancreatic Ductal Adenocarcinoma (PDAC) Organoids: The Shining Light at the End of the Tunnel for Drug Response Prediction and Personalized Medicine. Cancers (Basel). 2020;12(10):2750.
[4]Gilazieva Z, Ponomarev A, Rutland C, Rizvanov A, Solovyeva V. Promising Applications of Tumor Spheroids and Organoids for Personalized Medicine.Cancers (Basel). 2020;12(10):2727.
[5] Mittal R, Woo FW, Castro CS, et al. Organ-on-chip models: Implications in drug discovery and clinical applications. J Cell Physiol. 2019;234(6):8352-8380.
[6] Wei K, Korsunsky I, Marshall JL, et al. Notch signalling drives synovial fibroblast identity and arthritis pathology. Nature. 2020;582(7811):259-264.
[7] Yi SA, Zhang Y, Rathnam C, Pongkulapa T, Lee KB. Bioengineering Approaches for the Advanced Organoid Research. Adv Mater. 2021;33(45):e2007949.
[8] Tortorella I, Argentati C, Emiliani C, Martino S, Morena F. The role of physical cues in the development of stem cell-derived organoids. Eur Biophys J. 2022;51(2):105-117.
[9] Xie Y, Park ES, Xiang D, Li Z. Long-term organoid culture reveals enrichment of organoid-forming epithelial cells in the fimbrial portion of mouse fallopian tube. Stem Cell Res. 2018;32:51-60.
[10] Zhang RR, Koido M, Tadokoro T, et al. Human iPSC-Derived Posterior Gut Progenitors Are Expandable and Capable of Forming Gut and Liver Organoids. Stem Cell Reports. 2018;10(3):780-793.
[11] 米杜秋,張路陽,劉強,等. 表皮生長因子對膠質瘤干細胞增殖與侵襲的影響[J]. 解剖科學進展,2019,25(1):70-73.
[12] Boonekamp KE, Kretzschmar K, Wiener DJ, et al. Long-term expansion and differentiation of adult murine epidermal stem cells in 3D organoid cultures. Proc Natl Acad Sci U S A. 2019;116(29):14630-14638.
[13] Lu W, Kang Y. Cell lineage determinants as regulators of breast cancer metastasis. Cancer Metastasis Rev. 2016;35(4):631-644.
[14] Fujii M, Matano M, Toshimitsu K, et al. Human Intestinal Organoids Maintain Self-Renewal Capacity and Cellular Diversity in Niche-Inspired Culture Condition. Cell Stem Cell. 2018;23(6):787-793.e6.
[15] Patel M, Velagapudi C, Burns H, et al. Mouse Metanephric Mesenchymal Cell-Derived Angioblasts Undergo Vasculogenesis in Three-Dimensional Culture. Am J Pathol. 2018;188(3):768-784.
[16] Iyer RK, Odedra D, Chiu LL, Vunjak-Novakovic G, Radisic M. Vascular endothelial growth factor secretion by nonmyocytes modulates Connexin-43 levels in cardiac organoids. Tissue Eng Part A. 2012;18(17-18):1771-1783.
[17] Song L, Yuan X, Jones Z, et al. Assembly of Human Stem Cell-Derived Cortical Spheroids and Vascular Spheroids to Model 3-D Brain-like Tissues. Sci Rep. 2019;9(1):5977.





