五種常見的細胞增殖檢測技術原理及實驗流程分享
細胞增殖實驗常用方法包括細胞計數法、MTT法、BrdU染色法、CCK-8法、克隆形成法,這些實驗通常需借助顯微鏡和分光光度計完成。以上方法需頻繁拿出細胞,那么有什么新方法可以彌補這種不足呢?本文將介紹一種新的方法-使用活細胞成像系統,置于培養箱內實時動態成像,監測細胞的增殖情況。我們分析了新方法對比常用方法的優勢,同時列舉了幾篇活細胞成像系統應用在細胞增殖方向的發表在《Nature communications》、《Science translational medicine》、《Cell Reports》期刊的高分文章,該方法獲得了高校老師的認可,且在細胞增殖實驗中被推廣使用,證實了新方法的可靠性。
細胞增殖是生物體生長、發育、繁殖和遺傳的基礎,細胞以分裂的方式進行增殖。
細胞增殖能力是細胞活性的直接表現。
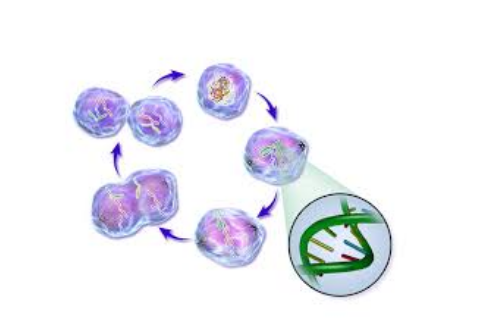
細胞增殖檢測技術廣泛應用于分子生物學、腫瘤生物學、藥理和藥代動力學等研究領域。 常見的細胞增殖檢測方法有以下5種。
1.細胞計數法
細胞增殖表現為細胞數目的增多,通過計數板和細胞計數儀得出細胞數目,繪制生長曲線。
操作方法:一般過程為接種細胞,分組培養7天,逐日檢測細胞數量,根據細胞數量繪制成圖,即為細胞生長曲線。
不足:操作繁瑣,需頻繁將細胞拿出培養箱,不適合數量較多或特定亞群的細胞計數。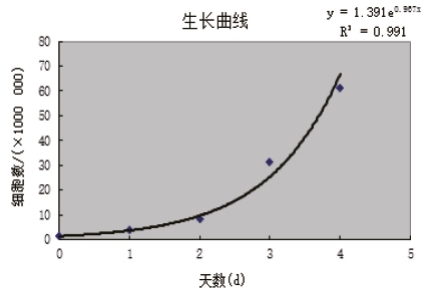
2.MTT法
活細胞線粒體中的琥珀酸脫氫酶能使外源性MTT還原為水不溶性的藍紫色結晶甲瓚(Formazan)并沉積在細胞中,而死細胞無此功能。
簡易流程:
2.1、接種細胞:制備細胞懸液,將細胞接種到多孔板中。
2.2、培養細胞:培養3-5天(可根據試驗目的和要求決定培養時間)。
2.3、呈色:培養3-5天后,每孔加MTT溶液。繼續孵育,加DMSO,使結晶物充分融解。
2.4、比色:在 490nm波長下檢測吸光值,以時間為橫坐標,吸光值為縱坐標繪制細胞生長曲線。
不足:工作量大,且溶解甲瓚的有機溶劑有毒性,對細胞造成損傷。
3. BrdU染色法
BrdU(5-溴脫氧尿嘧啶核苷)可代替胸腺嘧啶選擇性整合到復制細胞中新合成的DNA中(細胞周期S期)。通過檢測BrdU的摻入,從而判斷細胞的增殖能力。
簡易實驗流程如下:
3.1、對細胞進行接種,根據不同條件進行藥物處理。
3.2、制備適量BrdU培養基,孵育。除去培養液,用PBS洗滌。
3.3、加入多聚甲醛常溫固定,PBS沖洗。
3.4、加入含 Triton X-100的PBS,在冰上將細胞膜穿刺,加入預冷的PBS沖洗。
3.5、加1抗即抗小鼠BrdU單抗(工作濃度1:50),陰性對照加PBS或血清。
3.6、按ABC法進行檢測,蘇木素或伊紅襯染,在顯微鏡或活細胞成像系統下拍照。
不足:破壞細胞結構,準確性較低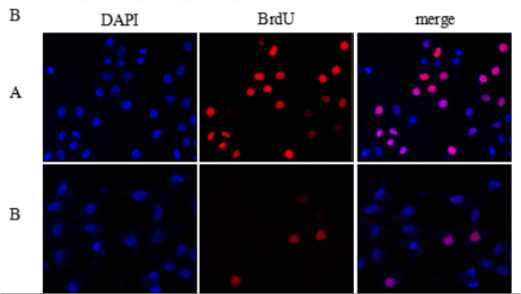
4. CCK-8法
CCK-8試劑中含有WST–8,可以被線粒體內的一些脫氫酶還原生成橙黃色的Formazan。用酶標儀在450nm波長處測定其光吸收值,可間接反映活細胞數量。
4.1、將處理過的細胞胰酶消化后計數,接種1000個細胞至96孔板,每孔100 μL培養基,將培養板置于培養箱中培養0 h、24h、48h和72h。
4.2、每孔加入10 μL CCK-8溶液,用加了相應量細胞培養液和CCK-8溶液但沒有加入細胞的孔作為空白對照。
4.3、在細胞培養箱內繼續孵育0.5h,用酶標儀在450nm測定吸光度。
不足:CCK-8價格較貴,且試劑顏色為淡紅色,與含酚紅的培養基顏色接近,操作過程中容易多加或漏加。
5. 克隆形成法
細胞在體外增殖,形成集落,集落的大小和數量反應該細胞獨立生存能力和增殖能力,從而反映細胞增殖的情況。
實驗流程:
5.1、接種細胞于六孔板中,輕輕混勻后放入培養箱中培養。
5.2、培養過夜后,根據實驗目的加入藥物或其他處理。
5.3、每隔一定時間更換一次培養基,培養2周后,去除培養基,加入PBS洗一次。
5.4、加入多聚甲醛或者乙醇固定,去除培養基,加入結晶紫染色液,常溫染色。
5.5、加入PBS洗3次,將六孔板放入烘箱中烘干,對克隆細胞進行計數和拍照。
不足:培養時間長,操作繁瑣,頻繁取出觀察,影響細胞生長環境。
綜上所述,傳統的細胞增殖檢測方法,操作繁瑣,需頻繁將細胞拿出培養箱,且個別試劑會對細胞結構造成影響。耗時、耗力、實驗成功率不能保證,最終影響實驗效率。
那么,有什么新工具可以彌補這些不足,助力細胞增殖實驗呢?持續關注奎克泰生物,下篇文章將繼續為您科普細胞增殖知識~
細胞增殖是生物體生長、發育、繁殖和遺傳的基礎,細胞以分裂的方式進行增殖。
細胞增殖能力是細胞活性的直接表現。

1.細胞計數法
細胞增殖表現為細胞數目的增多,通過計數板和細胞計數儀得出細胞數目,繪制生長曲線。
操作方法:一般過程為接種細胞,分組培養7天,逐日檢測細胞數量,根據細胞數量繪制成圖,即為細胞生長曲線。
不足:操作繁瑣,需頻繁將細胞拿出培養箱,不適合數量較多或特定亞群的細胞計數。

活細胞線粒體中的琥珀酸脫氫酶能使外源性MTT還原為水不溶性的藍紫色結晶甲瓚(Formazan)并沉積在細胞中,而死細胞無此功能。
簡易流程:
2.1、接種細胞:制備細胞懸液,將細胞接種到多孔板中。
2.2、培養細胞:培養3-5天(可根據試驗目的和要求決定培養時間)。
2.3、呈色:培養3-5天后,每孔加MTT溶液。繼續孵育,加DMSO,使結晶物充分融解。
2.4、比色:在 490nm波長下檢測吸光值,以時間為橫坐標,吸光值為縱坐標繪制細胞生長曲線。
不足:工作量大,且溶解甲瓚的有機溶劑有毒性,對細胞造成損傷。
3. BrdU染色法
BrdU(5-溴脫氧尿嘧啶核苷)可代替胸腺嘧啶選擇性整合到復制細胞中新合成的DNA中(細胞周期S期)。通過檢測BrdU的摻入,從而判斷細胞的增殖能力。
簡易實驗流程如下:
3.1、對細胞進行接種,根據不同條件進行藥物處理。
3.2、制備適量BrdU培養基,孵育。除去培養液,用PBS洗滌。
3.3、加入多聚甲醛常溫固定,PBS沖洗。
3.4、加入含 Triton X-100的PBS,在冰上將細胞膜穿刺,加入預冷的PBS沖洗。
3.5、加1抗即抗小鼠BrdU單抗(工作濃度1:50),陰性對照加PBS或血清。
3.6、按ABC法進行檢測,蘇木素或伊紅襯染,在顯微鏡或活細胞成像系統下拍照。
不足:破壞細胞結構,準確性較低

4. CCK-8法
CCK-8試劑中含有WST–8,可以被線粒體內的一些脫氫酶還原生成橙黃色的Formazan。用酶標儀在450nm波長處測定其光吸收值,可間接反映活細胞數量。
4.1、將處理過的細胞胰酶消化后計數,接種1000個細胞至96孔板,每孔100 μL培養基,將培養板置于培養箱中培養0 h、24h、48h和72h。
4.2、每孔加入10 μL CCK-8溶液,用加了相應量細胞培養液和CCK-8溶液但沒有加入細胞的孔作為空白對照。
4.3、在細胞培養箱內繼續孵育0.5h,用酶標儀在450nm測定吸光度。
不足:CCK-8價格較貴,且試劑顏色為淡紅色,與含酚紅的培養基顏色接近,操作過程中容易多加或漏加。
5. 克隆形成法
細胞在體外增殖,形成集落,集落的大小和數量反應該細胞獨立生存能力和增殖能力,從而反映細胞增殖的情況。
實驗流程:
5.1、接種細胞于六孔板中,輕輕混勻后放入培養箱中培養。
5.2、培養過夜后,根據實驗目的加入藥物或其他處理。
5.3、每隔一定時間更換一次培養基,培養2周后,去除培養基,加入PBS洗一次。
5.4、加入多聚甲醛或者乙醇固定,去除培養基,加入結晶紫染色液,常溫染色。
5.5、加入PBS洗3次,將六孔板放入烘箱中烘干,對克隆細胞進行計數和拍照。
不足:培養時間長,操作繁瑣,頻繁取出觀察,影響細胞生長環境。
綜上所述,傳統的細胞增殖檢測方法,操作繁瑣,需頻繁將細胞拿出培養箱,且個別試劑會對細胞結構造成影響。耗時、耗力、實驗成功率不能保證,最終影響實驗效率。
那么,有什么新工具可以彌補這些不足,助力細胞增殖實驗呢?持續關注奎克泰生物,下篇文章將繼續為您科普細胞增殖知識~
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





