胃抑制肽受體GIPR在肥胖癥與糖尿病治療中的應用及相關實驗介紹
胃抑制肽受體(Gastric inhibitory polypeptide receptor,GIPR)屬于G蛋白偶聯受體,在脂肪生成、胰島β細胞增殖和胰島素釋放等方面發揮重要作用,與2型糖尿病、肥胖癥和神經退行性疾病相關,對維持正常的代謝狀態至關重要。大量研究數據顯示,GIPR有潛力成為治療肥胖癥和糖尿病的關鍵靶點。
GIPR結構與功能
人的GIPR為G蛋白偶聯受體,由466個氨基酸組成,該受體包含一個大的胞外N端結構域,參與配體識別和結合,其核心部分由七個跨膜α-螺旋(TM1-TM7)構成,參與信號轉導。
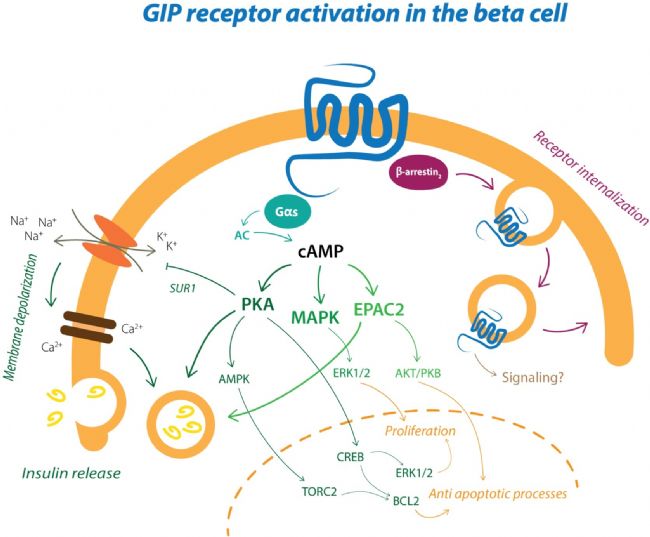
GIPR在胰腺細胞、胃、小腸、腎上腺皮質、脂肪組織、心臟、骨骼、垂體、肺和脾臟等組織均有表達,其中胰腺β細胞表達最高。它通過激活G蛋白,提升細胞內cAMP和Ca2+水平,并通過PI3K、PAK、PKB等信號通路調控下游基因的表達。下圖為β細胞中GIPR受體被激活時產生的信號通路。
GIPR結構與功能
人的GIPR為G蛋白偶聯受體,由466個氨基酸組成,該受體包含一個大的胞外N端結構域,參與配體識別和結合,其核心部分由七個跨膜α-螺旋(TM1-TM7)構成,參與信號轉導。
GIPR在胰腺細胞、胃、小腸、腎上腺皮質、脂肪組織、心臟、骨骼、垂體、肺和脾臟等組織均有表達,其中胰腺β細胞表達最高。它通過激活G蛋白,提升細胞內cAMP和Ca2+水平,并通過PI3K、PAK、PKB等信號通路調控下游基因的表達。下圖為β細胞中GIPR受體被激活時產生的信號通路。
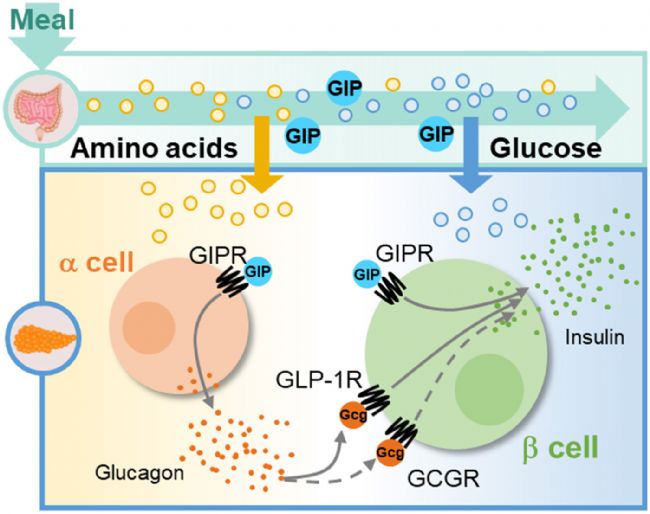
GIPR的內源性配體是GIP,GIP激活GIPR后,可調節餐后血糖濃度。在高血糖時,GIP促進胰島β細胞分泌胰島素;在低血糖時,刺激胰島α細胞釋放胰高血糖素,從而維持血糖穩態。(如下圖所示)
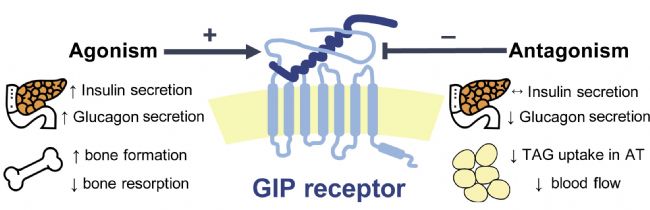
當人體攝入食物后,GIPR信號能夠促進胰島素分泌,從而降低血糖水平。同時,GIPR還影響脂肪細胞的儲存和代謝,以及肝臟中的葡萄糖合成和釋放。大量研究表明,GIPR在調控胰島素分泌、血糖和脂肪代謝方面發揮著重要作用,對于維持正常的代謝狀態至關重要。下圖為GIPR分別與激動劑、拮抗劑結合后身體產生的變化。
GIPR在疾病中作用
GIPR與GLP-1R相似,在控制食欲和體重方面具有潛在作用,它能夠減少食欲,從而幫助糖尿病患者減輕體重并控制血糖水平,有望在控制肥胖、糖尿病等代謝性疾病的發生和發展中發揮關鍵作用,是一個非常重要的治療靶點。
GIPR相關藥物研發
GIPR靶向治療作為代謝性疾病領域的新型治療策略,在2型糖尿病和肥胖癥等疾病的治療中展現出潛在應用價值。現階段針對該受體的藥物研發已形成多元化技術路線,主要包括小分子化藥,合成多肽,融合蛋白,抗體,雙特異性抗體等。
Tirzepatide:
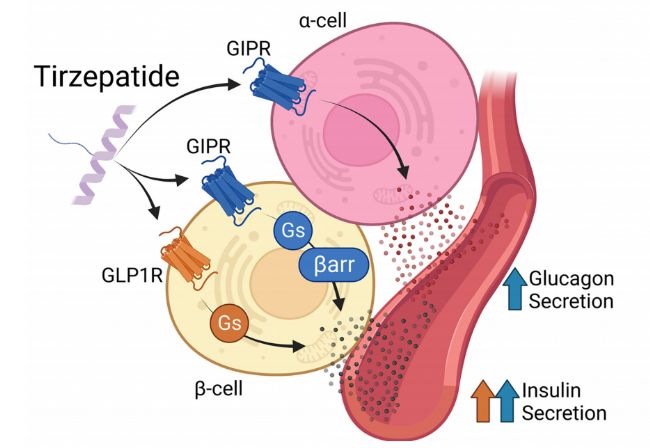
Tirzepatide作為GIPR和GLP-1R的雙重激動劑,于2022年獲得美國FDA批準上市。該藥物通過激活胰島β細胞表面的GLP-1R和GIPR,有效促進胰島素的合成與分泌。它與天然GIP類似,結合GIPR受體,作為完全激動劑通過Gs/cAMP和β-arrestin通路發出信號。Tirzpeatide 還通過GIPR刺激α細胞分泌胰高血糖素。具體如下圖所示。
Retatrutide:
Retatrutide是由禮來公司研發的一種新型藥物,為GLP-1/GIP/GCG三靶點激動劑。一項Retatrutide II期研究發現,治療48周后,Retatrutide各劑量組受試者體重均明顯降低,其中12mg Retatrutide組在24周治療后體重降低17.5%,48周時減重幅度更是達到24.2%。
GMA-106:
GMA-106是鴻運華寧開發的一種雙特異性抗體,靶向GIPR和GLP-1R,通過調節這兩條通路來減少食欲和脂肪積累。由于半衰期延長,GMA-106可能提供更靈活的給藥方案(每周或每月),提高患者依從性。在臨床前研究中,GMA-106在減少體重和體脂方面表現突出,有望成為治療肥胖、非酒精性脂肪肝(NASH)和2型糖尿病(T2DM)的有效藥物。
當前,GIPR在糖代謝和脂肪代謝中起重要作用,可能在糖尿病、肥胖、心血管疾病、代謝綜合征等多個領域具有廣泛應用前景,此外還對神經內分泌腫瘤有潛在治療作用。總之,GIPR是一個值得關注的靶點,未來還將有更多的GIPR相關藥物涌現。
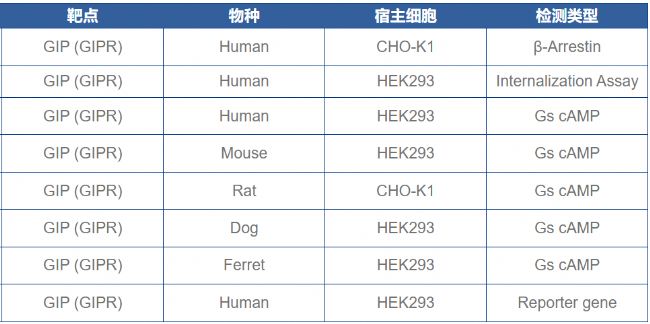
格寧生物相關實驗
GIPR: β-Arrestin/Gs cAMP/Reporter gene/ Internalization Assay檢測
參考文獻
- El K, Gray SM, Capozzi ME, Knuth ER, Jin E, Svendsen B, Clifford A, Brown JL, Encisco SE, Chazotte BM, Sloop KW, Nunez DJ, Merrins MJ, D'Alessio DA, Campbell JE. GIP mediates the incretin effect and glucose tolerance by dual actions on α cells and β cells. Sci Adv. 2021 Mar 12;7(11):eabf1948. doi: 10.1126/sciadv.abf1948. PMID: 33712466; PMCID: PMC7954443.
- Yu X , Chen S , Funcke J B ,et al.The GIP receptor activates futile calcium cycling in white adipose tissue to increase energy expenditure and drive weight loss in mice[J].Cell Metabolism, 2025, 37(1):187-204.e7.DOI:10.1016/j.cmet.2024.11.003.
- Smit FX, van der Velden WJC, Kizilkaya HS, Nørskov A, Lückmann M, Hansen TN, Sparre-Ulrich AH, Qvotrup K, Frimurer TM, Rosenkilde MM. Investigating GIPR (ant)agonism: A structural analysis of GIP and its receptor. Structure. 2021 Jul 1;29(7):679-693.e6. doi: 10.1016/j.str.2021.04.001. Epub 2021 Apr 22. PMID: 33891864.
- Mayendraraj A, Rosenkilde MM, Gasbjerg LS. GLP-1 and GIP receptor signaling in beta cells - A review of receptor interactions and co-stimulation. Peptides. 2022 May;151:170749. doi: 10.1016/j.peptides.2022.170749. Epub 2022 Jan 19. PMID: 35065096.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





