文獻解讀:多孔粘彈性水凝膠的觸發式微孔形成生物打印

發表期刊:Materials Horizons
影響因子:12.2
發表年份:2020
作者單位:加拿大麥吉爾大學機械工程系
DOI:10.1039/d0mh00813c.
研究背景
再生醫學和組織工程的關鍵在于構建模擬生物組織力學特性和孔隙結構的支架。然而,現有技術難以同時實現孔隙大小和支架粘彈性的精確調控。
模擬宿主組織結構和力學的細胞負載支架對于廣泛的生物醫學應用非常重要,但生物打印仍具有挑戰性。為了應對這些挑戰,研究者報告了一種稱為觸發式微孔形成生物打印的新方法。 這種方法可以產生具有確定結構和互連孔隙的細胞負載支架,孔隙大小不一,涵蓋多種細胞類型。生物打印支架的粘彈性可以與生物組織的粘彈性相匹配,并且不受孔隙率和硬度的影響。盡管孔隙率較高,但生物打印支架也表現出卓越的機械堅固性。生物打印方法和由此產生的支架支持細胞擴散、遷移和增殖。 三維生物打印系統在聲帶組織工程和體外癌癥模型方面的潛力得到了證實。其他可能的應用還包括組織修復、再生醫學、芯片器官、藥物篩選、器官移植和疾病建模。
研究方案
1. 觸發微孔形成機制
- 使用殼聚糖和聚乙二醇(PEG)作為生物墨水,通過pH誘導微相分離形成細胞級孔隙。
- 水凝膠的粘彈性通過改變PEG濃度調節,同時保持其結構完整性。
2. 生物打印與測試
- 打印多層支架并評估其機械性能、孔隙結構、降解特性及細胞相容性。
- 在支架中培養聲帶成纖維細胞(hVFFs)和癌細胞(MDA-MB-231),驗證其組織工程和疾病建模能力。
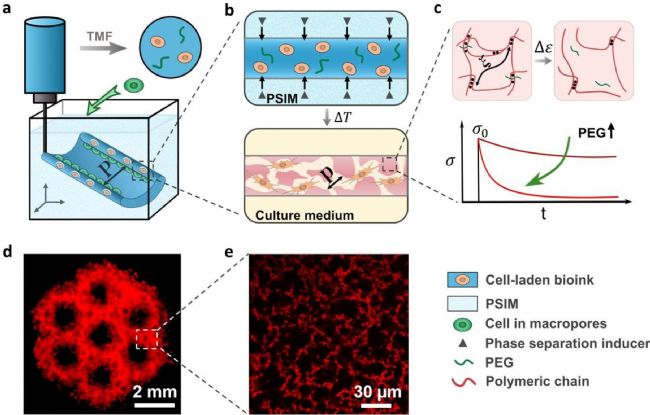
觸發式微孔形成(TMF)生物打印。(a)將含有細胞的生物墨水(深藍色)通過 TMF 生物打印技術制成具有確定結構(特征尺寸 P)的支架。(b) 在相分離誘導基質(PSIM,淺藍色)內形成的多孔粘彈性水凝膠(PVH),該基質支撐擠出的生物墨水并提供相分離誘導劑(灰色三角形),從而在高溫下形成細胞大小的孔(孔徑 p)。(c)以聚乙二醇(PEG)為交聯劑調節 PVH 的粘彈性響應。粘彈性響應表現為恒定應變下的應力松弛。(d)分層多孔支架的熒光圖像;比例尺為 2 毫米。(e)用羅丹明-B(紅色)標記的生物打印支架內部微孔的共焦圖像;比例尺為 30 微米。
研究成果
1. 支架結構與性能
- 打印的水凝膠具有高孔隙率(>60%)和細胞大小的互聯孔隙(平均約17.8 µm)。
- 水凝膠儲存模量范圍為0.5–27 kPa,可覆蓋大多數軟組織的力學需求。
2. 細胞相容性與功能
- 水凝膠支持細胞擴展、遷移和增殖,細胞存活率始終超過90%。
- 高孔隙率顯著提高了厚支架中的營養交換效率,避免了NEH(傳統彈性水凝膠)中的中心壞死現象。
3. 應用場景
- 聲帶工程: 打印的雙層支架能模擬聲帶的復雜層結構,促進細胞粘附和分布。
- 癌癥模型: PVH支架中癌細胞的增殖和聚集行為隨著粘彈性調節而變化,展現其對腫瘤侵襲性的影響。
未來展望
1. 創新貢獻
- TMF生物打印技術首次實現粘彈性、孔隙度和剛度的獨立調控,顯著擴展了生物打印材料的設計窗口。
2. 潛在應用
- 該技術可廣泛應用于組織修復、疾病建模、藥物篩選和器官移植等領域。
- 未來研究可進一步優化此方法并探索更多類型的生物墨水。
設備應用
在細胞運動研究中,用橙色 DNA 選擇性染色劑(Invitrogen 公司,V35005)對活細胞進行染色,染色后立即將其嵌入殼聚糖水凝膠中。將含有細胞的水凝膠轉移到無細胞粘附涂層的 8 孔培養板中,并使用JuLI™ Stage活細胞成像分析系統連續監測RFP通道超過48小時。
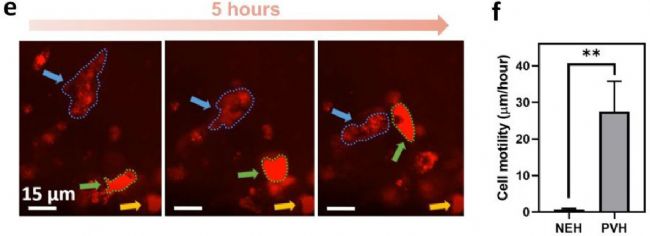
(e) hVFFs 在 PVH 內遷移的實時成像。兩個移動的細胞分別用藍色和綠色箭頭標記,一個靜止的細胞用黃色箭頭標記,以供參考。(f)PVH 和 NEH 內的細胞運動。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





