細(xì)胞凋亡的流式檢測(cè)實(shí)驗(yàn)步驟和結(jié)果解讀
凋亡如何測(cè)?流式圖看不懂?簡(jiǎn)簡(jiǎn)單單教你讀懂凋亡流式圖!!!!做個(gè)流式小能手~~
Section.01
什么是凋亡?
細(xì)胞凋亡 (Apoptosis),或者說是程序性細(xì)胞死亡,是細(xì)胞遵循自身基因指令進(jìn)行的一種有條不紊的自我毀滅過程。這個(gè)過程在生物體的正常發(fā)育和維持健康狀態(tài)中扮演著重要角色,并且在一些疾病狀態(tài)下也會(huì)發(fā)生[1]。
細(xì)胞凋亡會(huì)產(chǎn)生什么樣的變化呢?
早期階段,你會(huì)看到細(xì)胞開始皺縮變小,細(xì)胞核會(huì)破裂成碎片,同時(shí)細(xì)胞表面會(huì)出現(xiàn)一些泡泡狀的小突起,最終這些突起會(huì)分離出來,形成含有細(xì)胞內(nèi)部物質(zhì)的小包,我們稱之為“凋亡小體”。有趣的是,盡管細(xì)胞正在分解,但它的外層膜仍然保持完整,確保了細(xì)胞內(nèi)容物不會(huì)隨意泄漏出去。
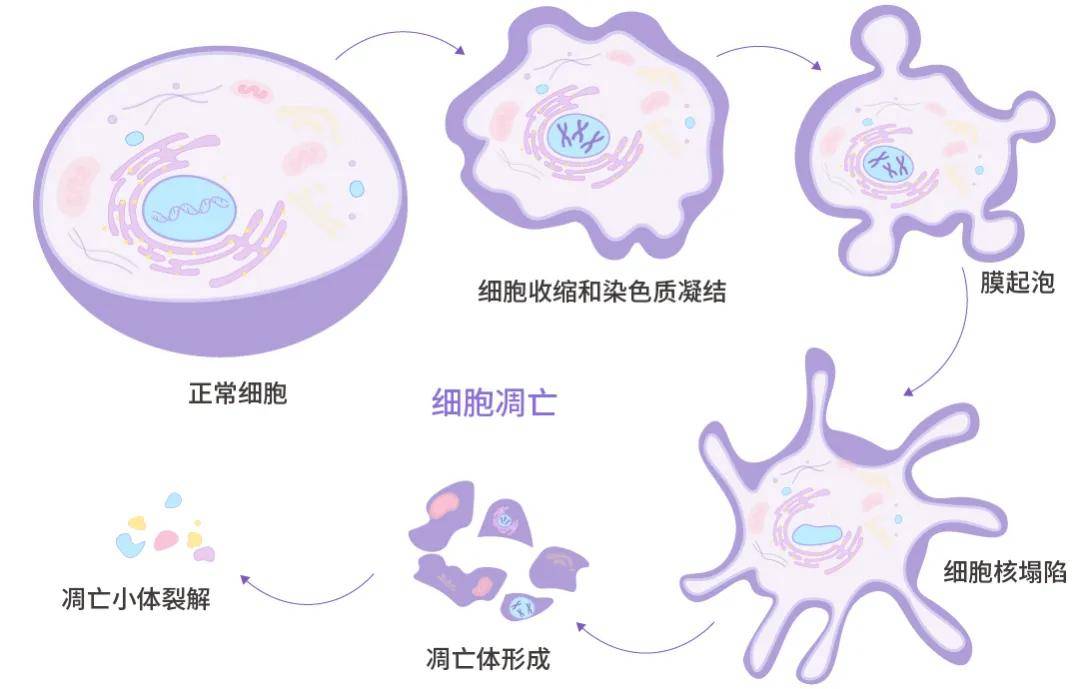 圖 1. 細(xì)胞凋亡過程。
圖 1. 細(xì)胞凋亡過程。
除此之外,細(xì)胞內(nèi)部還會(huì)發(fā)生一系列化學(xué)反應(yīng),例如激活特定的酶 (Caspase),這些酶會(huì)進(jìn)一步切割其他蛋白質(zhì),像 PARP 這樣的底物。還有,線粒體中的細(xì)胞色素 c 會(huì)被釋放到細(xì)胞質(zhì)中,DNA 會(huì)被切割成小片段。細(xì)胞膜也會(huì)發(fā)生變化,比如位于膜內(nèi)側(cè)的磷脂酰絲氨酸 (PS) 會(huì)翻轉(zhuǎn)到外側(cè),同時(shí)線粒體膜電位也會(huì)改變。最后,調(diào)控細(xì)胞生死命運(yùn)的蛋白家族成員,如 Bax、Bid、Bcl-2 等,它們的表達(dá)量也會(huì)有所調(diào)整,以促進(jìn)或抑制細(xì)胞凋亡的過程[1][2][3]。
Section.02
如何檢測(cè)凋亡呢?
那怎么檢測(cè)細(xì)胞凋亡呢?我們?cè)谶@介紹了兩種流式檢測(cè)方法,如果你感興趣的話讓我們一起看下去吧~
首先,最常用的細(xì)胞凋亡檢測(cè)方法是 Annexin V/PI 雙染法。
Annexin V 是一種依賴鈣離子的蛋白質(zhì),能特異性地綁定到細(xì)胞膜上的磷脂酰絲氨酸 (PS)。在健康細(xì)胞中,PS 位于細(xì)胞膜內(nèi)側(cè);而在凋亡早期,PS 會(huì)移到外側(cè)。因此,用熒光標(biāo)記 (如 FITC) 的 Annexin V 可以檢測(cè)到這個(gè)變化,表明細(xì)胞開始凋亡。
PI (碘化丙啶) 是一種紅色熒光染料,它不能進(jìn)入活細(xì)胞或早期凋亡細(xì)胞,但可以進(jìn)入已經(jīng)死亡或晚期凋亡細(xì)胞,因?yàn)檫@些細(xì)胞的膜已經(jīng)破損。
所以,通過 Annexin V 和 PI 的結(jié)合使用,我們可以區(qū)分早期凋亡、晚期凋亡和壞死的細(xì)胞。這種方法可以通過流式細(xì)胞儀或熒光顯微鏡輕松完成檢測(cè)。
其次,我們還可以檢測(cè)線粒體跨膜電位 (∆ΨM),在具有較高 ∆ΨM 的健康細(xì)胞中,JC-1 染料可進(jìn)入細(xì)胞并在線粒體中積累,形成 J-aggregates 發(fā)出橙紅色熒光。在凋亡細(xì)胞中,∆ΨM 較低,JC-1 染料進(jìn)入線粒體較少,以單體形式存在發(fā)出綠色熒光。
Section.03
案例: Annexin V/PI 法檢測(cè)
接下來,讓我們一起來看看 Annexin V/PI 法檢測(cè)實(shí)戰(zhàn)吧!
案例一

為了探究敲低 MUC16 對(duì)鼻咽癌細(xì)胞系 C666-1 和 HK-1 的糖酵解以及免疫逃逸能力的影響,作者利用Annexin V-FITC/PI 凋亡檢測(cè)試劑盒 (HY-K1073) 評(píng)估了鼻咽癌細(xì)胞在不同處理?xiàng)l件下的凋亡情況[4]。
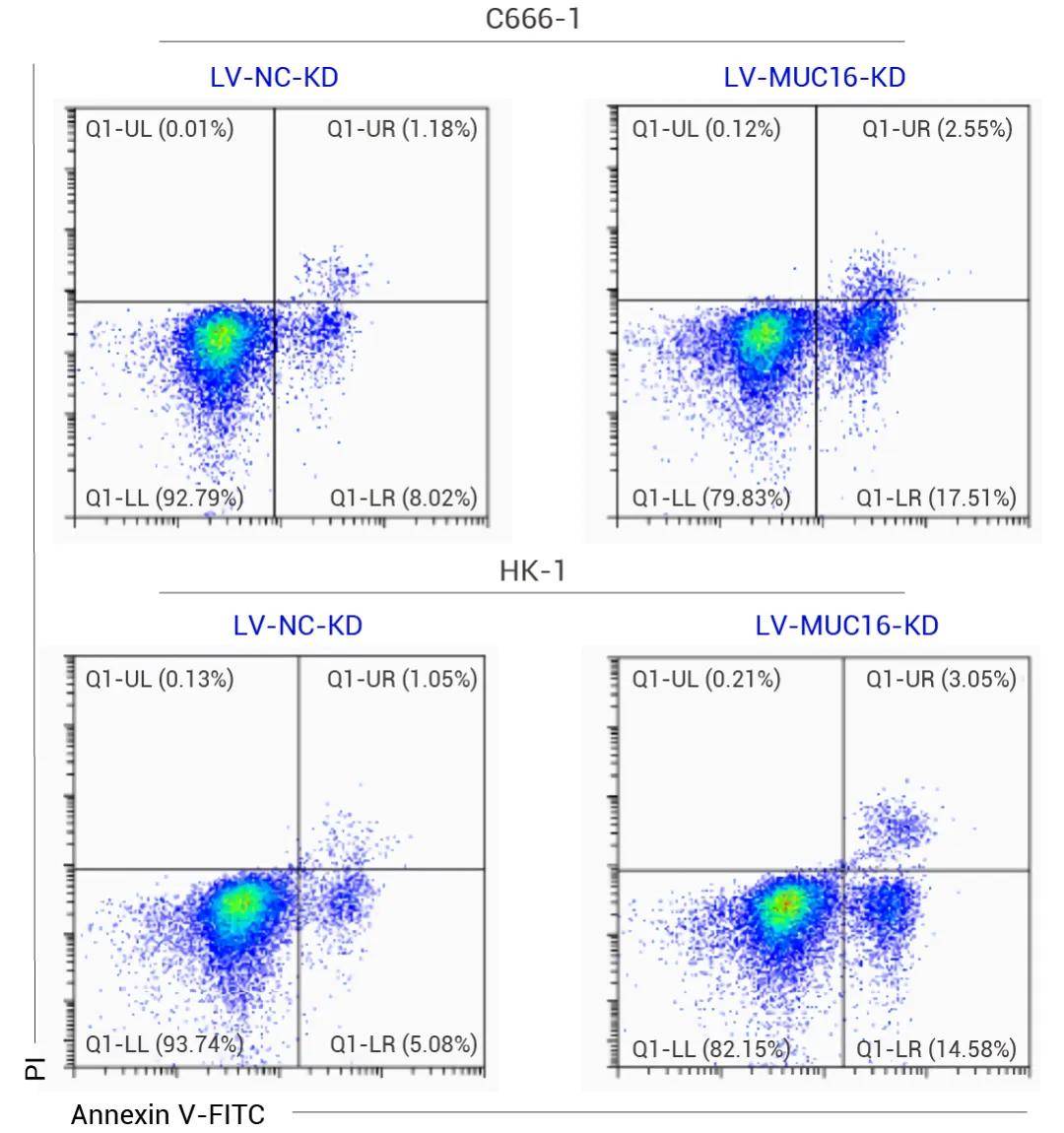 圖 2. 流式細(xì)胞術(shù)顯示 C666-1 和 HK-1 細(xì)胞中 MUC-16 的缺失誘導(dǎo)了細(xì)胞凋亡[4]。
圖 2. 流式細(xì)胞術(shù)顯示 C666-1 和 HK-1 細(xì)胞中 MUC-16 的缺失誘導(dǎo)了細(xì)胞凋亡[4]。
a. 活細(xì)胞中,不可檢測(cè)到 Annexin V-FITC/PI 的熒光。因?yàn)榛罴?xì)胞的細(xì)胞膜完整,不結(jié)合 Annexin V-FITC,PI 也無法穿過細(xì)胞膜進(jìn)入細(xì)胞,不發(fā)光。
b. 早期凋亡細(xì)胞中,可以檢測(cè)到 Annexin V-FITC 的熒光,但不可檢測(cè)到 PI 的熒光。因?yàn)榧?xì)胞膜磷脂酰絲氨酸 (PS) 外翻,Annexin V 可以結(jié)合,但細(xì)胞膜完整,PI 無法穿過細(xì)胞膜進(jìn)入細(xì)胞,顯示出綠色熒光。
c. 晚期凋亡細(xì)胞中,均可以檢測(cè)到 Annexin V-FITC/PI 的熒光。因?yàn)榧?xì)胞膜的完整性被破壞,Annexin V-FITC/PI 都可以進(jìn)入細(xì)胞,顯示出綠色和紅色熒光。
d. 流式圖的縱坐標(biāo)是 PI,在左上 (Q1-UL) 區(qū)域,發(fā)出紅色熒光,紅色熒光越強(qiáng),表示細(xì)胞死亡越嚴(yán)重。流式圖的橫坐標(biāo)是 Annexin V-FITC,在右下 (Q1-LR) 區(qū)域發(fā)出綠色熒光,綠色熒光越強(qiáng),表示早期凋亡細(xì)胞越多。左下 (Q1-LL) 是正常細(xì)胞,不發(fā)光。右上 (Q1-UR) 是晚期凋亡細(xì)胞和壞死細(xì)胞,發(fā)出綠色和紅色兩種熒光。
案例二

為了評(píng)估不同濃度的 1,25(OH)2D3 對(duì)頭腎巨噬細(xì)胞 (HKMs) 細(xì)胞活力的影響,作者利用 Annexin V-iFluor 488/PI (HY-K1080) 檢測(cè)細(xì)胞凋亡[5]。
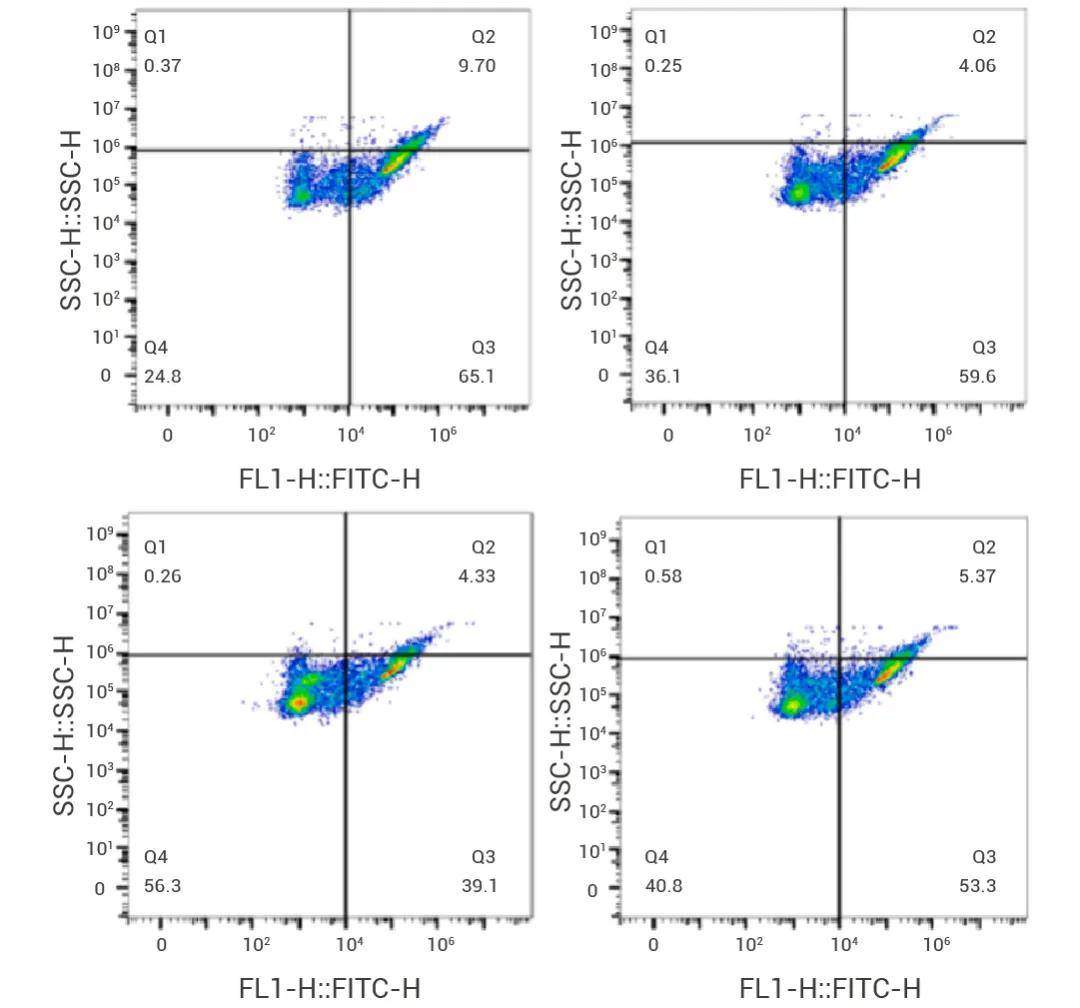 圖 3. 流式細(xì)胞術(shù)檢測(cè) 1,25-(OH)2D3 對(duì) HKMs 細(xì)胞凋亡的影響[5]。
圖 3. 流式細(xì)胞術(shù)檢測(cè) 1,25-(OH)2D3 對(duì) HKMs 細(xì)胞凋亡的影響[5]。
a. 1,25(OH)2D3 未處理組活細(xì)胞百分比為 24.8%。
b. 1 nM 處理組肝細(xì)胞百分比為 36.1%。
c. 10 nM 處理組活細(xì)胞百分比為 56.3%。
d. 100 nM 處理組活細(xì)胞百分比為 40.8%。
e. 流式圖的橫坐標(biāo)是 FL1-H (FITC-H) 代表 Annexin V-iFluor 488 的熒光強(qiáng)度。Annexin V-iFluor 488 用于檢測(cè)早期凋亡細(xì)胞。流式圖縱坐標(biāo)是 SSC-H (SSC-H) 代表側(cè)向散射光強(qiáng)度,用于檢測(cè)細(xì)胞的顆粒性和細(xì)胞內(nèi)結(jié)構(gòu)的復(fù)雜性,側(cè)向散射光強(qiáng)度通常與細(xì)胞內(nèi)顆粒物的大小和數(shù)量有關(guān)。
f. 低側(cè)向散射 (SSC-H) 和低 Annexin V-iFluor 488 熒光強(qiáng)度 (FL1-H)。通常代表活細(xì)胞。高側(cè)向散射 (SSC-H) 和高 Annexin V-iFluor 488 熒光強(qiáng)度 (FL1-H)。通常代表細(xì)胞凋亡晚期或壞死細(xì)胞。高側(cè)向散射 (SSC-H) 和低 Annexin V-iFluor 488 熒光強(qiáng)度 (FL1-H)。通常代表細(xì)胞凋亡早期。低側(cè)向散射 (SSC-H) 和高 Annexin V-iFluor 488 熒光強(qiáng)度 (FL1-H)。通常代表細(xì)胞凋亡早期。
Annexin V/PI 法檢測(cè)實(shí)驗(yàn)步驟和注意事項(xiàng)
(以 HY-K1073 為例)
1. 細(xì)胞與 Annexin V-FITC 和 PI 孵育
1.1 收集細(xì)胞:收集 1-5 × 105 個(gè)細(xì)胞。
- 懸浮細(xì)胞:1000 g 離心 5 min,棄去上清。加入 1 mL 預(yù)冷的 PBS 輕輕重懸細(xì)胞沉淀,1000 g 離心 5 min,棄去上清,保留細(xì)胞沉淀。
- 貼壁細(xì)胞:小心吸取細(xì)胞培養(yǎng)液保存?zhèn)溆谩<尤?PBS 洗滌后,加入適量胰酶消化液 (盡量不含 EDTA,以免影響 Annexin V 和 PS 的結(jié)合) 消化細(xì)胞。加入前面收集的培養(yǎng)液,輕輕吹打細(xì)胞,制成單細(xì)胞懸液,1000 g 離心 5 min,棄去上清。加入 1 mL 預(yù)冷的 PBS 輕輕重懸細(xì)胞沉淀,1000 g 離心 5 min,棄去上清,保留細(xì)胞沉淀。注:建議胰酶消化液不含 EDTA。
2. 加入 195 μL Binding Buffer,輕輕重懸細(xì)胞。
3. 加入 5 μL Annexin V-FITC,輕輕混勻。
4. 加入 10 μL PI Stain,輕輕混勻。
5. 室溫下避光孵育 10-20 min。
注:孵育過程中可輕輕顛倒數(shù)次以加強(qiáng)染色效果。
6. 流式細(xì)胞儀檢測(cè):用流式細(xì)胞儀檢測(cè)熒光強(qiáng)度。
01
注意事項(xiàng)
a. 流式檢測(cè)時(shí),Annexin V-FITC 最大激發(fā)波長(zhǎng)為 488 nm,最大發(fā)射波長(zhǎng)為 525 nm,在 FL1 通道檢測(cè);PI-DNA 最大激發(fā)波長(zhǎng)為 535 nm,最大發(fā)射波長(zhǎng)為 617 nm,在 FL2 或FL3 通道檢測(cè)。
b. 建議設(shè)置三組對(duì)照:未染色組、PI 單染組及 Annexin V-FITC 單染組。
c. 所有操作應(yīng)盡量快速,避免細(xì)胞長(zhǎng)時(shí)間暴露于非生理?xiàng)l件下。
d. 染色后的樣本需盡快分析,以防止染料信號(hào)減弱影響結(jié)果準(zhǔn)確性。
Section.04
案例:
JC-1 法檢測(cè)線粒體跨膜電位
那么 JC-1 法檢測(cè)線粒體跨膜電位是怎么做的呢?一個(gè)案例帶你讀懂 JC-1 法!
文獻(xiàn)中為了檢測(cè)人參皂苷 Rd 在高糖條件下對(duì)細(xì)胞狀態(tài)的影響,利用 JC-1 (HY-15534) 檢測(cè)線粒體膜電位變化[6]。
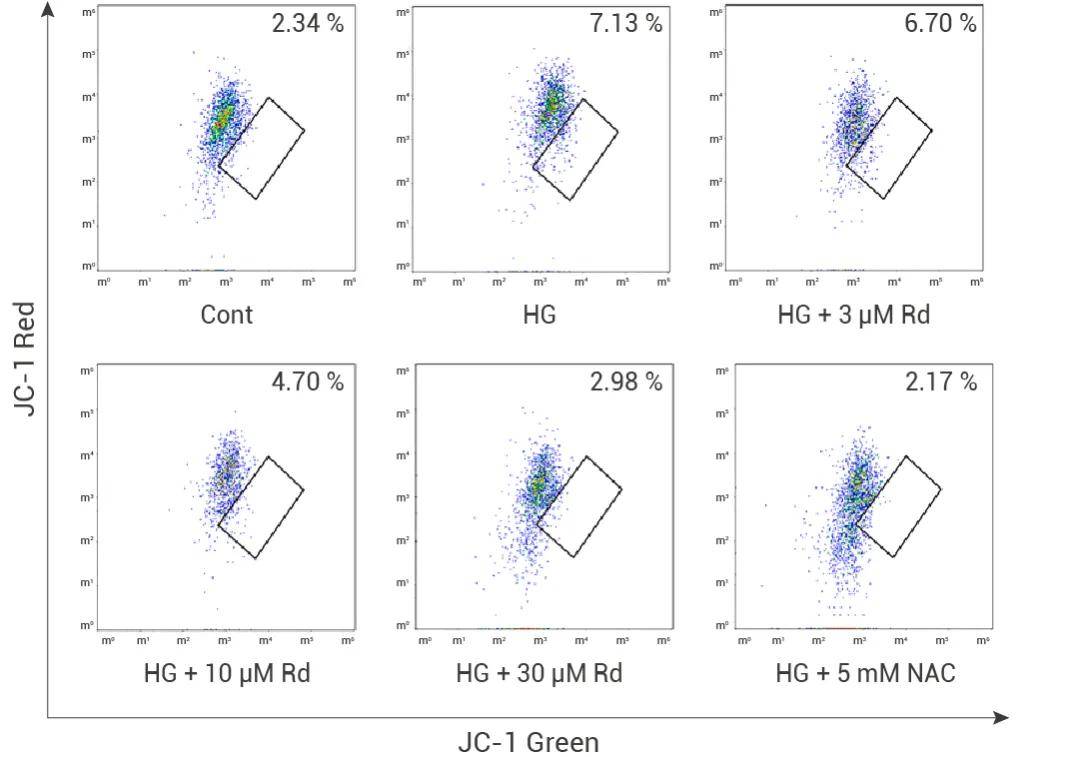 圖 4. 流式細(xì)胞術(shù)顯示人參皂苷 Rd 和 NAC 對(duì)高糖誘導(dǎo)的線粒體功能障礙具有保護(hù)作用[6]。
圖 4. 流式細(xì)胞術(shù)顯示人參皂苷 Rd 和 NAC 對(duì)高糖誘導(dǎo)的線粒體功能障礙具有保護(hù)作用[6]。
a. 高糖處理 (HG) 導(dǎo)致線粒體膜電位下降,表現(xiàn)為綠色熒光增加。
b. 人參皂苷 Rd 和 NAC 均能部分或完全恢復(fù)高糖處理導(dǎo)致的線粒體膜電位下降,表現(xiàn)為綠色熒光減少,紅色熒光增加。
c. 人參皂苷 Rd 的效果隨著濃度的增加而增強(qiáng)。
實(shí)驗(yàn)步驟與注意事項(xiàng)
一、JC-1 染色液的配制
- 制備儲(chǔ)存液
用 DMSO 配制 5 mg/mL 的 JC-1。如用 1 mL DMSO 溶解 5 mg JC-1。
注意:1) JC-1 儲(chǔ)存液建議分裝后于 -20℃ 或 -80℃ 避光保存。
- 工作液的配制
用預(yù)熱好的無血清細(xì)胞培養(yǎng)基或 PBS 稀釋儲(chǔ)存液,配制成 1-20 μg/mL 的 JC-1 工作。
注意:
1) 請(qǐng)根據(jù)實(shí)際情況調(diào)整 JC-1 工作液濃度,且現(xiàn)用現(xiàn)配。
2) 如果 JC-1 進(jìn)入細(xì)胞的效果不好,可向工作也液中加入適量 20% Pluronic F127 溶液,終濃度為 0.02-0.05%,Pluronic F127 可以防止 JC-1 在緩沖液中聚合并幫助其進(jìn)入細(xì)胞。
二、JC-1 染色
1. 以 6 孔板為例進(jìn)行細(xì)胞鋪板,密度為 5×105 cells/mL。37℃,5% CO2 培養(yǎng)箱培養(yǎng)過夜。
注意:進(jìn)行凋亡誘導(dǎo)時(shí)的細(xì)胞密度建議不超過 1×106/mL,也可根據(jù)自己的細(xì)胞類型培養(yǎng)至合適的密度。
2. 取 0.5 mL 細(xì)胞懸液至無菌的離心管內(nèi)。
3. 400 g 離心 3-5 min;棄上清。
4. 用 1 mL JC-1 工作液重懸細(xì)胞,于 37℃,5% CO2 培養(yǎng)箱孵育 15-30 min。
5. 室溫條件 400 g 離心 5 min;吸掉上清。
6. 用 2 mL 細(xì)胞培養(yǎng)液或者緩沖液重懸細(xì)胞,之后室溫條件 400 g 離心 5 min;棄上清,重復(fù)兩次。
7. 用 1 mL 新鮮培養(yǎng)液或者緩沖液重懸細(xì)胞,立刻進(jìn)行后續(xù)的流式分析或熒光顯微鏡觀察。
8. 數(shù)據(jù)分析 (流式細(xì)胞儀):含有紅色 JC-1 聚集物的健康細(xì)胞線粒體用 FL2 通道檢測(cè);含有綠色 JC-1 單體的凋亡或不健康細(xì)胞用 FL1 (FITC) 通道檢測(cè)。
Section.05
小結(jié)
用流式細(xì)胞術(shù)檢測(cè)細(xì)胞凋亡,你學(xué)會(huì)了嗎?如果你覺得這篇干貨滿滿的凋亡檢測(cè)方法有幫助,記得動(dòng)動(dòng)小手點(diǎn)贊收藏哦!!!我們下期見,為大家?guī)砀嗟目蒲行「韶泘
萌家細(xì)胞凋亡相關(guān)產(chǎn)品推薦








[1] Susan Elmore, et al. Apoptosis: a review of programmed cell death. Toxicol Pathol. 2007 Jun;35(4):495-516.
[2] Rebecca C Taylor, et al. Apoptosis: controlled demolition at the cellular level. Nat Rev Mol Cell Biol. 2008 Mar;9(3):231-41.
[3] Anna Chmurska, et al. Two Faces of Autophagy in the Struggle against Cancer. Int J Mol Sci. 2021 Mar 15;22(6):2981.
[4] Yueyang Liu, et al. Hypomethylation-associated ELF3 helps nasopharyngeal carcinoma to escape immune surveillance via MUC16-mediated glycolytic metabolic reprogramming. Am J Physiol Cell Physiol. 2024 Sep 2;327(4):C1125–C1142.
[5] Fengxia Zhao, et al. Oral administration of high-dose vitamin D3 can effectively suppress Nocardia seriolae infection in largemouth bass (Micropterus salmoides). Aquaculture. Volume 595, Part 2, 30 January 2025, 741643.
[6] Kai Tang, et al. Ginsenoside Rd ameliorates high glucose-induced retinal endothelial injury through AMPK-STRT1 interdependence. Pharmacol Res. 2022 May:179:106123.
- 細(xì)胞凋亡的流式檢測(cè)實(shí)驗(yàn)步驟和結(jié)果解讀
- 堿性固綠染色液說明書
- 全球干細(xì)胞臨床研究現(xiàn)狀與展望
- 造血干細(xì)胞與公認(rèn)單能干細(xì)胞的差異
- 干細(xì)胞的種類及在再生醫(yī)學(xué)中的作用
- 細(xì)胞培養(yǎng)時(shí)造成“黑膠蟲”及“黑點(diǎn)”污染的綜合分析與解決辦法
- 原代細(xì)胞分離培養(yǎng)實(shí)驗(yàn)步驟及注意事項(xiàng)盤點(diǎn)
- 動(dòng)脈粥樣硬化(AS)進(jìn)程中脂質(zhì)代謝與巨噬細(xì)胞極化的相互作用關(guān)系研究
- GelNEST™基質(zhì)膠助力應(yīng)對(duì)貿(mào)易壁壘下的科研不確定性
- 拉曼技術(shù)在未來醫(yī)學(xué)中的應(yīng)用醫(yī)工融合沙龍成功舉行
- 博鷺騰試劑2025首次大促銷開啟,超多優(yōu)惠等你來
- 中喬新舟開學(xué)優(yōu)惠:細(xì)胞實(shí)驗(yàn)套裝980元,培養(yǎng)基折扣等
- 中喬新舟限時(shí)促銷:買細(xì)胞就送支原體檢測(cè)試劑盒
- 華威中儀試劑盒年末限時(shí)優(yōu)惠來襲,儲(chǔ)值享好禮
- 美德聲推出新品重組細(xì)胞系用于生產(chǎn)單克隆血型試劑
- 百螢小麥胚芽凝集素探針染料8折優(yōu)惠,買即贈(zèng)鼠標(biāo)墊





