高濃度蛋白檢測優化方法
在蛋白質濃度測定中,傳統方法如 Bradford法 和 Lowry法 雖然應用廣泛,但存在以下局限性:
1. 樣品稀釋需求高濃度樣品(如純化后的濃縮蛋白)需多次稀釋才能落入標準曲線線性范圍,操作繁瑣且可能引入稀釋誤差(如移液偏差)。
2. 試劑依賴性
依賴顯色反應(如Bradford試劑結合蛋白),需額外試劑配制和孵育時間(通常需10-30分鐘),無法即時檢測。
3. 干擾因素多
Bradford法對去垢劑(如Triton X-100)、強酸強堿敏感;
Lowry法易受還原劑(如DTT、β-巰基乙醇)干擾。
4. 樣品消耗量大
需數十至數百微升樣品(如Bradford法通常需50-100 μL),對珍貴微量樣本(如原代細胞裂解液)不友好。
與傳統方法相比,超微量紫外分光光度法通過以下特點實現了 “免稀釋”快速檢測:
1. 直接測量
基于蛋白質中色氨酸(Trp)和酪氨酸(Tyr)在280 nm的固有吸光度,無需添加試劑,直接通過吸光度計算濃度,省去顯色反應步驟。
2. 超微量檢測能力
僅需1-2 μL樣品,尤其適合微量或珍貴樣本。
通過光程縮短技術(如將1 cm光程縮短至0.05 mm),直接擴大線性檢測范圍(例如:1 mm光程下A280=2對應10 mg/mL,而0.05 mm光程下可測至200 mg/mL),避免稀釋需求。
3. 實時性與高通量
測量時間短(<10秒),可快速評估多個樣品。自動化檢測,減少人為操作誤差。
對于一些抗體生產研發的用戶,通常蛋白濃度比較高,樣品量比較大,同時樣品又很珍貴。比如在抗體藥物生產的層析純化階段,需快速測定多個洗脫組分的蛋白濃度以優化收集窗口。若采用Bradford法,僅樣品稀釋和孵育就可能耗費數十分鐘,顯著拖慢流程。而超微量紫外法(A280)通過直接測量、秒級出結果的特性,可無縫整合到自動化純化系統中,實現實時反饋與動態調控,將傳統數小時的質控環節壓縮至幾分鐘內完成。
然而,傳統的超微量紫外分光光度計測量蛋白濃度高于100mg/mL時,誤差就會偏大。以IgG蛋白為例:
| 蛋白(IgG)濃度范圍 | % 誤差 |
| 小于 10 mg/mL | ±3% |
| 10 – 45 mg/mL | ±5% |
| 45 – 110 mg/mL | ±10% |
| 110 – 220 mg/mL | ±20% |
| 220 – 400 mg/mL | ±50% |

雖然這一方法解決了測量精度的痛點,然而這種方法還有很多需要優化的地方:
A. 每次測量需要消耗至少200ul的樣品;
B. 且檢測上限最高只有300mg/ml;
C. 檢測時會消耗大量的耗材,增加長期使用的檢測成本;
D. 占用很大的實驗室空間。
有沒有一臺儀器可以一次性解決這些問題呢?
2025年的春天,我們帶著新面世的超微量紫外高精度旗艦版本(NanoDrop Ultra AP)來到了位于南京市的某知名上市藥企,研發和質檢的老師熱情的接待了我們。并拿出來兩個樣品(抗體1: 180mg/ml和抗體2: 150mg/ml)
讓我們現場測試。測試結果如下:
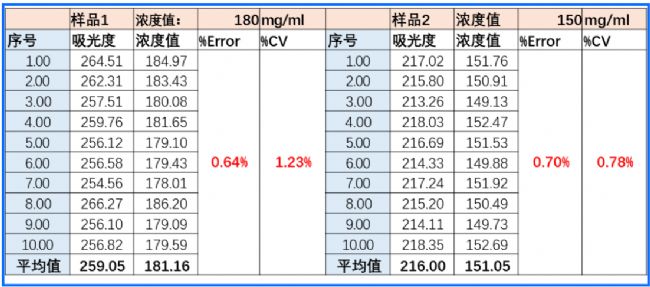
研發老師:測試結果出人意料,又快又準,測三個樣速度2分鐘,每次只要取2ul的樣品;以前我們要8分鐘,而且樣品量要100ml, 還得清洗器皿,定期換管子,買耗材好麻煩;
質檢老師:之前的方法還需要電腦上操作,驗證也得在電腦上做,確實不方便;
研發老師:這是什么神器,你們為啥不早點推出呢?
謝謝老師們的認可,這是NanoDrop新品:多功能高精度核酸蛋白測定儀。
1. 檢測上限提高至400mg/ml(IgG)
2. 三次重復測量時間僅需2分鐘
3. 每次檢測僅需2ul樣品
4. 無需任何耗材
5. 占地面積小,僅需572cm2的空間
6. 一機多用,除了高濃度蛋白檢測,還擁傳統NanoDrop的全部功能

更多關注,請聯系我們:
芮徠(上海)實驗儀器有限公司
標簽:
高濃度蛋白檢測
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





