層析技術的四大經典方式及其分離原理、優勢、適用場景和選擇要點
在生物制藥研發與生產中,層析技術作為實現高純度分離的重要手段,被廣泛應用于疫苗、抗體、重組蛋白等各類生物大分子的純化流程。層析的核心,是“填料”——這個看似不起眼的小球體,正是構筑高效純化工藝的關鍵所在。
本期推文將帶你走近層析技術的四大經典方式,了解其分離原理、優勢、適用場景以及選擇要點,為你的工藝開發和技術理解打下基礎。
凝膠過濾是一種根據生物分子的大小及形狀來分離物質的層析方法。凝膠過濾介質為多孔的網狀結構,生物分子越小,在介質中走過的路徑越長,出峰越靠后。選擇凝膠過濾介質關鍵在于選擇合適的分離范圍,其次要考慮介質的機械性能和可放大性。
凝膠過濾層析術語
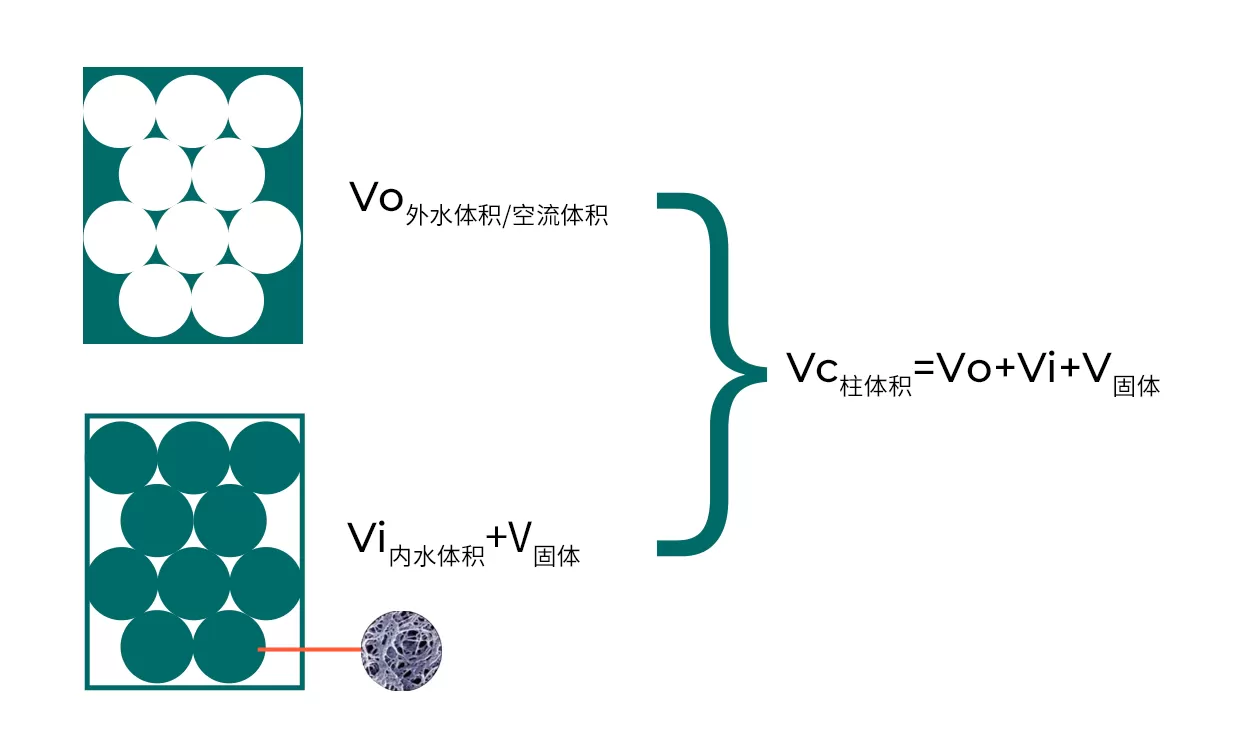
Fig.1 凝膠層析術語
大分子首先離開柱子,緊接著是中分子,最后是小分子。全部分離過程需要一個全柱體積的緩沖液通過凝膠過濾柱料。
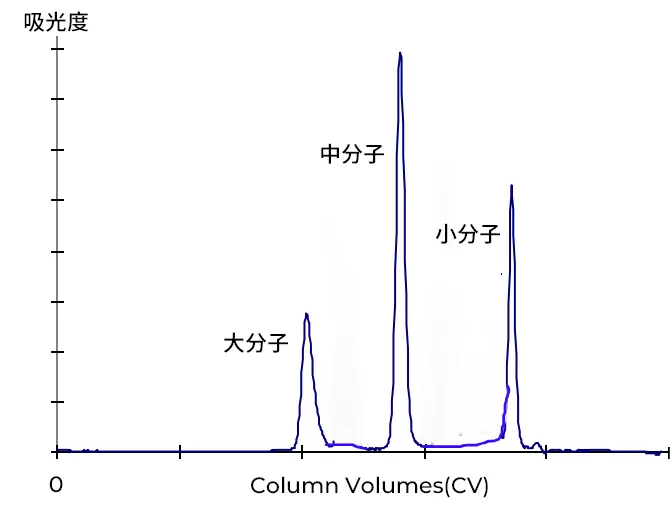
Fig.2 凝膠層析過程層析圖譜
緩沖液:Tris-HCl(pH7~8)、磷酸鹽緩沖液(pH6~7.5),低濃度NaCl(如150mM減少吸附)。
不同材質基架特點
• Bestdex:交聯的葡聚糖,常用于分子量差異極大的組群物質快速分離,如脫鹽、緩沖液置換。
• Bestarose:交聯的瓊脂糖,中等壓力下的高流速可提供良好的分辨率和速度,適用于工業規模的大分子純化。
• Chromdex:高度交聯的瓊脂糖和葡聚糖,分辨率高、硬度大,是精細純化階段的良好選擇。
填料選擇要點
每種介質的孔徑都有一定的范圍,選擇凝膠過濾介質的關鍵在于選擇合適的分離范圍,其次要考慮介質的機械性能和可放大性。
• 組群分離(緩沖液置換):可以從一組較大的分子中去除小分子,或者快速、簡單地進行緩沖液置換,上樣體積一般小于30%CV(Column Volume,柱體積 );
• 精細分離:去除其他層析方法沒有去除的雜質、多聚體等,上樣體積一般為0.5%~5%CV;
• 定性分析:分子量大小及分布的測定等。
離子交換層析是根據不同生物分子所帶表面電荷性質和數量的差異來分離的一種層析技術。由于生物分子大都帶有酸性基團和堿性基團,并且可以通過調節緩沖液的pH改變其帶電性質和數量,生物分子與帶相反電荷的陰離子交換填料或者陽離子交換填料相結合后,采用改變流動相中的離子強度或pH,讓結合弱的先洗脫下來,結合強的后洗脫下來,從而達到分離純化的目的。
蛋白質滴定曲線
每種蛋白質都有其獨特的凈電荷與pH的關系,可以將其顯示為滴定曲線。
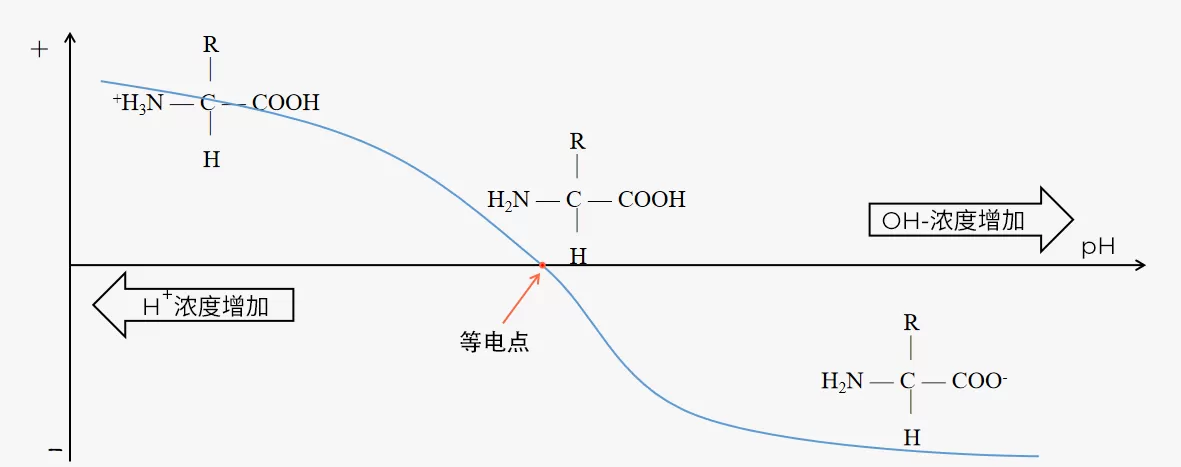
注:當分子所在溶液pH小于分子的pI(等電點)時,分子表面凈電荷為正(+);當分子所在溶液pH大于分子的pI時,分子表面凈電荷為負(-)。
Fig.3 蛋白滴定曲線
Table 1.離子交換層析功能基團

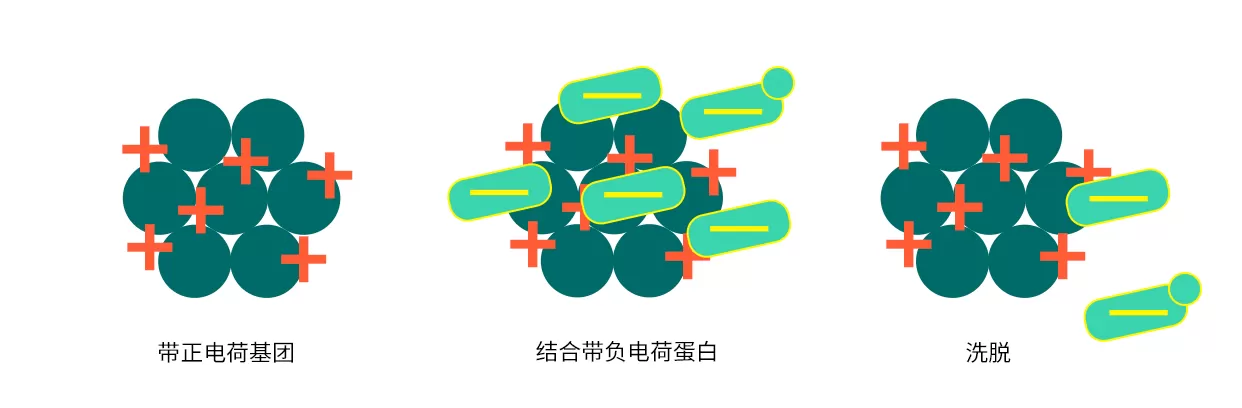
Fig.4 陰離子交換層析過程
• 載量高,適合工業放大
• 分離效率高,應用最廣(約75%的純化流程使用)
缺點
• 需優化pH和鹽濃度
• 需高鹽洗脫,不適用于高鹽條件下不穩定的樣品
典型應用
• 抗體純化中的雜質去除(如HCP、DNA)
• 疫苗抗原的精細純化
• 重組蛋白捕獲和精細純化等
疏水作用層析是根據蛋白表面疏水性的不同,利用蛋白和疏水層析介質疏水表面可逆的相互作用來分離蛋白。選擇疏水作用層析填料的關鍵在于選擇合適疏水強弱的配基,若蛋白質的疏水性較強就需要選擇較弱的疏水填料,反之亦然。
Table 2.疏水層析功能基團

疏水作用介質疏水性強弱表

Fig.5 疏水作用介質疏水性強弱表
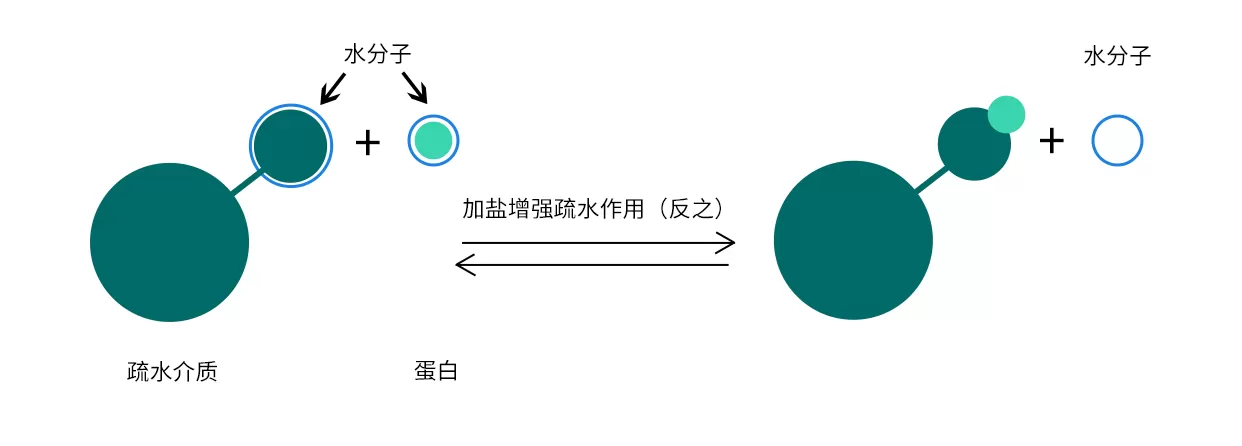
Fig.6 疏水層析過程
• 分辨率高
• “高鹽吸附,低鹽洗脫”的特點使其能直接與其他層析分離技術如鹽析、離子交換等工藝聯合使用
缺點
• 高鹽易引發沉淀,需要合理控制鹽濃度
• 對溫度較敏感:層析開始前建議確認樣品、緩沖液、柱子、層析設備都在相同的溫度
• 洗脫容易拖尾
典型應用
• 適用于根據蛋白疏水性差異分離的捕獲、中度純化和精細純化
• 抗體聚體及片段去除
• ADC純化中的雜質去除
親和層析:識別“特異性結合”
原理
親和層析是一種根據生物分子之間的特異相互作用來分離物質的層析方法,如酶和底物的結合、受體和配體的結合、抗體和抗原的結合等。這類結合既是特異的,又是可逆的。通過這種可逆的結合和分離來達到蛋白純化的目的。親和層析具有高選擇性的特點,可快速從復雜體系中捕獲目的蛋白,通常一步純化就能達到90%以上的純度。
Table 3.親和層析常見配基與底物


Fig.7 親和填料結構
• 基架:多孔球形,使配基附著在基質上,具有理化惰性;
• 間隔臂:克服可能存在的空間位阻效應,改善配基與目標分子的結合;
• 親和配基:可逆地結合特定目標分子或目標基團的分子。
優點vs缺點
• 特異性強,一步純化后純度可達90%以上
• 操作簡便,適合作為第一步捕獲工藝
缺點
• 填料單價相對其他層析填料較高
• 配基脫落風險需控制
典型應用
• 單抗/雙抗生產的初步捕獲
• 標簽蛋白純化
總結
層析純化技術構建了現代生物制藥工藝的“中流砥柱”,而層析填料就是這個工藝階段的關鍵構件。理解層析原理,是掌握純化技術的第一步。未來,我們還將深入解析不同類型填料的選擇技巧、工藝優化思路以及真實案例分享,敬請期待!





