6種細胞因子EC50常用檢測方法介紹
細胞因子(如IL-2、TNF-α、IFN-γ等)是免疫系統中的關鍵信號分子,其活性通常用EC50(半數最大有效濃度)來評估。EC50是指細胞因子達到最大生物學效應一半時所需的濃度,值越小,表明活性越強。
細胞因子EC50通常使用細胞增殖檢測、報告基因檢測、流式檢測、ELISA檢測、生物傳感器及其他方法,下面我們一一介紹相關方法。
01 細胞增殖檢測法(經典生物學活性檢測)
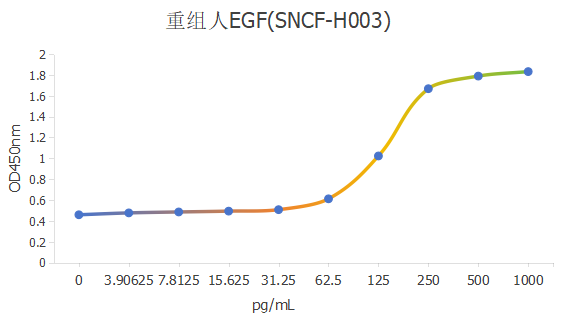
(采用 Balb/C 3T3 細胞增殖檢測,ED50為100-500 pg/mL。)
●原理
某些細胞因子(如IL-2、IL-6)能促進特定細胞系的增殖,通過檢測細胞數量或代謝活性(如CCK-8、MTT法)來計算EC50。
●實驗步驟
細胞培養:選擇依賴目標細胞因子的細胞系(如CTLL-2細胞依賴IL-2)。
梯度稀釋:將細胞因子按不同濃度加入培養體系。
檢測增殖:培養48-72小時后,用CCK-8/MTT法測OD值。
計算EC50:用GraphPad Prism等擬合劑量-反應曲線。
●優缺點
✅ 優點:直接反映生物學活性,結果可靠。
❌ 缺點:耗時長(需細胞培養),易受細胞狀態影響。
02 報告基因檢測法(高通量篩選)
●原理
構建攜帶報告基因(如熒光素酶、GFP)的工程細胞系,細胞因子激活信號通路(如STAT、NF-κB)后誘導報告基因表達,通過熒光/發光強度計算EC50。
●實驗步驟
轉染細胞:用含報告基因的質粒轉染細胞(如HEK293T-STAT3-luc)。
刺激細胞:加入不同濃度細胞因子。
檢測信號:用熒光素酶檢測系統測發光值。
數據分析:擬合曲線計算EC50。
●優缺點
✅ 優點:靈敏度高,適合高通量篩選。
❌ 缺點:需基因工程改造細胞,可能受非特異性信號干擾。
03 流式細胞術檢測(單細胞水平分析)
●原理
某些細胞因子(如IFN-γ)能誘導細胞表面標志物(如MHC-II)或磷酸化蛋白(如p-STAT1)表達,用流式細胞術定量檢測。
●實驗步驟
刺激細胞:用不同濃度細胞因子處理細胞(如THP-1細胞+IFN-γ)。
抗體標記:用熒光抗體檢測目標蛋白(如抗-pSTAT1-PE)。
流式分析:計算MFI(平均熒光強度),擬合EC50。
●優缺點
✅ 優點:單細胞分辨率,可多參數分析。
❌ 缺點:設備昂貴,數據分析復雜。
04 ELISA檢測(蛋白水平定量)
●原理
ELISA(酶聯免疫吸附試驗)可檢測細胞因子濃度,但需注意:ELISA測的是蛋白含量,不一定代表活性!若要測EC50,需結合功能實驗。
●實驗步驟
標準曲線:用重組蛋白梯度稀釋建立標準曲線。
樣本檢測:測待測樣本的OD值,計算濃度。
活性驗證:通常需結合細胞實驗(如增殖或報告基因)。
●優缺點
✅ 優點:操作簡單,適合大批量樣本。
❌ 缺點:無法區分活性與非活性形式(如結合態vs游離態)。
05 生物傳感器技術(新興方法)
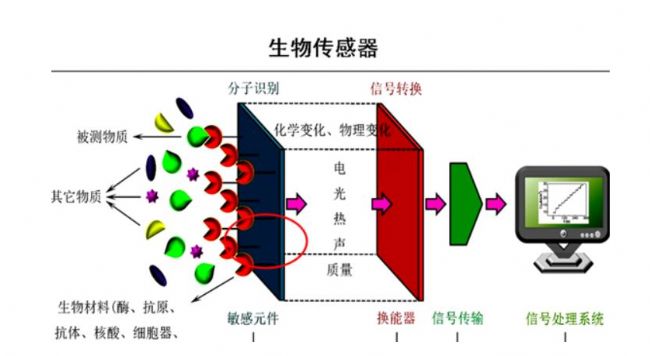
●原理
利用表面等離子共振(SPR)、生物層干涉儀(BLI)等技術,實時監測細胞因子與受體的結合動力學,計算EC50。
●實驗步驟(以SPR為例)
固定受體:將細胞因子受體偶聯至芯片。
注入樣本:不同濃度細胞因子流過芯片。
檢測信號:實時監測結合-解離曲線。
計算EC50:擬合結合動力學數據。
●優缺點
✅ 優點:無需標記,實時監測結合活性。
❌ 缺點:設備昂貴,需優化結合條件。
06 其他檢測方法
qPCR:檢測細胞因子下游基因表達(如SOCS3),間接反映活性。
細胞遷移實驗:適用于趨化因子(如IL-8)的EC50測定。
蛋白質組學/磷酸化組學:全面分析細胞因子調控的分子網絡。
選擇合適的檢測方法,才能準確評估細胞因子的EC50,為藥物研發或基礎研究提供可靠數據!

尚恩生物提供380余種細胞因子,表達系統包括哺乳動物、昆蟲系統、酵母、大腸桿菌,可以提供His、FC等標簽及不帶標簽的細胞因子,目前已經通過各種方法檢測了120余種細胞因子生物活性,活性更有保障,適用于ELISA、WB、抗體制備、細胞培養及其他領域,歡迎垂詢。





