FDA宣布逐步取消動物實驗,加速類器官替代進程
2025年4月10日,美國食品藥品監督管理局(FDA)發布一項具有里程碑意義的政策,宣布將在單克隆抗體(mAb)等藥物開發中,逐步用更具人類相關性的測試方法替代動物實驗。這項舉措不僅加快了新藥審批流程,還降低了研發成本,推進了倫理科學進步,或將重塑全球藥物研發生態。



該法案在美國《聯邦食品、藥品和化妝品法》中新增一項條款,要求FDA制定流程,評估和認證在新藥研發中可使用的“非動物”測試方法,并將通過認證的方法納入藥品注冊審評體系。這項立法為提升新藥研發效率、改善預測效果和踐行科研倫理提供了制度保障。
為什么要推動非動物的“非臨床測試方法”?
在藥物正式進入人體臨床試驗前,必須進行所謂的“非臨床研究”(nonclinical testing),即在體外或動物中評估其安全性和初步有效性。長期以來,這一環節依賴大量動物實驗。但現實中,動物模型往往不能準確反映人類反應,導致:
為什么要推動非動物的“非臨床測試方法”?
在藥物正式進入人體臨床試驗前,必須進行所謂的“非臨床研究”(nonclinical testing),即在體外或動物中評估其安全性和初步有效性。長期以來,這一環節依賴大量動物實驗。但現實中,動物模型往往不能準確反映人類反應,導致:
- 臨床階段失敗率高;
- 藥物開發周期長、成本高;
- 動物使用引發倫理爭議。
因此,科學界與監管機構正在推動更具人類生理相關性的替代方法,如FDA現代化法案中提出的“人類細胞模型、微生理系統、生物3D打印模型、計算機模型”。這些方法在多個研究領域顯示出良好的預測能力,并有望替代部分動物實驗。
* FDA現代化法案詳細解讀:
* FDA現代化法案詳細解讀:

法案主要內容解讀
該法案重點建立以下制度:
1. 認證機制的建立
- FDA需設立流程,讓申請人可提交用于藥品開發的非動物測試方法認證請求;
- 認證方法需滿足兩個標準之一:提高預測性或縮短研發周期;
- 一旦認證通過,申請人可在后續藥品開發與申報中正式使用該方法,并可引用其認證數據。
2. 審評時限和程序
- FDA應在收到申請后180天內作出是否批準的決定;
- 可邀請外部專家或研究聯盟參與評審,確保科學性與透明度;
- 對使用認證方法開發的藥品,FDA將給予優先評審或加速通道。
3. 數據共享與引用機制
- 獲得認證的方法可被申請人或其授權方使用;
- 在提交藥品上市申請時,可直接引用該認證方法及其驗證數據,避免重復動物試驗。
結語
《FDA現代化法案》為所有能夠減少動物使用、提高藥物藥效/安全性預測準確度的測試方法和模型提供了合規入口和激勵機制。它將為新興體外模型、人工智能計算機模型等多樣化非動物方法的研發和轉化打開制度之門。
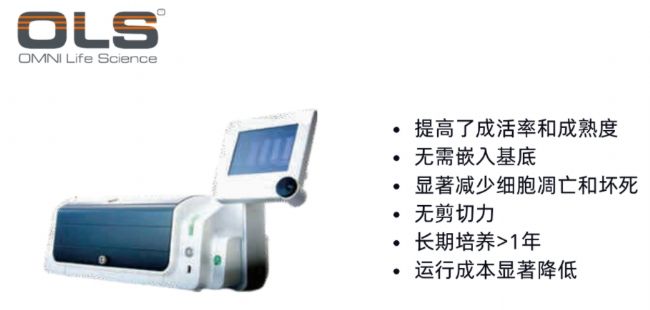
CERO 3D細胞(類器官)生物反應器
OLS OMNI 生命科學:類器官和細胞計數的解決方案

BIO ONE 生物分液系統
【新產品】BIO ONE:3D細胞培養科研新伙伴!
關注我們了解更多

上海跡亞國際商貿有限公司
Gaia China Co.,Ltd.
- 農工黨中央調研組蒞臨迪必爾生物開展專題調研
- 柏恒科技2025年3月質量月活動總結會議圓滿落幕
- 知楚振蕩培養箱、安全柜、超凈臺等入駐科學研究所
- 喜訊:棱鏡泰克流式細胞儀獲CE認證!進軍國際市場
- 科德角國際熱烈歡迎旭化成醫療器械蒞臨開展現場評審
- 理加聯合(LICA)推出科研成果支持基金助力科研
- 關稅加碼,培安發聲:CEM產品價格不受關稅影響
- Eppendorf 新品CO2培養箱搖床斬獲2025年iF設計獎!
- 武漢谷豐光電高通量盆栽表型檢測平臺在華南農大安裝
- 復旦大學瑞孚迪獎學金項目啟動,簽約儀式順利舉行
- GelNEST™基質膠助力應對貿易壁壘下的科研不確定性
- 無懼關稅!韓國派氏全線液基細胞制片產品助力IVD領域
- 關稅波動情況下科茲莫關于穩定供應及品質承諾的聲明
- 東樂自然基因榮獲丹納赫生命科學平臺兩項殊榮
- 艾普拜生物:以全流程解決方案,為科研工作者護航
- FDA宣布逐步取消動物實驗,加速類器官替代進程
- CELLINK網絡研討會:3D生物打印技術如何用于癌癥研究
- 網絡研討會預告:芯片組織與3D打印構建仿生體外模型
- 國內首臺商業化體積打印裝備——OrganSEC成功發布
- 凈信旗下雷萌生物代表ibidi為壽宇峰博士頒發論文獎
- 祝賀進科馳安獲TissueLabs3D生物打印機全國總代
- CELLINK開放生物打印BIO ONE應用及技術說明下載通道
- 永沁泉推出全新升級GelMA水凝膠微球促銷活動
- CELLINK推出全新BIO ONE生物打印機,助力3D細胞培養
- 2024中西部地區生物制造及相關材料發展論壇通知
- 賽多利斯聯手BICO:3D 生物打印打開生命科學新疆域
- EFL參加2023中國生物材料大會,期待“渝”您相遇
- 化學重編程誘導人多能干細胞技術培訓班巡講開啟報名
- 首屆化學重編程誘導人多能干細胞技術培訓班成功召開
- 網絡研討會:微流控和3D生物打印在牙齦再生的應用
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






