空間基因表達+T細胞受體測序探索腦轉移瘤微環境中的免疫活動
「轉移」二字對于任何一個癌癥病人來說都是最不想聽到的壞消息之一。那么醫生口中的轉移究竟是什么呢?醫學上是這樣定義的:當癌細胞從原發腫瘤擴散到身體的其他部位,在之前未接觸過的器官中沉積癌細胞群,在那里不受控制的細胞生長繼續造成傷害。當治療無法控制癌癥發展時,不論在身體還是精神上,患者及其家屬都將面臨更嚴峻的考驗。
// 為什么T細胞浸潤在轉移瘤中尤為重要?
在原發性腫瘤和轉移瘤中,預后高度依賴于腫瘤微環境中的免疫活性。Barnes和Amir在英國癌癥雜志上指出:“‘促炎性’腫瘤微環境和浸潤的CD8表達淋巴細胞與多種腫瘤類型的臨床結果改善有關”[1]。在轉移瘤中也有同樣的發現,有研究分析了25對原發性非小細胞肺癌(NSCLC)標本和腦轉移瘤NSCLC,發現腦轉移灶實質CD8+T細胞的總體密度高于原發灶,且基質中CD8+TIL數量較少的患者預后較差,該研究指出“腦轉移瘤中的腫瘤浸潤淋巴細胞 (TIL) 與預后呈正相關[2]。
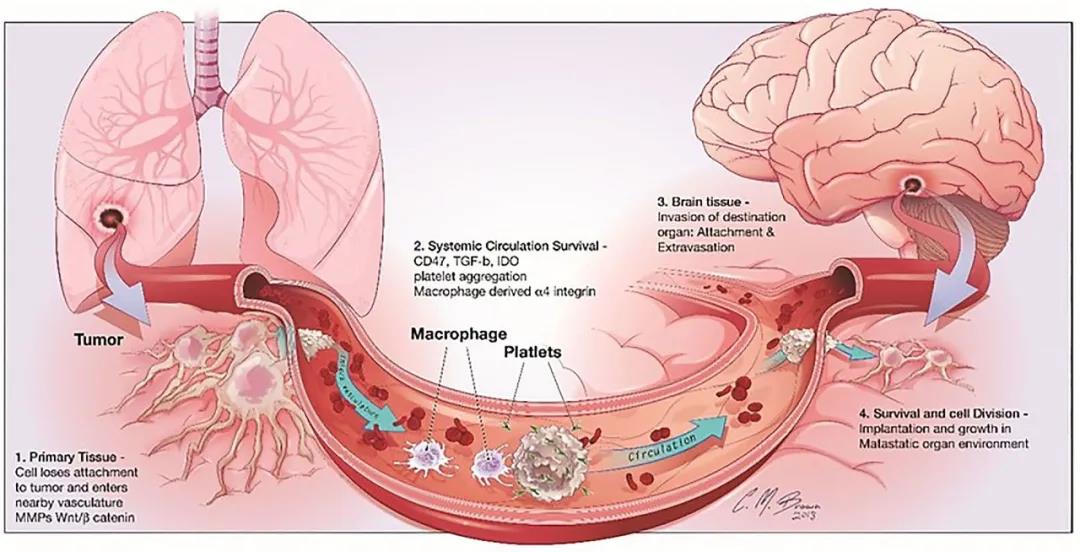
腦轉移級聯反應涉及四個主要步驟[2]:1.轉移細胞從原發癌中脫離,
2.在體循環中存活,3.在腦實質中的侵襲,以及4.在中樞神經系統微環境中的存活。
但是,正如Barnes和Amir所言,并非所有T細胞在腫瘤微環境中都具有相同的積極作用。“其他免疫細胞的抑制功能,例如髓源性抑制細胞和調節性T細胞 (Tregs),似乎在破壞癌癥免疫控制能力方面發揮著重要作用,從而產生更糟糕的結果”[1]。也有其他發現指出癌癥進化和治療耐藥性的模型取決于腫瘤免疫浸潤的組成。邁阿密大學綜合癌癥中心的科學家們使用單細胞測序研究葡萄膜黑色素瘤 (UM) 的腫瘤微環境,發現了在以往研究中未曾與UM聯系起來的特定免疫細胞群。這包括具有替代檢查點標記LAG3的T細胞,其在UM腫瘤中的表達比傳統的CTLA4和PD1標記更廣泛[3]。
因此,區分腫瘤微環境 (TME) 中的T細胞功能狀態、抗原特異性和其他總體特征對于了解癌癥預后至關重要,這也解釋了為什么某些癌癥對治療和轉移沒有反應。但是TIL的分子特征只是一方面,畢竟每種癌癥類型甚至每種特定的腫瘤都具有獨特的特性,可以影響免疫微環境的組成和空間組織。換句話說,腫瘤中免疫細胞浸潤的程度也會影響預后。
在一項三陰性乳腺癌研究中,Visium空間基因表達數據顯示在組織切片中,腫瘤塊周圍有一圈耗盡的T細胞[4]。空間分辨的基因表達可以提供比單獨的病理學注釋更高分辨率的浸潤免疫細胞的鑒定和滲透到癌組織程度的可視化視圖。結果表明浸潤的T細胞群具有的抗腫瘤功效有限。
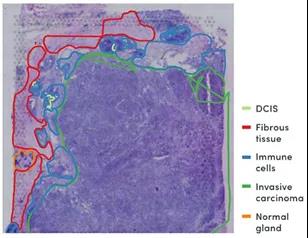
(a)三陰性乳腺癌樣本的病理學注釋。
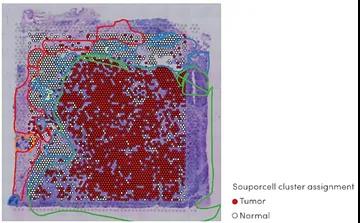
(b)利用基因表達數據,推測每個Visium斑點的基因型為腫瘤或正常。還顯示了重疊的病理學注釋。
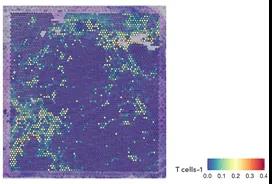
(c)特定T細胞亞型浸潤區域,通過結合Visium空間基因表達和單核RNA-seq數據進行可視化。
在致瘤區域周圍可以看到耗盡的T細胞。
// 空間基因表達和T細胞受體測序的結合研究
這些在對癌癥的免疫反應中發揮作用的復雜因素表明,需要對TME進行全面的了解以統一多維讀數,包括T細胞組成和浸潤的單細胞和空間注釋。William等人在一項研究中通過Visium空間基因表達技術定義T細胞受體 (TCR) 序列,發現T細胞受體序列“決定了淋巴細胞抗原的特異性,并且可以作為淋巴細胞克隆的條形碼”,這是T細胞識別和功能鑒定的關鍵讀數。通過這種方式,可以實現在一次測定中同時顯示組織樣本中的T細胞受體克隆型和整體基因表達[5]。
為此,研究人員修改了在Visium分析中進行的標準cDNA文庫制備步驟。他們將引物添加到TCR序列的5'端,以同時捕獲TCR的可變CDR3區域和包含組織切片內轉錄物位置信息的空間條形碼。此外還修改了文庫清理步驟,標準Visium分析需要對cDNA文庫進行片段化,但在這種情況下,他們通過珠子純化來清理文庫,以保留TCR和空間條形碼序列之間的聯系[5]。
// 多個角度探索腦轉移瘤中的T細胞浸潤
利用這種方法從空間轉錄組學數據中獲取TCR序列,研究團隊對31例腦轉移患者手術切除后的浸潤性CD8+ T細胞及其周圍腫瘤微環境進行了詳細的表征。他們在PD1+ CD8+ T細胞中確定了四個主要的轉錄群體,包括分裂細胞、終分化細胞和兩個與耗盡的祖細胞特征相似的簇。TCR序列的空間解析讀取和基因表達也顯示,每個群體都定位于腦轉移瘤微環境的特定區域,這表明CD8+ 腫瘤浸潤T細胞根據抗原特異性排列[6]。
除了能夠指導潛在的腦轉移免疫治療策略外,這些發現還體現了生物學系統方法的價值,即建立在多組生物學觀點之上,通過從多個參數獲得的信息來揭示細胞異質性。通過將T細胞轉錄特征、空間定位和TCR抗原特異性結合在一起,構建了對適應性免疫過程的最全面的理解。有了這些分析物,科學家們可以繼續在解決腫瘤微環境中復雜的免疫活動和驅動癌癥預后的多維因素方面深入探索。
參考文獻:
-
[1]Barnes T and Amir E. HYPE or HOPE: the prognostic value of infiltrating immune cells in cancer. BJC 117: 451–460 (2017). doi: 10.1038/bjc.2017.220
-
[2]Luo L, et al.The Immune microenvironment in brain metastases of non-small cell lung cancer. Front Oncol 11: 698844 (2021). doi: 10.3389/fonc.2021.698844
-
[3]GenomeWeb and 10x Genomics. White Paper. Using Single-Cell Multiomics to Reveal New Insights Into Uveal Melanoma Evolution and Therapeutic Resistance.
-
[4]10x Genomics. Application Note. Spatially Resolved Heterogeneity of Triple Negative Breast Cancer.
-
[5]Hudson W and Sudmeier L. Localization of T cell clonotypes using spatial transcriptomics. bioRxiv. Posted August 5, 2021. doi: 10.1101/2021.08.03.454999
-
[6]Sudmeier L, et al. The CD8+T cell landscape of human brain metastases. bioRxiv. Posted August 5, 2021. doi: 10.1101/2021.08.03.455000





