聯合應用量子點及熒光發射掃描顯微鏡技術的腫瘤轉移示蹤
腫瘤轉移是實現腫瘤有效治療的一大障礙,而目前有關腫瘤轉移(特別是侵潤Extravasation)過程的認識非常有限。主要原因是參與腫瘤轉移的多細胞、多分子之間的相互作用復雜,腫瘤轉移過程難以實現在體示蹤。隨著新技術的發展,熒光顯微鏡成像可實現對細胞的高分辨示蹤;而量子點作為新型熒光探針,具有熒光亮度高、穩定性好、適于多色成像等優勢,相較于傳統有機熒光探針更適合長期動態觀測。美國洛克菲勒大學Sanford M Simon課題組,聯合應用量子點和發射光譜掃描多光子顯微鏡成像技術,實現了在體腫瘤侵潤轉移的示蹤觀察。
Evelyn B Voura等發現,量子點標記對體外培養的腫瘤細胞沒有明顯的毒性作用,將量子點標記的腫瘤細胞靜脈注射入小鼠體內,與未標記細胞的侵潤轉移行為沒有明顯區別(圖1);另外,利用多光子激光器的激發,對量子點進行光譜掃描和成像,可實現五個不同群體細胞的同時觀察(圖2)。總之,該項研究在建立量子點的安全的在體研究方法之外,尚可用于開展在體多細胞的相互作用研究。
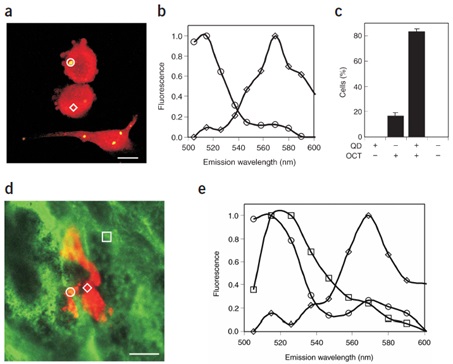
圖1 以量子點對腫瘤細胞進行細胞內標記并在體成像
(a) 應用DNA轉染試劑Lipofectamine2000,使腫瘤細胞B16F10被DHLA加帽的510nm量子點(黃)標記,腫瘤細胞則被標志物染為紅色;(b) 利用發射掃描共聚焦顯微鏡,應用META檢測器,獲取細胞內量子點(圓形)及細胞標志物(菱形)的熒光值(488nm激發);(c) 應用Lipofectamine2000使>80%的腫瘤細胞被量子點標記;(d) 同時被量子點(黃)和標志物(紅)標記的腫瘤細胞,注射入小鼠尾靜脈,5h后對肺組織進行固定和包埋,并將內皮細胞標記為綠色。以1mm光學切片對肺組織包埋樣品進行三維投影;(e) 對510nm量子點(圓形)、腫瘤標志物(菱形)以及內皮細胞標志物(方形)進行發射光譜掃描。
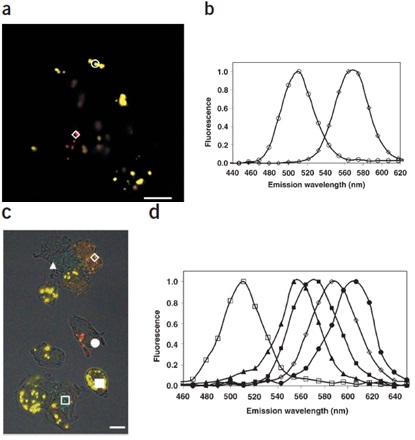
圖2 發射掃描多光子顯微鏡可區分至少5個細胞群
(a) B16F10腫瘤細胞被標記不同量子點,混合后經尾靜脈注射入小鼠體內,5h后制備肺組織包埋切片,以發射掃描多光子顯微鏡對細胞成像;(b) 由多光子成像獲得相應區域的發射光譜掃描數值(圓形指示510nm量子點,菱形指示570nm量子點);(c) 以5種不同量子點(510/550/570/590/610nm)分別標記腫瘤細胞,混合后接種于玻片培養,以發射掃描多光子顯微鏡成像;(d) 以10nm帶寬進行發射光譜掃描的數據。
文獻來源:
Voura EB, Jaiswal JK, Mattoussi H, Simon SM. Tracking metastatic tumor cell extravasation with quantum dot nanocrystals and fluorescence emission-scanning microscopy. Nat Med. 2004;10(9):993-8.





