延長半衰期且可作為藥物靶點:FcRn在藥物開發中的廣泛應用
近期,基于FcRn特性開發的新藥在中國迎來諸多進展。9月底,和鉑醫藥全人源抗FcRn抗體巴托利單抗在針對全身型重癥肌無力(gMG)的3期注冊臨床中,完成首例患者給藥。11月4日,翰思生物及原旗下泰州翰中生物開發的人源化抗PD-1單克隆抗體HX008用于治療MSI-H/dMMR實體瘤的上市申請正式被CDE納入優先審評審批,該抗體利用了FcRn改造技術進行了差異化設計,在IgG4的Fc改造以延長半衰期。隨著科學界對FcRn生物學功能研究的不斷深入,FcRn在藥物開發中的前景被廣泛認可。
FcRn的轉運保護機制
在五種類型的免疫球蛋白(IgA、IgD、IgE、IgG和IgM)中,IgG在人體血清中的含量是最多的(約占Ig的75%)。IgG是機體病原體和抗毒素的重要成分,在機體免疫反應中起到了重要作用。此外,IgG是已知的能從母體轉移至胎兒,從而使胎兒獲得短期被動免疫能力的抗體。而這種IgG的特異性轉運是由neonatal Fc receptor(FcRn)所介導。FcRn能保護IgG和白蛋白在細胞內“不被降解”,并將其釋放回血液循環中。
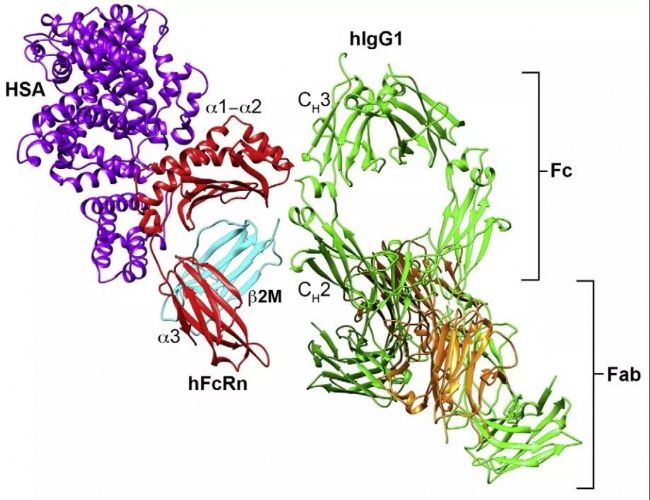
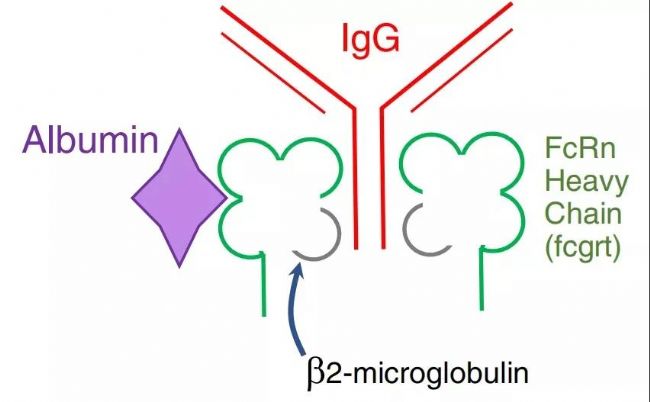
圖1. FcRn與IgG和白蛋白結合的結構示意圖[1-2]。
上圖:人IgG1(綠色)通過其Fc端CH2–CH3域與FcRn的α2域(紅色)和β2M(藍色)的N端相結合。人血清白蛋白(紫色)在其他結合域與FcRn結合。下圖:平衡條件下,FcRn與IgG以2:1的比例結合;白蛋白在其他位點與FcRn以1:1的比例結合。
FcRn在體內許多組織的上皮細胞、內皮細胞及多種免疫細胞(如單核巨噬細胞)中廣泛表達。其中,血管內皮細胞是FcRn保護IgG免于被分解代謝的主要部位。在這些地方,FcRn與血液的接觸面積很大。當血管內皮細胞大量內吞血清中的蛋白時,FcRn可以有效地攔截IgG并將其返還到血液循環中,從而延長血清中IgG的半衰期。FcRn與IgG的結合是pH依賴性的:它們只在酸性條件(pH6.0-6.5)下結合,在中性(pH7.0-7.5)條件下解離。因此,在酸化的內體(endosome)中,IgG能與FcRn有效結合,并跟隨FcRn被轉運至細胞膜表面。由于細胞外血液的pH值為微堿性(pH7.35-7.45),IgG與FcRn解離,被“回收”至血液循環中。此外,FcRn對血清白蛋白(serum albumin, SA)的保護機制與IgG相同,也為pH依賴性。且SA在人血清中的半衰期很長,約有20天。
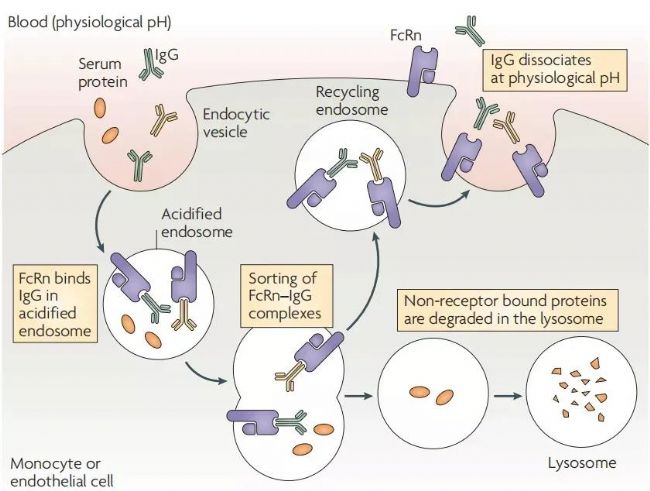
圖2. FcRn對IgG的轉運保護機制[3]。
FcRn在血管內皮細胞和循環中的單核細胞上均有表達。這些細胞通過內吞作用,將血清中的IgG攝入細胞內,IgG與FcRn在酸化的內體中結合。沒能與FcRn結合的蛋白會在溶酶體中被降解,而與FcRn結合的IgG則會被釋放回血液循環中,從而延長其半衰期。
利用FcRn的轉運保護機制開發新一代藥物
很多藥物利用FcRn對IgG和SA的保護機制,與IgG的Fc或SA進行融合/偶聯來延長其血清半衰期,改善藥代動力學。或者更進一步,對Fc和SA進行改造,提高其與FcRn的結合力后,再與藥物進行融合/偶聯。例如,用于治療牛皮癬的Amevive (alefacept),治療類風濕關節炎的Enbrel (etanercept)、治療免疫性血小板減少癥(ITP)的Nplate (romiplostim)等,都通過與hIgG1的Fc進行偶聯來達到延長血清半衰期的目的。此外,用于治療II型糖尿病的藥物Tanzeum(albiglutide)、治療B型血友病的Albutrepenonacog alfa (Idelvion)等,則通過與SA進行偶聯來延長藥物血清半衰期。
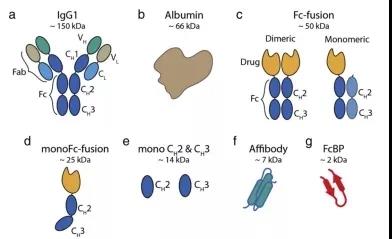
圖3. 利用FcRn保護機制的各種融合蛋白示意圖[3]。
(a)全長IgG1;(b)白蛋白;(c)與Fc進行融合;(d)與單體Fc融合;(e) 與單體Fc的CH2和CH3融合;(f) 與經改造后與FcRn結合力更強的affibody融合; (g)與IgG Fc-binding peptide(FcBP)融合。
此外,基于FcRn的特性,還有一個重要的研發方向,就是通過研發藥物來抑制內源性FcRn與IgG的結合,從而治療由自身抗體(autoantibody)驅動的自身免疫性疾病。在自身抗體驅動的疾病中,機體的抗體攻擊或損傷自身的蛋白質、細胞和組織,往往造成毀滅性的后果。目前,已有多種FcRn抑制劑正處于臨床試驗階段。例如,前文提到的和鉑醫藥全人源抗FcRn抗體巴托利單抗;荷蘭生物技術公司Argenx的Efgartigimod已處于治療廣義重癥肌無力(gMG)的phase 3階段;優時比(UCB)公司的Rozanolixizumab也已處于治療gMG和ITP的phase 3階段。不久的將來,希望能看到更多有效藥物的上市,為患者們帶來福音。
FcRn/SA雙人源化小鼠
為了助力靶向FcRn小分子和抗體藥物研發,賽業生物引進了FcRn/SA雙人源化小鼠模型,能準確地預測藥代動力學。
FcRn/血清白蛋白(SA)雙人源化小鼠-AlbuMusTM模型
品系背景:C57BL/6N
AlbuMusTM品系說明:
在以前建立的白蛋白人源化模型中,hSA的表達不符合正常的生理水平及表達模式。通過對白蛋白復合物成熟過程及與FcRn表達和調控的模式進行深入分析,建立了SA/FcRn雙人源化模型,該模型hSA的生理水平和hFcRn的表達模式符合正常生理水平。
■ 人源化SA和人源化FcRn由各自的內源性小鼠啟動子驅動,取代了小鼠體內對應的基因表達。
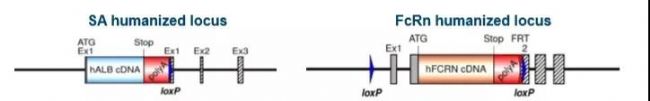
■ 在AlbuMusTM中人白蛋白的表達處于正常生理水平(1.5-6g/dL),血液化學檢測小鼠體內人白蛋白表現正常。
■ AlbuMusTM小鼠的血液化學實驗數據與野生型相似。
■ AlbuMusTM,雙人源化FcRn/白蛋白小鼠模型表現出正常的白蛋白相關藥物和生物制劑所需的自體人受體/配體相互作用(它們的半衰期與在非人類靈長類動物中獲得的數據相關)。
■ AlbuMusTM模擬了人體的生理狀態,因此在和SA可逆結合蛋白相關藥物和常規藥物的生物制劑的開發中有著廣泛的應用。
■ 雙重人源化FcRn/白蛋白小鼠模型是研究白蛋白相關藥物PK/PD的獨特工具。
模型驗證:
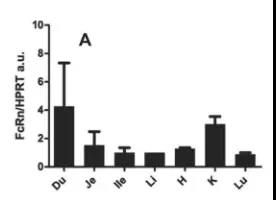

圖1. 人源FcRn的表達符合正常生理水平。
A)用qPCR法分析人源SA/FcRn小鼠組織標本中的hFcRn的表達。發現hFcRn在十二指腸(Du)、空腸(Je)、回腸(iLe)、大腸(Li)、肝(H)、腎(K)、肺(Lu)中都有表達。B)人源SA/FcRn小鼠(大圖)和野生型小鼠(小圖)中hFcRn的免疫組化染色。野生型小鼠對FcRn無交叉反應(小圖)。

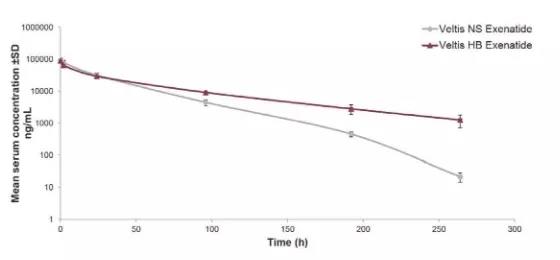
圖2. 在我們的雙重人源SA/FcRn小鼠中,與人白蛋白結合的藥物的半衰期得以延長。上圖)白蛋白結合藥物1:對hFcRn的親和力低;下圖)白蛋白結合藥物2:對hFcRn的親和力高。

圖3. 與野生型小鼠相比,與Veltis®結合的藥物(Exenatide)在AlbuMusTM小鼠體內的半衰期延長了一倍;在AlbuMusTM小鼠中,與HB-Veltis®偶聯的Exenatide的半衰期比與第一代技術偶聯的Exenatide的半衰期延長了一倍(Veltis®NS)。因此,該化合物的半衰期延長是由于提高了Veltis®對人類FcRn的高親和力。
引用文獻精選:
Viuff D, Antunes F, Evans L, et al. Generation of a double transgenic humanized neonatal Fc receptor (FcRn)/albumin mouse to study the pharmacokinetics of albumin-linked drugs. Journal of Controlled Release, 2016: 22-30.
參考文獻:
[1] Baldwin W.M. 3rd, Valujskikh A., Fairchild R.L. The neonatal Fc receptor: Key to homeostasic control of IgG and IgG-related biopharmaceuticals. Am J Transplant. 19(7):1881-1887 (2019).
[2] Sockolosky J.T. and Szoka F.C. The neonatal Fc receptor, FcRn, as a target for drug delivery and therapy. Advanced Drug Delivery Reviews. 91: 109–24 (2015).
[3] Roopenian D.C. and Akilesh S. FcRn: the neonatal Fc receptor comes of age. Nat Rev Immunol. 7(9):715-25 (2007).





